河北省定州市2018届高三化学毕业班上学期第三次月考试题
文档属性
| 名称 | 河北省定州市2018届高三化学毕业班上学期第三次月考试题 |  | |
| 格式 | zip | ||
| 文件大小 | 459.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-15 15:05:14 | ||
图片预览



文档简介
2017-2018学年第一学期高三第3次月考化学试卷
一、单选题
1.下列各物质或微粒性质的比较中正确的是( )
A. 熔点:H2O<I2<SiO2<KCl
B. 粒子半径:K+>Na+>Mg2+>Al3+
C. 酸性:H2SO4>HClO4>H3PO4>H2SiO3
D. 稳定性:H2O<NH3<PH3<SiH4
2.下列说法中,不正确的是( )
A. 胶体与溶液的本质区别是丁达尔效应
B. 氯化铁溶液可应急止血,利用的是胶体的聚沉
C. 用一束平行光线入射淀粉溶液里,从侧面可以观察到一条光亮的通路
D. 将稀硫酸逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解
3.下列判断错误的是 ( )
①反应NH3(g)+HCl(g) ══ NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s) ══ CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l) ══ Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g) ══ 2CO(g)不能自发进行,则该反应的ΔH>0
A. ①③ B. ②③ C. ②④ D. ①②
4.已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
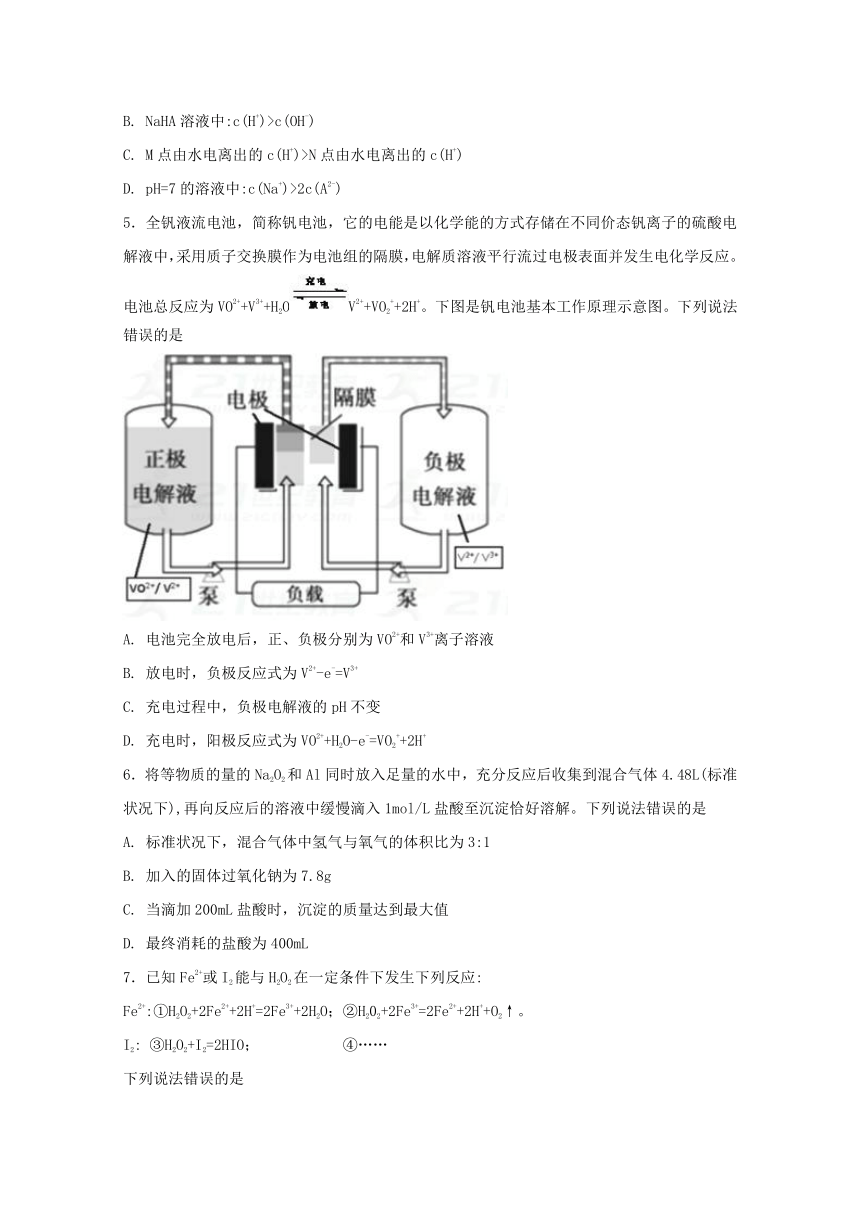
5.全钒液流电池,简称钒电池,它的电能是以化学能的方式存储在不同价态钒离子的硫酸电解液中,采用质子交换膜作为电池组的隔膜,电解质溶液平行流过电极表面并发生电化学反应。电池总反应为VO2++V3++H2OV2++VO2++2H+。下图是钒电池基本工作原理示意图。下列说法错误的是
A. 电池完全放电后,正、负极分别为VO2+和V3+离子溶液
B. 放电时,负极反应式为V2+-e-=V3+
C. 充电过程中,负极电解液的pH不变
D. 充电时,阳极反应式为VO2++H2O-e-=VO2++2H+
6.将等物质的量的Na2O2和Al同时放入足量的水中,充分反应后收集到混合气体4.48L(标准状况下),再向反应后的溶液中缓慢滴入1mol/L盐酸至沉淀恰好溶解。下列说法错误的是
A. 标准状况下,混合气体中氢气与氧气的体积比为3:1
B. 加入的固体过氧化钠为7.8g
C. 当滴加200mL盐酸时,沉淀的质量达到最大值
D. 最终消耗的盐酸为400mL
7.已知Fe2+或I2能与H2O2在一定条件下发生下列反应:
Fe2+:①H2O2+2Fe2++2H+=2Fe3++2H2O;②H202+2Fe3+=2Fe2++2H++O2↑。
I2: ③H2O2+I2=2HIO; ④……
下列说法错误的是
A. 通过反应①②可知Fe2+为过氧化氢分解的催化剂
B. 根据反应①可知,在该条件下,氧化性:H2O2>Fe3+
C. 1molH202分解,转移的电子数为2NA
D. 反应④为2HIO+H2O2=I2+2H2O+O2↑
8.S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键
S-S
S-Cl
Cl-Cl
键能/kJ/mol
a
b
c
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为:
C. y=2b-a-c D. 在S2(1)+2Cl2(g)2SCl2(g)的反应中,△H=(x+y)kJ/mol
9.下列解释事实的化学用语错误的是
A. 盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞:SiO2+20H-=SiO32-+H2O
B. 酸雨的pH小于5.6:CO2+H2OH2CO3H++HCO3-
C. 澄清石灰水中加入过量小苏打溶液出现浑浊:Ca2++2HCO3-+20H-+CaCO3↓+CO32-+2H2O
D. 在AlCl3溶液中加入过量氨水仍有浑浊Al3++3NH3·H2O==Al(OH)3↓+?3NH4+
10.萜类化合物是天然物质中最多的一类物质,有些具有较强的香气和生理活性。某些萜类化合物可以相互转化。下列说法错误的是
A. 香叶醛的分子式为C10H16O
B. 香叶醇和香茅醛互为同分异构体
C. 上述四种物质均能使酸性高锰酸钾溶液或溴水褪色
D. 香茅醇可以发生取代反应加成反应及氧化反应,但是不能发生还原反应
11.为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是
A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
12.过碳酸钠是过氧化氢与碳酸钠通过反应得到的一种固体物质,具有双氧水的性质,主要用作漂白剂和氧化剂、去污剂、清洗剂以及杀菌剂,一种制备过碳酸钠的工艺如下。下列说法正确的是
A. 过碳酸钠是混合物
B. 为了加快反应速率,应该在高温下进行反应,再冷却析出更多过碳酸钠
C. 稳定剂使碱性溶液转化为酸性溶液,让过碳酸钠更稳定
D. 操作a应该是过滤、洗涤
13.下列体系中,离子可能大量共存的是
A. 滴加KSCN显红色的溶液:NH4+、K+、Cl-、HCO3-
B. 常温下,水电离出的c(H+)=1×10-12mol/L的溶液:Fe2+、Mg2+、SO42-、NO3-
C. 使酚酞试剂显红色的溶液:Na+、Ba2+、NO3-、A1O2-
D. 加入Al能产生H2的溶液:K+、NH4+、CH3COO-、Cl-
14.下列实验操作、现象及相应结论正确的是
选项
实验
现象
结论
A
向有少量铜粉的Cu(NO3)2溶液中滴入稀硫酸
铜粉逐渐溶解
稀硫酸能与铜单质反应
B
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
C
向氯化钙和氨水的混合溶液中通入少量CO2气体
有白色沉定产生
沉淀为CaCO3
D
向某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NH4+
A. A B. B C. C D. D
15.X、Y、Z、W是原子序数依次增大的短周期主族元素,经常在食品包装袋中充入Y的单质气体延缓食品的腐败,由X、W形成的种化合物与Z、W形成的一种化合物反应,生成淡黄色固体。下列说法正确的是
A. 原子半径的大小顺序: r(Y)>r(Z)>r(W)
B. 上述四种元素可以形成阴、阳离子数之比为1:1的离子化合物
C. 简单气态氢化物的稳定性:Y>Z
D. 单质沸点:X>Y>Z
16.设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 0.5mol/LCuCl2溶液中含有的Cl-数目为NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 标准状况下,H2和CO混合气体4.48L在足量O2中充分燃烧消耗O2分子数为0.1NA
D. 在反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,消耗1molCl2时转移的电子总数为1.5NA
17.下列有关基本营养物质和资源的说法中,正确的是
A. 煤的气化是物理变化,也是高效、清洁利用煤的重要途径
B. 乙醇汽油是一种新型化合物
C. 食物纤维素在人体内不能被吸收利用,却是健康饮食不可或缺的一部分
D. 糖类、油脂、蛋白质是人体基本营养物质,均属于高分子化合物
18.山西博物院是太原市地标性建筑之一,下列相关说法正确的是
A. 展柜使用的钢化玻璃,其主要成分只有SiO2
B. 墙体使用的砖瓦、水泥,是硅酸盐材料
C. 陈列的元青花瓷的原料有高岭土[Al2Si2O5(OH)4],也可以表示为Al2O3·SiO2·H20
D. 展示的青铜器上有一层绿色物质可能是碱式碳酸铜,此绿色物质不溶于盐酸
19.现有100ml 3mol/L的NaOH溶液和100ml1mol/L的AlCl3溶液。按以下两种方法进行实验:
i)将NaOH溶液分多次加入到AlCl3溶液
ii)将AlCl3溶液分多次加入到NaOH溶液中。比较两次实验的结果是:()
A. 现象相同,最终得到沉淀的质量相等 B. 现象不同,最终得到沉淀的质量相等
C. 现象相同,最终得到沉淀的质量不相等 D. 现象不同,最终得到沉淀的质量不相等
20.广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置.下列各图中能用作防倒吸安全瓶的是( )
A. B. C. D.
二、计算题
21.规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为 _____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b= ____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 mol?L-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
三、推断题
22.多沙唑嗪盐酸盐是一种用于治疗高血压的药物。多沙唑嗪的合成路线如下:
(1) A分子结构中在一个面上最多有________个原子。D→E 发生的化学反应类型是_______。 D 中含有的官能团名称是________。
(2)B→C的化学方程式是______. (K2CO3 在方程式中作催化剂)
(3)满足下列条件①和②的D的同分异构体的个数为________。
写出一种同时满足下列条件①②③的同分异构体的结构简式_________。
①苯的衍生物,且苯环上只有两种处于对位的取代基
②分子结构中含羧基,且该物质能发生银镜反应
③水解后的产物才能与FeCl3溶液发生显色反应
(4)E→F的反应中还可能生成一种有机副产物,该副产物的结构简式为________。
(5)由F制备多沙唑嗪的反应中要加入试剂X (C10H10N3O2Cl),X的结构简式为 ________。
参考答案
BADCC DCCBD CDCCB ACBBB
21. 106:1 2×10-11 1:10 9:101 a+b=14 求混合溶液pH时,若混合后溶液呈酸性直接计算氢离子浓度,再求pH,若溶液呈碱性,先计算氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再计算pH
22. 7 取代反应 醚键、羧基 9种
一、单选题
1.下列各物质或微粒性质的比较中正确的是( )
A. 熔点:H2O<I2<SiO2<KCl
B. 粒子半径:K+>Na+>Mg2+>Al3+
C. 酸性:H2SO4>HClO4>H3PO4>H2SiO3
D. 稳定性:H2O<NH3<PH3<SiH4
2.下列说法中,不正确的是( )
A. 胶体与溶液的本质区别是丁达尔效应
B. 氯化铁溶液可应急止血,利用的是胶体的聚沉
C. 用一束平行光线入射淀粉溶液里,从侧面可以观察到一条光亮的通路
D. 将稀硫酸逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解
3.下列判断错误的是 ( )
①反应NH3(g)+HCl(g) ══ NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s) ══ CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l) ══ Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g) ══ 2CO(g)不能自发进行,则该反应的ΔH>0
A. ①③ B. ②③ C. ②④ D. ①②
4.已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
5.全钒液流电池,简称钒电池,它的电能是以化学能的方式存储在不同价态钒离子的硫酸电解液中,采用质子交换膜作为电池组的隔膜,电解质溶液平行流过电极表面并发生电化学反应。电池总反应为VO2++V3++H2OV2++VO2++2H+。下图是钒电池基本工作原理示意图。下列说法错误的是
A. 电池完全放电后,正、负极分别为VO2+和V3+离子溶液
B. 放电时,负极反应式为V2+-e-=V3+
C. 充电过程中,负极电解液的pH不变
D. 充电时,阳极反应式为VO2++H2O-e-=VO2++2H+
6.将等物质的量的Na2O2和Al同时放入足量的水中,充分反应后收集到混合气体4.48L(标准状况下),再向反应后的溶液中缓慢滴入1mol/L盐酸至沉淀恰好溶解。下列说法错误的是
A. 标准状况下,混合气体中氢气与氧气的体积比为3:1
B. 加入的固体过氧化钠为7.8g
C. 当滴加200mL盐酸时,沉淀的质量达到最大值
D. 最终消耗的盐酸为400mL
7.已知Fe2+或I2能与H2O2在一定条件下发生下列反应:
Fe2+:①H2O2+2Fe2++2H+=2Fe3++2H2O;②H202+2Fe3+=2Fe2++2H++O2↑。
I2: ③H2O2+I2=2HIO; ④……
下列说法错误的是
A. 通过反应①②可知Fe2+为过氧化氢分解的催化剂
B. 根据反应①可知,在该条件下,氧化性:H2O2>Fe3+
C. 1molH202分解,转移的电子数为2NA
D. 反应④为2HIO+H2O2=I2+2H2O+O2↑
8.S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键
S-S
S-Cl
Cl-Cl
键能/kJ/mol
a
b
c
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为:
C. y=2b-a-c D. 在S2(1)+2Cl2(g)2SCl2(g)的反应中,△H=(x+y)kJ/mol
9.下列解释事实的化学用语错误的是
A. 盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞:SiO2+20H-=SiO32-+H2O
B. 酸雨的pH小于5.6:CO2+H2OH2CO3H++HCO3-
C. 澄清石灰水中加入过量小苏打溶液出现浑浊:Ca2++2HCO3-+20H-+CaCO3↓+CO32-+2H2O
D. 在AlCl3溶液中加入过量氨水仍有浑浊Al3++3NH3·H2O==Al(OH)3↓+?3NH4+
10.萜类化合物是天然物质中最多的一类物质,有些具有较强的香气和生理活性。某些萜类化合物可以相互转化。下列说法错误的是
A. 香叶醛的分子式为C10H16O
B. 香叶醇和香茅醛互为同分异构体
C. 上述四种物质均能使酸性高锰酸钾溶液或溴水褪色
D. 香茅醇可以发生取代反应加成反应及氧化反应,但是不能发生还原反应
11.为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是
A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
12.过碳酸钠是过氧化氢与碳酸钠通过反应得到的一种固体物质,具有双氧水的性质,主要用作漂白剂和氧化剂、去污剂、清洗剂以及杀菌剂,一种制备过碳酸钠的工艺如下。下列说法正确的是
A. 过碳酸钠是混合物
B. 为了加快反应速率,应该在高温下进行反应,再冷却析出更多过碳酸钠
C. 稳定剂使碱性溶液转化为酸性溶液,让过碳酸钠更稳定
D. 操作a应该是过滤、洗涤
13.下列体系中,离子可能大量共存的是
A. 滴加KSCN显红色的溶液:NH4+、K+、Cl-、HCO3-
B. 常温下,水电离出的c(H+)=1×10-12mol/L的溶液:Fe2+、Mg2+、SO42-、NO3-
C. 使酚酞试剂显红色的溶液:Na+、Ba2+、NO3-、A1O2-
D. 加入Al能产生H2的溶液:K+、NH4+、CH3COO-、Cl-
14.下列实验操作、现象及相应结论正确的是
选项
实验
现象
结论
A
向有少量铜粉的Cu(NO3)2溶液中滴入稀硫酸
铜粉逐渐溶解
稀硫酸能与铜单质反应
B
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
C
向氯化钙和氨水的混合溶液中通入少量CO2气体
有白色沉定产生
沉淀为CaCO3
D
向某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NH4+
A. A B. B C. C D. D
15.X、Y、Z、W是原子序数依次增大的短周期主族元素,经常在食品包装袋中充入Y的单质气体延缓食品的腐败,由X、W形成的种化合物与Z、W形成的一种化合物反应,生成淡黄色固体。下列说法正确的是
A. 原子半径的大小顺序: r(Y)>r(Z)>r(W)
B. 上述四种元素可以形成阴、阳离子数之比为1:1的离子化合物
C. 简单气态氢化物的稳定性:Y>Z
D. 单质沸点:X>Y>Z
16.设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 0.5mol/LCuCl2溶液中含有的Cl-数目为NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 标准状况下,H2和CO混合气体4.48L在足量O2中充分燃烧消耗O2分子数为0.1NA
D. 在反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,消耗1molCl2时转移的电子总数为1.5NA
17.下列有关基本营养物质和资源的说法中,正确的是
A. 煤的气化是物理变化,也是高效、清洁利用煤的重要途径
B. 乙醇汽油是一种新型化合物
C. 食物纤维素在人体内不能被吸收利用,却是健康饮食不可或缺的一部分
D. 糖类、油脂、蛋白质是人体基本营养物质,均属于高分子化合物
18.山西博物院是太原市地标性建筑之一,下列相关说法正确的是
A. 展柜使用的钢化玻璃,其主要成分只有SiO2
B. 墙体使用的砖瓦、水泥,是硅酸盐材料
C. 陈列的元青花瓷的原料有高岭土[Al2Si2O5(OH)4],也可以表示为Al2O3·SiO2·H20
D. 展示的青铜器上有一层绿色物质可能是碱式碳酸铜,此绿色物质不溶于盐酸
19.现有100ml 3mol/L的NaOH溶液和100ml1mol/L的AlCl3溶液。按以下两种方法进行实验:
i)将NaOH溶液分多次加入到AlCl3溶液
ii)将AlCl3溶液分多次加入到NaOH溶液中。比较两次实验的结果是:()
A. 现象相同,最终得到沉淀的质量相等 B. 现象不同,最终得到沉淀的质量相等
C. 现象相同,最终得到沉淀的质量不相等 D. 现象不同,最终得到沉淀的质量不相等
20.广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置.下列各图中能用作防倒吸安全瓶的是( )
A. B. C. D.
二、计算题
21.规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为 _____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b= ____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 mol?L-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
三、推断题
22.多沙唑嗪盐酸盐是一种用于治疗高血压的药物。多沙唑嗪的合成路线如下:
(1) A分子结构中在一个面上最多有________个原子。D→E 发生的化学反应类型是_______。 D 中含有的官能团名称是________。
(2)B→C的化学方程式是______. (K2CO3 在方程式中作催化剂)
(3)满足下列条件①和②的D的同分异构体的个数为________。
写出一种同时满足下列条件①②③的同分异构体的结构简式_________。
①苯的衍生物,且苯环上只有两种处于对位的取代基
②分子结构中含羧基,且该物质能发生银镜反应
③水解后的产物才能与FeCl3溶液发生显色反应
(4)E→F的反应中还可能生成一种有机副产物,该副产物的结构简式为________。
(5)由F制备多沙唑嗪的反应中要加入试剂X (C10H10N3O2Cl),X的结构简式为 ________。
参考答案
BADCC DCCBD CDCCB ACBBB
21. 106:1 2×10-11 1:10 9:101 a+b=14 求混合溶液pH时,若混合后溶液呈酸性直接计算氢离子浓度,再求pH,若溶液呈碱性,先计算氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再计算pH
22. 7 取代反应 醚键、羧基 9种
同课章节目录
