物质的转化规律[下学期]
图片预览









文档简介
课件30张PPT。第二节 物质转化的规律一、非金属单质与其化合物转化
实验一:硫在氧气中的燃烧
硫在空气中燃烧的现象:
硫在氧气中燃烧的现象:
反应化学方程式为:
1、非金属单质转化为相应的化合物 点燃
S + O2 ===== SO2发出淡蓝色的火焰,放出热量,生成有刺激性气味
(有毒)的气体。发出明亮的蓝紫色火焰,放出热量,生成有刺激性气味
(有毒)的气体。讨论:
为除去二氧化硫,在实验结束后,可以用什么溶液吸收?
讨论: 通过以上实验,说明非金属单质在一定的条件下(在空气或氧气中燃烧)可转化为相应的化合物。你还知道哪些非金属单质可以转化为相应的化合物?
高温 点燃
如:C + O2 ==== CO2
点燃
4P + 5O2 ===== 2P2O5 (除去空气中的氧气)
点燃
2H2 + O2 ===2H2O(氢气是最清洁、最理想的能源)
补充:C + CO2 ===== 2CO (不完全燃烧)
实验二:
蒸馏水+紫色石蕊试液:
蒸馏水+CO2+紫色石蕊试液:
原因:CO2溶于水生成碳酸 CO2 + H2O == H2CO3
加热后:红色溶液逐渐变成紫色溶液。
原因:
2、非金属氧化物与水反应生成酸(除SiO2)
S→SO2→H2SO3→H2SO4 △
H2CO3 === CO2↑+ H2O紫色石蕊试液不变色
紫色石蕊试液变红色 点燃
1 、 S + O2 ==SO22、SO2+H2O=H2SO33、2H2SO3+O2=2H2SO4酸雨的形成原因讨论:
你认为正常降水是碱性、中性还是酸性?为什么?
用化学方程式表示下列物质间的转化:
C→CO2→H2CO3 CaCO3
讨论:你知道通过哪些方法可以使酸转化成盐,写出 使盐酸转化成氯化锌的四种方法。
Zn + 2HCl = ZnCl2 + H2↑
ZnO + 2HCl = ZnCl2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
ZnCO3 + 2HCl = ZnCl2 + H2O + CO2↑
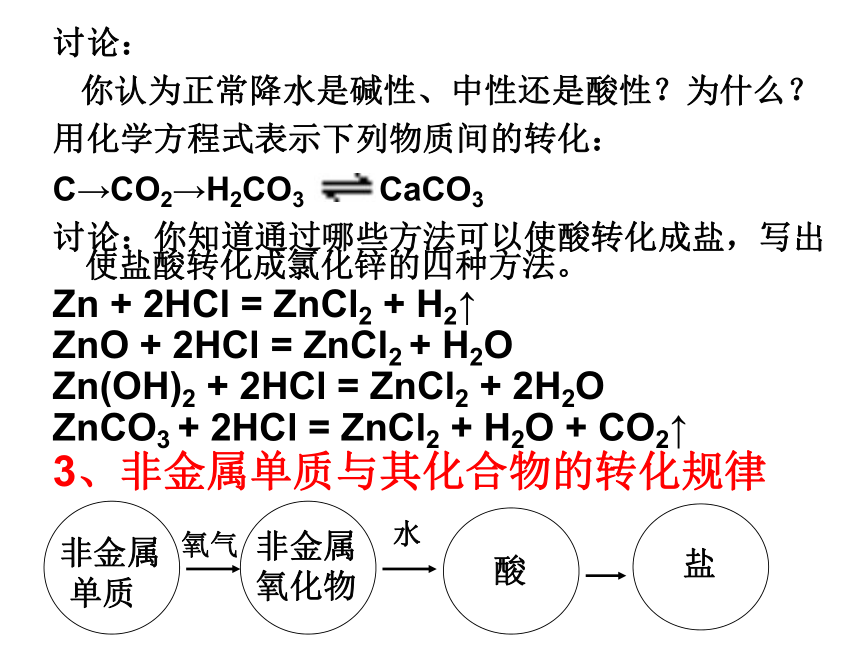
3、非金属单质与其化合物的转化规律
非金属
单质非金属
氧化物酸盐氧气水二、金属单质与其化合物的转化
实验一:铁和硫加热
(1)取少量的硫磺(黄色)和铁粉(黑色)混合,用磁铁接近混合物;现象:铁粉被磁铁吸出,附在磁铁的表面。
(2)把混合物加热;现象:发生剧烈反应,放出大量的热,生成黑色固体。
(3)用磁铁接近生成物; 现象:磁铁不能吸引生成物。
反应方程式:
讨论:
通过以上实验,说明金属单质在一定的条件下可转化为相应的化合物。同学们还知道哪些金属单质可以转化为相应的化合物?
如:2Mg + O2 2MgO 2Cu + O2 2CuO
3Fe + 2O2 Fe3O4
2、金属单质+非金属单质→盐
2Fe + 3Cl2 2FeCl3 Cu + Cl2 CuCl2 △
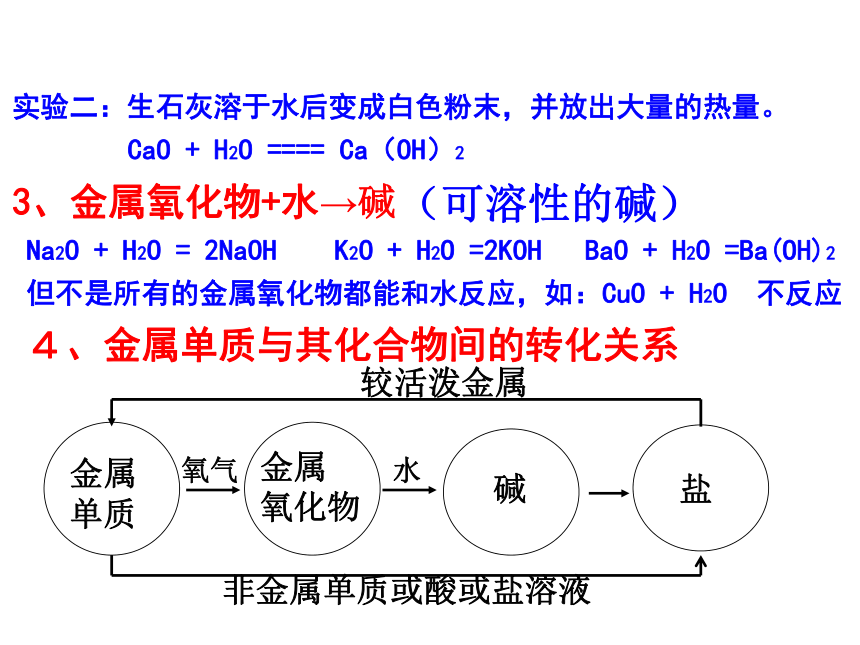
Fe + S ===FeS 1、金属+ 氧气→金属氧化物实验二:生石灰溶于水后变成白色粉末,并放出大量的热量。
CaO + H2O ==== Ca(OH)2
3、金属氧化物+水→碱
Na2O + H2O = 2NaOH K2O + H2O =2KOH BaO + H2O =Ba(OH)2
但不是所有的金属氧化物都能和水反应,如:CuO + H2O 不反应
4、金属单质与其化合物间的转化关系(可溶性的碱)金属
单质金属
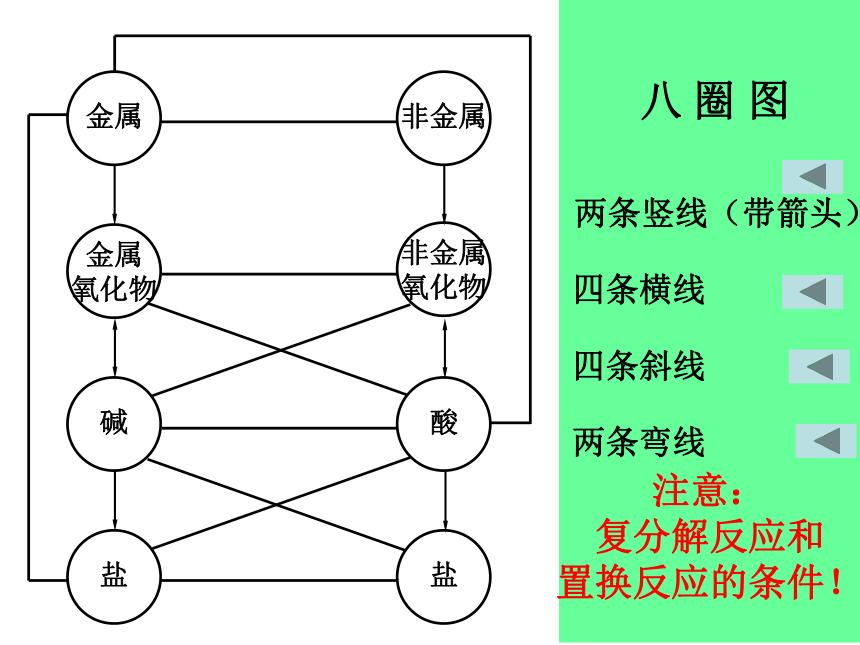
氧化物 碱盐氧气水较活泼金属 非金属单质或酸或盐溶液 1、两条纵线金属金属氧化物碱盐+O2+H2O+酸非金属非金属氧化物酸盐+O2 +H2O
(除SiO2)+碱三、物质转化规律2、四条横线金属 + 非金属 无氧酸盐 金属氧化物 +非金属氧化物 含氧酸盐 酸 + 碱 盐 + 水 可溶性盐 +可溶性盐 新盐 + 新盐3、四条交叉斜线金属氧化物+ 酸 盐 + 水 可溶性碱 +可溶性盐 新碱 + 新盐 盐 + 酸 新酸 + 新盐非金属氧化物+碱 盐 + 水 4、两条弯线金属+ 盐 新金属+ 新盐 金属 + 酸 盐 + 氢气
注意:
复分解反应和
置换反应的条件!两条竖线(带箭头)四条横线四条斜线两条弯线八 圈 图以 MgCl2为例,写出制备MgCl2的可能方法:Mg + Cl2 MgCl2Mg(OH)2+2HCl=MgCl2+2H2OMgO+2HCl=MgCl2+H2OMgCO3+2HCl=MgCl2+H2O+CO2↑MgSO4+BaCl2=MgCl2+BaSO4↓Mg+2HCl=MgCl2+H2 ↑Mg+FeCl2=MgCl2+Fe1、“垃圾是放错了位置的资源”,应该分类回收。
生活中废弃的铁锅、铝质易拉罐、铜导线等可
以归为一类加以回收,它们属于 ( )
A.化合物 B.非金属
C.有机物 D.金属或合金
2、国际互联网上报道:“目前世界上近有20亿人
患有缺铁性贫血”。我国政府即将启动“酱油补
铁工程”。这里的铁是指 ( )
A.铁元素 B.铁单质
C.四氧化三铁 D.三氧化二铁
3、地壳中含量最多的金属元素是 。DAAl物质的转化规律(四)
金属的冶炼
教学目标
1、初步学会实验室冶炼金属的方法,
了解工业上冶炼金属的方法。
2、培养学生的实验观察能力、描述
实验现象的能力等实验能力。
3、培养学生实验中的环境保护意识。复习提问:
1、金属可以与哪些物质发生反应?
2、用什么方法可以制得金属单质?
3、在NaOH、Ca(OH)2两种溶液中,一般选用
哪一种溶液来检验气体是不是二氧化碳?
为什么?实验一:木炭和氧化铜粉末在高温下的反应
加热木炭和氧化铜粉末的混合物一段时间,发现:试管壁出现水珠,试管中出现紫红色的固体;
澄清的石灰水变浑浊。化学方程式:
实验注意事项:
1、试管口要略向下倾斜
2、铁夹应夹在离试管口1/3处。
3、酒精灯加热用外焰。
4、实验结束,先移去盛有石灰水的烧杯,后
移去酒精灯
2CuO + C 2Cu + CO2↑—— 防止水倒流使试管爆裂—— 防止烧杯内溶液倒流使试管破裂实验二:用氢气还原氧化铜
1、把少量绿色的孔雀石粉末用酒精灯加热,发现:
化学方程式:
2、待试管内的产物冷却后,通入氢气,过一会儿给氧化铜加热。
现象:黑色的氧化铜变成光亮紫红色的金属;
试管内壁出现小水珠(试管口冒白气)。
化学方程式:绿色固体慢慢变成黑色,试管内壁出现小水珠。Cu2(OH)2CO3 2CuO + CO2↑+ H2OCuO + H2 Cu + H2O思考与讨论:1、为什么在氢气还原氧化铜实验开始时,要
先通氢气,后给氧化铜加热?
答:防止试管中氢气不纯,加热时发生爆炸。
2、铜在空气中加热很容易氧化变成氧化铜,你
在实验过程中要注意什么?
答:先停止加热,继续通入氢气直到试管冷却,
防止铜被空气中的氧气氧化。实验注意事项:
1、试管口要略向下倾斜
—— 防止水倒流使试管爆裂。
2、铁夹应夹在离试管口1/3处。
3、通H2的导管应伸到离管底接近的地方——
防止试管内H2与空气混合,加热时发生爆炸。
4、实验开始,应先通入H2,过一会儿再用酒精
灯加热
5、实验结束,应先停止加热,继续通入氢气直
到试管冷却——防止试管中H2不纯,加热时爆炸。—— 防止铜被空气中的O2氧化。已知:一氧化碳也能夺取氧化铜中的氧。
推测:用一氧化碳还原氧化铜
通入一氧化碳,过一会儿给氧化铜加热。
现象:黑色的氧化铜变成亮红色的固体;
澄清的石灰水变浑浊。
化学方程式:
CuO + CO Cu + CO2比较氧化铜分别被氢气、木炭、一氧化碳
还原的实验,完成下列表格。CuO + CO Cu + CO22CuO+C 2Cu+CO2↑CuO + H2 Cu + H2OCuO CuCuO Cu CuO Cu试管壁出现水珠,试管中
出现光亮紫红色的固体;
澄清的石灰水变浑浊。黑色的氧化铜变成光亮紫
红色的金属;
试管内壁出现小水珠。黑色的氧化铜变成光亮紫
红色的固体;
澄清的石灰水变浑浊。反应需要比较
高的温度H2“早出晚归”尾气要无害化
处理
试管中
出现光亮紫红色的固体;
黑色的氧化铜变成光亮紫
红色的金属;
黑色的氧化铜变成光亮紫
红色的固体;
练一练
下图为一氧化碳还原氧化铜的装置
①实验过程中观察到的现象是:在(a)玻璃管内 ;
在(b)管内 。
②点燃(b)管中导出一氧化碳气体的目的是:
为了 。黑色的氧化铜变成光亮紫红色的固体 澄清的石灰水变浑浊防止CO污染大气Fe2O3 + 3CO 2Fe + 3CO2实验三、用一氧化碳还原氧化铁
现象:红棕色固体变成黑色粉末,
澄清的石灰水变浑浊。
反应方程式:
—— 工业炼铁的原理CuO + CO Cu + CO22CuO+C 2Cu+CO2↑CuO + H2 Cu + H2O金属的冶炼:把金属从化合态变成游离态。方法一、金属氧化物与H2、C、CO还原剂等共热。
方法二、盐溶液与活泼金属置换出金属。Fe2O3 + 3CO 2Fe + 3CO21、下面是氢气还原氧化铜的操作步骤:a.停止用酒精灯加热;b.将平铺在试管底,把试管固定在铁架台上;c.用酒精灯加热;d.继续通人氢气到试管冷却;e.向盛氧化铜的试管中通氢气。
实验时正确的操作顺序是 .
2、某学生在实验室还原8g氧化铜,需耗氢气的质量为( )
A 8g B 大于0.2g C 小于0.2g D 0.2g Bb、e、c、a、d练 习3、以铁粉、氧化铜和稀硫酸为原料,试用两种
方法制取少量的铜,写出化学方程式,并比较那
一个方法好?
(1) ,
;
(2) ,
。CuO + H2 Cu + H2OFe + H2SO4 = FeSO4 + H2↑Fe + CuSO4 = FeSO4 + CuCuO + H2SO4 = CuSO4 + H2O其中(2)较好。CuCuOCu(OH)2CuCl2(CuSO4)Cu2(OH)2CO3铜锈O2CO/C/H2不溶性碱受热易分解不溶性碱===金属氧化物+水4、写出下列变化的化学方程式Cu2(OH)2CO3 2CuO + CO2↑+ H2OCuO + H2 Cu + H2O2Cu + O2 2CuOCu(OH)2 CuO + H2OCuO + H2SO4 CuSO4 + H2OCu(OH)2 + H2SO4 = CuSO4 + 2H2O2NaOH +CuSO4 = Cu(OH)2↓+ Na2SO4
实验一:硫在氧气中的燃烧
硫在空气中燃烧的现象:
硫在氧气中燃烧的现象:
反应化学方程式为:
1、非金属单质转化为相应的化合物 点燃
S + O2 ===== SO2发出淡蓝色的火焰,放出热量,生成有刺激性气味
(有毒)的气体。发出明亮的蓝紫色火焰,放出热量,生成有刺激性气味
(有毒)的气体。讨论:
为除去二氧化硫,在实验结束后,可以用什么溶液吸收?
讨论: 通过以上实验,说明非金属单质在一定的条件下(在空气或氧气中燃烧)可转化为相应的化合物。你还知道哪些非金属单质可以转化为相应的化合物?
高温 点燃
如:C + O2 ==== CO2
点燃
4P + 5O2 ===== 2P2O5 (除去空气中的氧气)
点燃
2H2 + O2 ===2H2O(氢气是最清洁、最理想的能源)
补充:C + CO2 ===== 2CO (不完全燃烧)
实验二:
蒸馏水+紫色石蕊试液:
蒸馏水+CO2+紫色石蕊试液:
原因:CO2溶于水生成碳酸 CO2 + H2O == H2CO3
加热后:红色溶液逐渐变成紫色溶液。
原因:
2、非金属氧化物与水反应生成酸(除SiO2)
S→SO2→H2SO3→H2SO4 △
H2CO3 === CO2↑+ H2O紫色石蕊试液不变色
紫色石蕊试液变红色 点燃
1 、 S + O2 ==SO22、SO2+H2O=H2SO33、2H2SO3+O2=2H2SO4酸雨的形成原因讨论:
你认为正常降水是碱性、中性还是酸性?为什么?
用化学方程式表示下列物质间的转化:
C→CO2→H2CO3 CaCO3
讨论:你知道通过哪些方法可以使酸转化成盐,写出 使盐酸转化成氯化锌的四种方法。
Zn + 2HCl = ZnCl2 + H2↑
ZnO + 2HCl = ZnCl2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
ZnCO3 + 2HCl = ZnCl2 + H2O + CO2↑
3、非金属单质与其化合物的转化规律
非金属
单质非金属
氧化物酸盐氧气水二、金属单质与其化合物的转化
实验一:铁和硫加热
(1)取少量的硫磺(黄色)和铁粉(黑色)混合,用磁铁接近混合物;现象:铁粉被磁铁吸出,附在磁铁的表面。
(2)把混合物加热;现象:发生剧烈反应,放出大量的热,生成黑色固体。
(3)用磁铁接近生成物; 现象:磁铁不能吸引生成物。
反应方程式:
讨论:
通过以上实验,说明金属单质在一定的条件下可转化为相应的化合物。同学们还知道哪些金属单质可以转化为相应的化合物?
如:2Mg + O2 2MgO 2Cu + O2 2CuO
3Fe + 2O2 Fe3O4
2、金属单质+非金属单质→盐
2Fe + 3Cl2 2FeCl3 Cu + Cl2 CuCl2 △
Fe + S ===FeS 1、金属+ 氧气→金属氧化物实验二:生石灰溶于水后变成白色粉末,并放出大量的热量。
CaO + H2O ==== Ca(OH)2
3、金属氧化物+水→碱
Na2O + H2O = 2NaOH K2O + H2O =2KOH BaO + H2O =Ba(OH)2
但不是所有的金属氧化物都能和水反应,如:CuO + H2O 不反应
4、金属单质与其化合物间的转化关系(可溶性的碱)金属
单质金属
氧化物 碱盐氧气水较活泼金属 非金属单质或酸或盐溶液 1、两条纵线金属金属氧化物碱盐+O2+H2O+酸非金属非金属氧化物酸盐+O2 +H2O
(除SiO2)+碱三、物质转化规律2、四条横线金属 + 非金属 无氧酸盐 金属氧化物 +非金属氧化物 含氧酸盐 酸 + 碱 盐 + 水 可溶性盐 +可溶性盐 新盐 + 新盐3、四条交叉斜线金属氧化物+ 酸 盐 + 水 可溶性碱 +可溶性盐 新碱 + 新盐 盐 + 酸 新酸 + 新盐非金属氧化物+碱 盐 + 水 4、两条弯线金属+ 盐 新金属+ 新盐 金属 + 酸 盐 + 氢气
注意:
复分解反应和
置换反应的条件!两条竖线(带箭头)四条横线四条斜线两条弯线八 圈 图以 MgCl2为例,写出制备MgCl2的可能方法:Mg + Cl2 MgCl2Mg(OH)2+2HCl=MgCl2+2H2OMgO+2HCl=MgCl2+H2OMgCO3+2HCl=MgCl2+H2O+CO2↑MgSO4+BaCl2=MgCl2+BaSO4↓Mg+2HCl=MgCl2+H2 ↑Mg+FeCl2=MgCl2+Fe1、“垃圾是放错了位置的资源”,应该分类回收。
生活中废弃的铁锅、铝质易拉罐、铜导线等可
以归为一类加以回收,它们属于 ( )
A.化合物 B.非金属
C.有机物 D.金属或合金
2、国际互联网上报道:“目前世界上近有20亿人
患有缺铁性贫血”。我国政府即将启动“酱油补
铁工程”。这里的铁是指 ( )
A.铁元素 B.铁单质
C.四氧化三铁 D.三氧化二铁
3、地壳中含量最多的金属元素是 。DAAl物质的转化规律(四)
金属的冶炼
教学目标
1、初步学会实验室冶炼金属的方法,
了解工业上冶炼金属的方法。
2、培养学生的实验观察能力、描述
实验现象的能力等实验能力。
3、培养学生实验中的环境保护意识。复习提问:
1、金属可以与哪些物质发生反应?
2、用什么方法可以制得金属单质?
3、在NaOH、Ca(OH)2两种溶液中,一般选用
哪一种溶液来检验气体是不是二氧化碳?
为什么?实验一:木炭和氧化铜粉末在高温下的反应
加热木炭和氧化铜粉末的混合物一段时间,发现:试管壁出现水珠,试管中出现紫红色的固体;
澄清的石灰水变浑浊。化学方程式:
实验注意事项:
1、试管口要略向下倾斜
2、铁夹应夹在离试管口1/3处。
3、酒精灯加热用外焰。
4、实验结束,先移去盛有石灰水的烧杯,后
移去酒精灯
2CuO + C 2Cu + CO2↑—— 防止水倒流使试管爆裂—— 防止烧杯内溶液倒流使试管破裂实验二:用氢气还原氧化铜
1、把少量绿色的孔雀石粉末用酒精灯加热,发现:
化学方程式:
2、待试管内的产物冷却后,通入氢气,过一会儿给氧化铜加热。
现象:黑色的氧化铜变成光亮紫红色的金属;
试管内壁出现小水珠(试管口冒白气)。
化学方程式:绿色固体慢慢变成黑色,试管内壁出现小水珠。Cu2(OH)2CO3 2CuO + CO2↑+ H2OCuO + H2 Cu + H2O思考与讨论:1、为什么在氢气还原氧化铜实验开始时,要
先通氢气,后给氧化铜加热?
答:防止试管中氢气不纯,加热时发生爆炸。
2、铜在空气中加热很容易氧化变成氧化铜,你
在实验过程中要注意什么?
答:先停止加热,继续通入氢气直到试管冷却,
防止铜被空气中的氧气氧化。实验注意事项:
1、试管口要略向下倾斜
—— 防止水倒流使试管爆裂。
2、铁夹应夹在离试管口1/3处。
3、通H2的导管应伸到离管底接近的地方——
防止试管内H2与空气混合,加热时发生爆炸。
4、实验开始,应先通入H2,过一会儿再用酒精
灯加热
5、实验结束,应先停止加热,继续通入氢气直
到试管冷却——防止试管中H2不纯,加热时爆炸。—— 防止铜被空气中的O2氧化。已知:一氧化碳也能夺取氧化铜中的氧。
推测:用一氧化碳还原氧化铜
通入一氧化碳,过一会儿给氧化铜加热。
现象:黑色的氧化铜变成亮红色的固体;
澄清的石灰水变浑浊。
化学方程式:
CuO + CO Cu + CO2比较氧化铜分别被氢气、木炭、一氧化碳
还原的实验,完成下列表格。CuO + CO Cu + CO22CuO+C 2Cu+CO2↑CuO + H2 Cu + H2OCuO CuCuO Cu CuO Cu试管壁出现水珠,试管中
出现光亮紫红色的固体;
澄清的石灰水变浑浊。黑色的氧化铜变成光亮紫
红色的金属;
试管内壁出现小水珠。黑色的氧化铜变成光亮紫
红色的固体;
澄清的石灰水变浑浊。反应需要比较
高的温度H2“早出晚归”尾气要无害化
处理
试管中
出现光亮紫红色的固体;
黑色的氧化铜变成光亮紫
红色的金属;
黑色的氧化铜变成光亮紫
红色的固体;
练一练
下图为一氧化碳还原氧化铜的装置
①实验过程中观察到的现象是:在(a)玻璃管内 ;
在(b)管内 。
②点燃(b)管中导出一氧化碳气体的目的是:
为了 。黑色的氧化铜变成光亮紫红色的固体 澄清的石灰水变浑浊防止CO污染大气Fe2O3 + 3CO 2Fe + 3CO2实验三、用一氧化碳还原氧化铁
现象:红棕色固体变成黑色粉末,
澄清的石灰水变浑浊。
反应方程式:
—— 工业炼铁的原理CuO + CO Cu + CO22CuO+C 2Cu+CO2↑CuO + H2 Cu + H2O金属的冶炼:把金属从化合态变成游离态。方法一、金属氧化物与H2、C、CO还原剂等共热。
方法二、盐溶液与活泼金属置换出金属。Fe2O3 + 3CO 2Fe + 3CO21、下面是氢气还原氧化铜的操作步骤:a.停止用酒精灯加热;b.将平铺在试管底,把试管固定在铁架台上;c.用酒精灯加热;d.继续通人氢气到试管冷却;e.向盛氧化铜的试管中通氢气。
实验时正确的操作顺序是 .
2、某学生在实验室还原8g氧化铜,需耗氢气的质量为( )
A 8g B 大于0.2g C 小于0.2g D 0.2g Bb、e、c、a、d练 习3、以铁粉、氧化铜和稀硫酸为原料,试用两种
方法制取少量的铜,写出化学方程式,并比较那
一个方法好?
(1) ,
;
(2) ,
。CuO + H2 Cu + H2OFe + H2SO4 = FeSO4 + H2↑Fe + CuSO4 = FeSO4 + CuCuO + H2SO4 = CuSO4 + H2O其中(2)较好。CuCuOCu(OH)2CuCl2(CuSO4)Cu2(OH)2CO3铜锈O2CO/C/H2不溶性碱受热易分解不溶性碱===金属氧化物+水4、写出下列变化的化学方程式Cu2(OH)2CO3 2CuO + CO2↑+ H2OCuO + H2 Cu + H2O2Cu + O2 2CuOCu(OH)2 CuO + H2OCuO + H2SO4 CuSO4 + H2OCu(OH)2 + H2SO4 = CuSO4 + 2H2O2NaOH +CuSO4 = Cu(OH)2↓+ Na2SO4
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
