化学概念和基础理论[下学期]
图片预览





文档简介
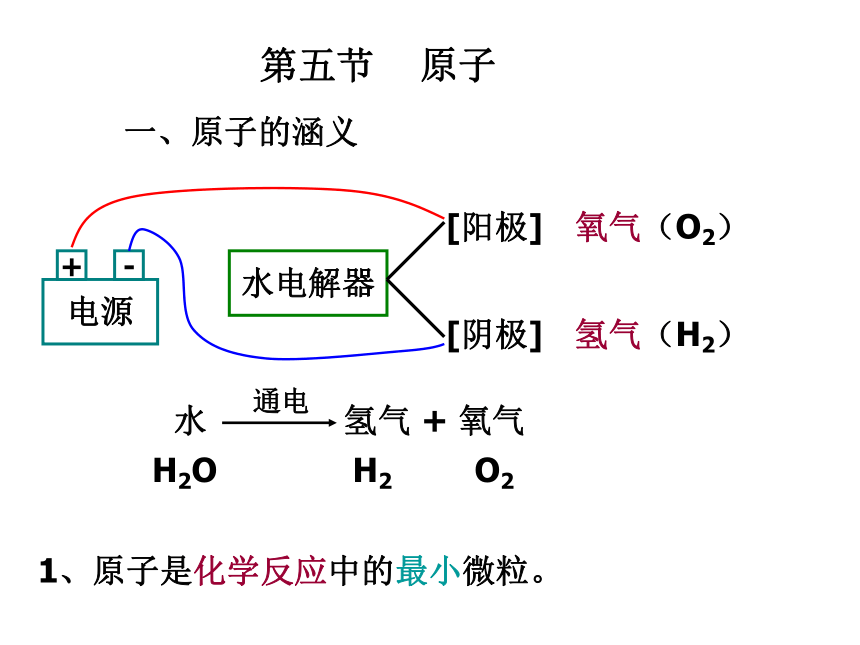
课件37张PPT。第五节 原子一、原子的涵义水电解器[阳极][阴极]氧气(O2)氢气(H2)1、原子是化学反应中的最小微粒。水 氢气 + 氧气通电H2OH2O22、分子与原子的区别:在化学反应中,分子可分成
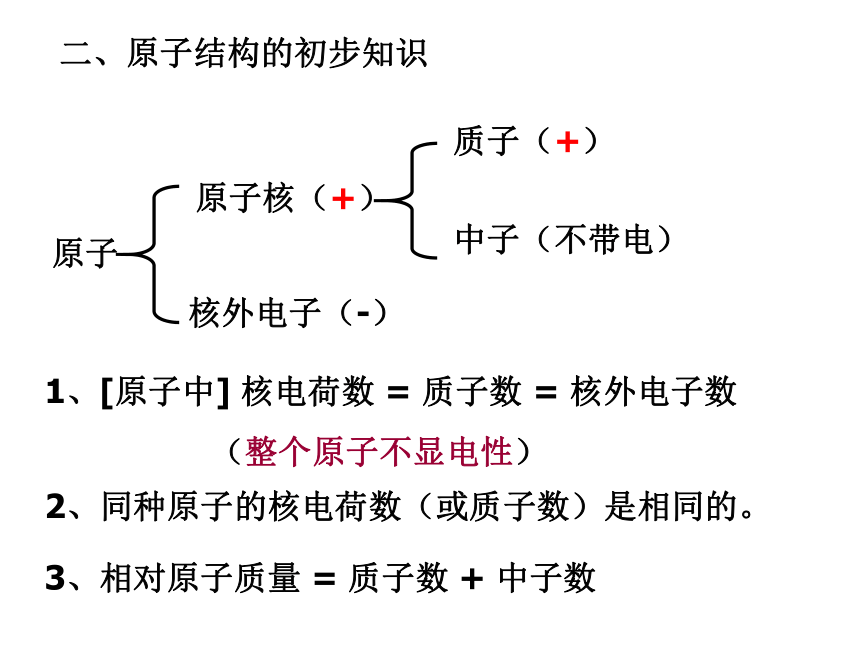
原子,而原子不能再分。3、原子也是构成物质的一种微粒。金属稀有气体某些非金属铁(Fe)铜(Cu)镁(Mg)等氦气(He)氖气(Ne)氩气(Ar)碳(C)硅(Si)二、原子结构的初步知识原子核外电子(-)原子核(+)中子(不带电)质子(+)1、[原子中] 核电荷数 = 质子数 = 核外电子数
(整个原子不显电性)2、同种原子的核电荷数(或质子数)是相同的。3、相对原子质量 = 质子数 + 中子数三、相对原子质量:[练习]已知碳12原子的质量为a千克,某原子的质量
为b千克,则该原子的相对原子质量为_____。 以一种碳原子质量的1/12作为
标准,其他原子的质量跟它相
比所得的值。原子有一定的质量如 1个氢原子 1.674×10-27千克
1个氧原子 2.657×10-26千克
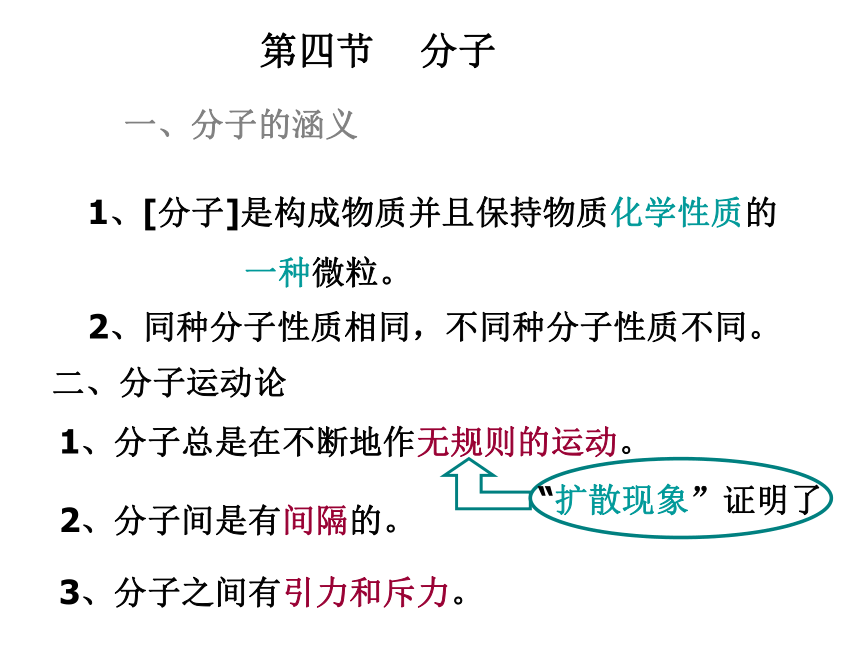
1个碳原子 1.993×10-26千克第四节 分子二、分子运动论1、[分子]是构成物质并且保持物质化学性质的
一种微粒。2、同种分子性质相同,不同种分子性质不同。一、分子的涵义1、分子总是在不断地作无规则的运动。2、分子间是有间隔的。3、分子之间有引力和斥力。“扩散现象”证明了三、用分子观点解释日常生活中的现象1、区分物理变化和化学变化
物理变化:
化学变化:分子本身没有变。分子本身起了变化,变成其他物质的分子。2、区分混合物和纯净物
纯净物:
混合物:由同种分子构成的物质。由不同种分子构成的物质。[思考题]
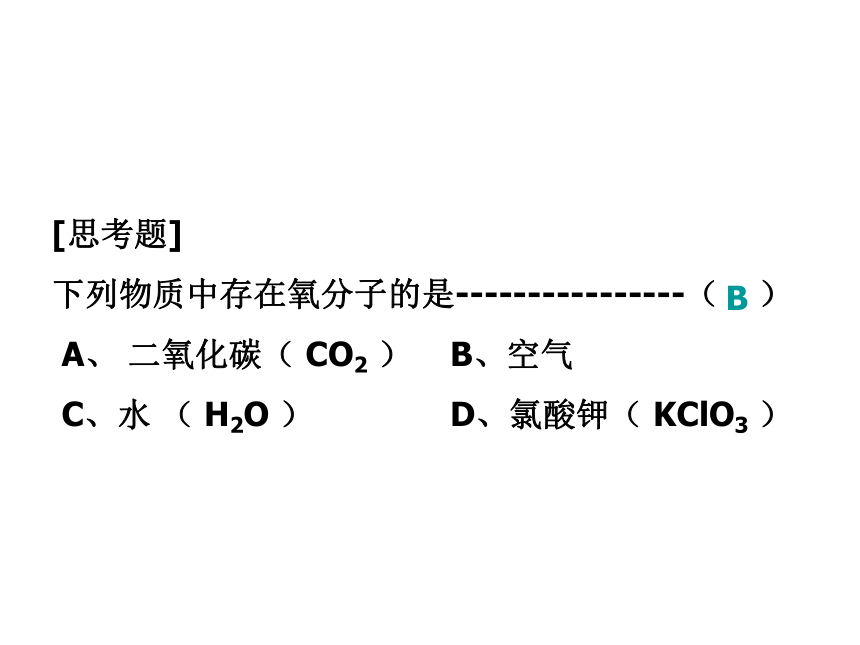
下列物质中存在氧分子的是----------------( )
A、 二氧化碳( CO2 ) B、空气
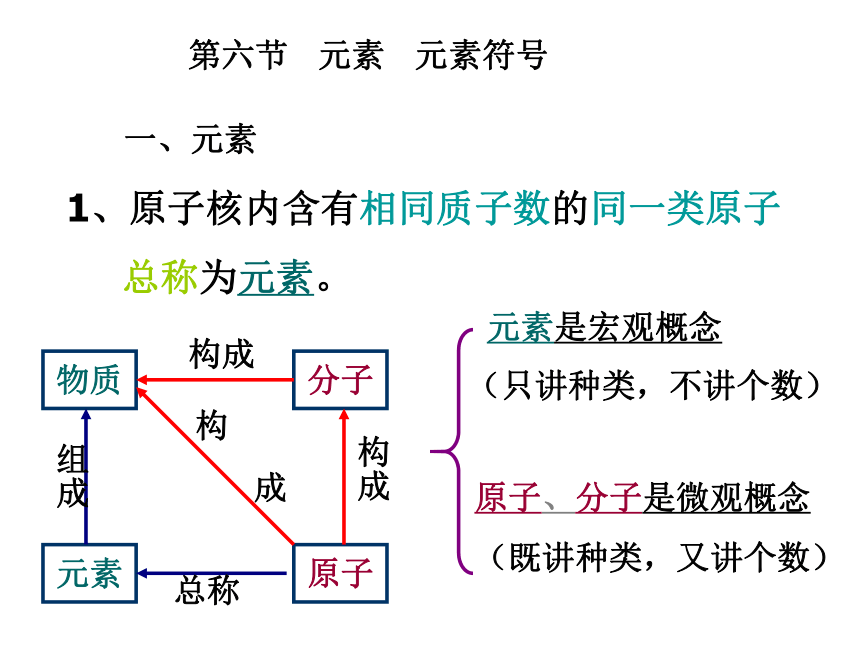
C、水 ( H2O ) D、氯酸钾( KClO3 )B第六节 元素 元素符号一、元素1、原子核内含有相同质子数的同一类原子
总称为元素。 元素是宏观概念
(只讲种类,不讲个数)原子、分子是微观概念
(既讲种类,又讲个数)构
成构成构成总称组成例如:水 (H2O)①水是由氢元素和氧元素组成的。
②水是由水分子构成的。
③一个水分子是由2个氢原子和1个氧原子构成的。例如:铁 (Fe)①铁是由铁元素组成的。
②铁是由铁原子直接构成的。2、已发现的元素种类有100多种。3、地壳中所含元素的质量分数:
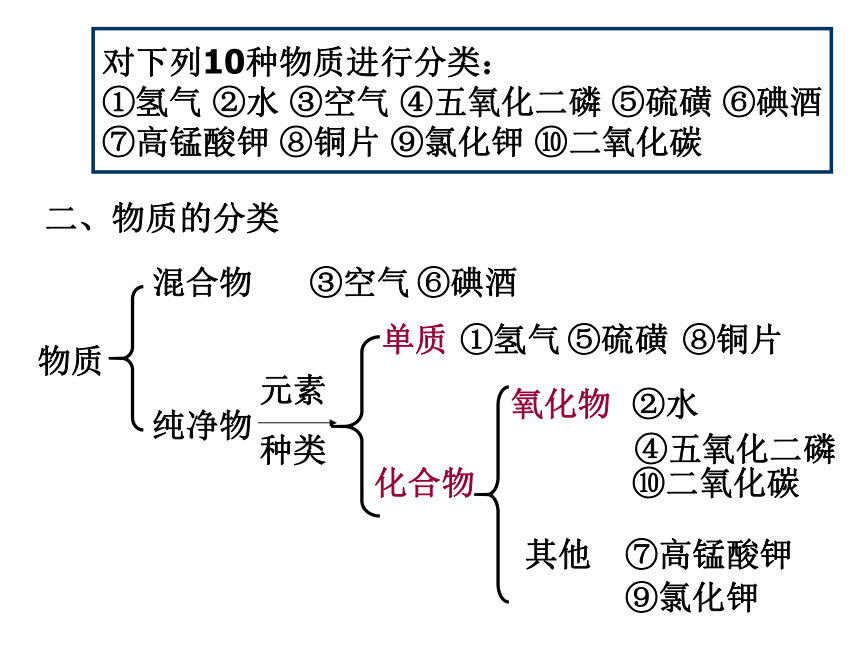
氧(O)>硅(Si)>铝(Al)>铁(Fe)物质化合物单质纯净物混合物氧化物对下列10种物质进行分类:
①氢气 ②水 ③空气 ④五氧化二磷 ⑤硫磺 ⑥碘酒
⑦高锰酸钾 ⑧铜片 ⑨氯化钾 ⑩二氧化碳二、物质的分类③空气⑥碘酒元素
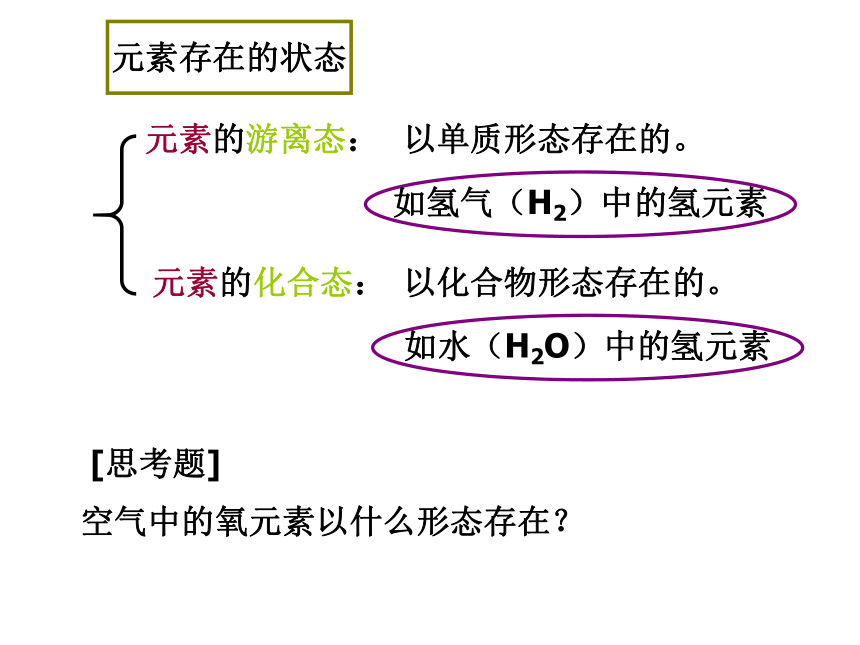
种类①氢气⑤硫磺⑧铜片其他②水 ④五氧化二磷⑩二氧化碳⑦高锰酸钾⑨氯化钾元素存在的状态元素的游离态:元素的化合态:以单质形态存在的。以化合物形态存在的。如氢气(H2)中的氢元素如水(H2O)中的氢元素 [思考题]
空气中的氧元素以什么形态存在?三、元素符号1、用拉丁文名称的第一个大写字母来表示。2、元素符号的意义:(1)表示某一种元素
(2)表示这种元素的一个原子[课堂练习] 1、下列叙述中正确的是----------------( )
A、水是由二个氢元素和一个氧元素组成的
B、二氧化碳是由一个碳原子和二个氧原子构成的
C、二氧化碳分子是由碳元素和氧元素组成的
D、二氧化硫中含有硫和氧两种元素
2、地壳中含量最多的金属元素是-----------( )
大气中含量最多的元素是----------------( )
A、氧 B、硅 C、铝 D、氮3、下列符号中既能表示一种元素,又能表示元素的
一个原子,还能表示这种元素游离态的是( )
(A) H (B) 2H (C)O2 (D) C一、混合物和纯净物第三节 物质的分类(1)1、混合物(1)定义:由两种或两种以上物质组成,各物质只是简单混合,没有发生化学变化。(2)特征:没有固定的组成,各成分保持原有的性质。(3)实例:空气、盐酸、合金、爆鸣气、漂白粉、自然界的水等。2、纯净物(1)定义:只由一种物质组成。(2)特征:有固定的组成和性质。(3)实例:氯酸钾、氧气、胆矾等。二、单质和化合物1、单质:由同种元素组成的纯净物。不一定一定2、化合物:由不同种元素组成的纯净物。注意:混合物与化合物的区别。 混合物—物质多种; 化合物—物质一种,但组成的元素有多种。三、无机物的分类1、无机物:无机化合物和单质的统称。2、单质根据组成元素的性质,可分为金属单质、非金属单质和稀有气体单质。3、无机化合物根据组成和性质,通常可以分为氧化物、酸、碱、盐。1、定义:含有碳元素的化合物。四、有机化合物(简称“有机物”)蔗糖、淀粉、纤维素、脂肪、蛋白质、酶、激素、维生素等物质都是有机化合物。1、性质: (1)没有颜色、没有气味的气体; (2)密度比空气小;(3)极难溶于水; (4)很容易燃烧。〈一〉甲烷(CH4)——最简单的有机物注意:甲烷与空气或氧气混合点燃易爆炸。2、应用:①甲烷收集方法:排水法和向下排空气法。1、性质: ①无色透明,具有特殊气味的液体; ②易挥发,常作溶剂; ③可燃性(可作酒精灯和内燃机的燃料)。②四川等省天然气资源丰富,天然气的主要成分是CH4, “西气东输”中的“气”即是天然气。〈二〉酒精(C2H5OH)——又称“乙醇”2、应用:(1)配制各种酒类饮料。注意:工业酒精含甲醇,有剧毒,不能食用。(2)医疗上常用75%的酒精作为消毒剂。CH3COOH= CH3COO-+H+〈二〉醋酸(CH3COOH)——食醋的主要成分。1、性质 (1)无色,具有强烈刺激性气味的液体;(2)易溶于水; (3)16.6℃凝结成冰醋酸; (4)具酸性,是一种有机酸,家庭可用于清除水垢。2、应用:①调料,食醋含醋酸3%~5%;②防腐剂。五、氧化物1、定义:由两种元素组成,其中一种是氧元素的化合物。2、特征:二种元素组成,必定含氧的化合物。3、分类极其关系第三节 物质的分类(2)〈一〉酸性氧化物1、定义:凡能跟碱起反应生成盐和水的氧化物叫做酸性氧化物。(也叫酸酐)2、性质:(1)酸性氧化物+碱→盐和水如:CO2、SO2、SO3、SiO2等。非金属氧化物大多是酸性氧化物CO2+2NaOH=Na2CO3+H2OSO2+2KOH=K2SO3+H2O3、制取:①非金属与O2直接化合②含氧酸盐加热分解③含氧酸加热分解(2)酸性氧化物(除SiO2)+水→酸(3)酸性氧化物+碱性氧化物→含氧酸盐CO2+H2O=H2CO3SO2+H2O=H2SO3SO3+H2O=H2SO4H2CO3=H2O+CO24、几种常见的酸及相应酸酐〈二〉碱性氧化物1、定义:凡能跟酸起反应生成盐和水的氧化物叫做碱性氧化物。如:Na2O、CaO、K2O、BaO、CuO等。金属氧化物大多是碱性氧化物2、性质:(1)碱性氧化物+酸→盐和水CuO+2HCl=CuCl2+H2OFe2O3+3H2SO4=Fe2(SO4)3 +3H2O(2)少数碱性氧化物+水→可溶性碱(3)酸性氧化物+碱性氧化物→含氧酸盐Na2O+H2O=2NaOHK2O+H2O=2KOHCaO+H2O=Ca(OH)2BaO+H2O=Ba(OH)2炼铁的高炉和制玻璃的反应原理3、制取:①金属与O2直接化合②含氧酸盐加热分解③不溶性碱加热分解注意:不溶性碱、难溶性碳酸盐加热易分解,可溶性的碱和可溶性的碳酸盐加热不易分解。金属 氧化物非金属氧化物碱性 氧化物酸性 氧化物大多数是一定是大多数是不一定是(1)Al2O3、ZnO等金属氧化物不是碱性氧化物;(2)CO、NO、H2O等非金属氧化物不是酸性氧化物;(3)Mn2O7是酸性氧化物但不是非金属氧化物。五、酸:电解质电离时所生成的阳离子全部是氢离子的化合物。1、酸的分类及命名酸按分子是否含氧原子无氧酸——命名“氢某酸” HCl氢氯酸(盐酸)H2S氢硫酸含氧酸——命名“某酸” HNO3硝酸、H2SO4硫酸、 H2CO3碳酸、H3PO4磷酸、 H2SO3亚硫酸等按酸电离时所能生成的氢离子的个数一元酸:HNO3、HCl三元酸:H3PO4二元酸:H2SO4、H2CO3六、碱:电解质电离时所生成的阴离子全部是氢氧根离子的化合物1、组成:金属离子(或NH4+)和一个或多个氢氧根离子构成。2、碱的分类可溶性碱:NaOH、 KOH 、 Ba(OH)2、Ca(OH)2、NH4OH不溶性碱:Cu(OH)2、Fe(OH)3、Mg(OH)23、碱的命名:“氢氧化某”4、碱的通性(可溶性)A、跟指示剂反应B、跟酸起中和反应D、跟某些可溶性盐起反应C、跟酸性氧化物起反应5、不溶性碱加热易分解为金属氧化物和水七、盐:酸和碱中和的产物1、组成:金属离子(或NH4+)和酸根离子2、分类及命名⑴正盐:酸跟碱完全中和的产物。NaCl、CuSO4、KNO3、CaCO3等。命名含氧酸盐:“甲酸乙” CuSO4硫酸铜无氧酸盐:“甲化乙” AlCl3氯化铝 FeCl2氯化亚铁⑵酸式盐:酸中的氢离子被碱部分中和生成的盐。命名:“甲酸氢乙”或“甲酸几氢乙”NaHCO3碳酸氢钠; NaH2PO4磷酸二氢钠⑶碱式盐:碱中氢氧根离子被酸部分中和生成的盐。命名:“碱式+正盐名称”Mg(OH)Cl碱式氯化镁Cu2(OH)2CO3碱式碳酸铜
原子,而原子不能再分。3、原子也是构成物质的一种微粒。金属稀有气体某些非金属铁(Fe)铜(Cu)镁(Mg)等氦气(He)氖气(Ne)氩气(Ar)碳(C)硅(Si)二、原子结构的初步知识原子核外电子(-)原子核(+)中子(不带电)质子(+)1、[原子中] 核电荷数 = 质子数 = 核外电子数
(整个原子不显电性)2、同种原子的核电荷数(或质子数)是相同的。3、相对原子质量 = 质子数 + 中子数三、相对原子质量:[练习]已知碳12原子的质量为a千克,某原子的质量
为b千克,则该原子的相对原子质量为_____。 以一种碳原子质量的1/12作为
标准,其他原子的质量跟它相
比所得的值。原子有一定的质量如 1个氢原子 1.674×10-27千克
1个氧原子 2.657×10-26千克
1个碳原子 1.993×10-26千克第四节 分子二、分子运动论1、[分子]是构成物质并且保持物质化学性质的
一种微粒。2、同种分子性质相同,不同种分子性质不同。一、分子的涵义1、分子总是在不断地作无规则的运动。2、分子间是有间隔的。3、分子之间有引力和斥力。“扩散现象”证明了三、用分子观点解释日常生活中的现象1、区分物理变化和化学变化
物理变化:
化学变化:分子本身没有变。分子本身起了变化,变成其他物质的分子。2、区分混合物和纯净物
纯净物:
混合物:由同种分子构成的物质。由不同种分子构成的物质。[思考题]
下列物质中存在氧分子的是----------------( )
A、 二氧化碳( CO2 ) B、空气
C、水 ( H2O ) D、氯酸钾( KClO3 )B第六节 元素 元素符号一、元素1、原子核内含有相同质子数的同一类原子
总称为元素。 元素是宏观概念
(只讲种类,不讲个数)原子、分子是微观概念
(既讲种类,又讲个数)构
成构成构成总称组成例如:水 (H2O)①水是由氢元素和氧元素组成的。
②水是由水分子构成的。
③一个水分子是由2个氢原子和1个氧原子构成的。例如:铁 (Fe)①铁是由铁元素组成的。
②铁是由铁原子直接构成的。2、已发现的元素种类有100多种。3、地壳中所含元素的质量分数:
氧(O)>硅(Si)>铝(Al)>铁(Fe)物质化合物单质纯净物混合物氧化物对下列10种物质进行分类:
①氢气 ②水 ③空气 ④五氧化二磷 ⑤硫磺 ⑥碘酒
⑦高锰酸钾 ⑧铜片 ⑨氯化钾 ⑩二氧化碳二、物质的分类③空气⑥碘酒元素
种类①氢气⑤硫磺⑧铜片其他②水 ④五氧化二磷⑩二氧化碳⑦高锰酸钾⑨氯化钾元素存在的状态元素的游离态:元素的化合态:以单质形态存在的。以化合物形态存在的。如氢气(H2)中的氢元素如水(H2O)中的氢元素 [思考题]
空气中的氧元素以什么形态存在?三、元素符号1、用拉丁文名称的第一个大写字母来表示。2、元素符号的意义:(1)表示某一种元素
(2)表示这种元素的一个原子[课堂练习] 1、下列叙述中正确的是----------------( )
A、水是由二个氢元素和一个氧元素组成的
B、二氧化碳是由一个碳原子和二个氧原子构成的
C、二氧化碳分子是由碳元素和氧元素组成的
D、二氧化硫中含有硫和氧两种元素
2、地壳中含量最多的金属元素是-----------( )
大气中含量最多的元素是----------------( )
A、氧 B、硅 C、铝 D、氮3、下列符号中既能表示一种元素,又能表示元素的
一个原子,还能表示这种元素游离态的是( )
(A) H (B) 2H (C)O2 (D) C一、混合物和纯净物第三节 物质的分类(1)1、混合物(1)定义:由两种或两种以上物质组成,各物质只是简单混合,没有发生化学变化。(2)特征:没有固定的组成,各成分保持原有的性质。(3)实例:空气、盐酸、合金、爆鸣气、漂白粉、自然界的水等。2、纯净物(1)定义:只由一种物质组成。(2)特征:有固定的组成和性质。(3)实例:氯酸钾、氧气、胆矾等。二、单质和化合物1、单质:由同种元素组成的纯净物。不一定一定2、化合物:由不同种元素组成的纯净物。注意:混合物与化合物的区别。 混合物—物质多种; 化合物—物质一种,但组成的元素有多种。三、无机物的分类1、无机物:无机化合物和单质的统称。2、单质根据组成元素的性质,可分为金属单质、非金属单质和稀有气体单质。3、无机化合物根据组成和性质,通常可以分为氧化物、酸、碱、盐。1、定义:含有碳元素的化合物。四、有机化合物(简称“有机物”)蔗糖、淀粉、纤维素、脂肪、蛋白质、酶、激素、维生素等物质都是有机化合物。1、性质: (1)没有颜色、没有气味的气体; (2)密度比空气小;(3)极难溶于水; (4)很容易燃烧。〈一〉甲烷(CH4)——最简单的有机物注意:甲烷与空气或氧气混合点燃易爆炸。2、应用:①甲烷收集方法:排水法和向下排空气法。1、性质: ①无色透明,具有特殊气味的液体; ②易挥发,常作溶剂; ③可燃性(可作酒精灯和内燃机的燃料)。②四川等省天然气资源丰富,天然气的主要成分是CH4, “西气东输”中的“气”即是天然气。〈二〉酒精(C2H5OH)——又称“乙醇”2、应用:(1)配制各种酒类饮料。注意:工业酒精含甲醇,有剧毒,不能食用。(2)医疗上常用75%的酒精作为消毒剂。CH3COOH= CH3COO-+H+〈二〉醋酸(CH3COOH)——食醋的主要成分。1、性质 (1)无色,具有强烈刺激性气味的液体;(2)易溶于水; (3)16.6℃凝结成冰醋酸; (4)具酸性,是一种有机酸,家庭可用于清除水垢。2、应用:①调料,食醋含醋酸3%~5%;②防腐剂。五、氧化物1、定义:由两种元素组成,其中一种是氧元素的化合物。2、特征:二种元素组成,必定含氧的化合物。3、分类极其关系第三节 物质的分类(2)〈一〉酸性氧化物1、定义:凡能跟碱起反应生成盐和水的氧化物叫做酸性氧化物。(也叫酸酐)2、性质:(1)酸性氧化物+碱→盐和水如:CO2、SO2、SO3、SiO2等。非金属氧化物大多是酸性氧化物CO2+2NaOH=Na2CO3+H2OSO2+2KOH=K2SO3+H2O3、制取:①非金属与O2直接化合②含氧酸盐加热分解③含氧酸加热分解(2)酸性氧化物(除SiO2)+水→酸(3)酸性氧化物+碱性氧化物→含氧酸盐CO2+H2O=H2CO3SO2+H2O=H2SO3SO3+H2O=H2SO4H2CO3=H2O+CO24、几种常见的酸及相应酸酐〈二〉碱性氧化物1、定义:凡能跟酸起反应生成盐和水的氧化物叫做碱性氧化物。如:Na2O、CaO、K2O、BaO、CuO等。金属氧化物大多是碱性氧化物2、性质:(1)碱性氧化物+酸→盐和水CuO+2HCl=CuCl2+H2OFe2O3+3H2SO4=Fe2(SO4)3 +3H2O(2)少数碱性氧化物+水→可溶性碱(3)酸性氧化物+碱性氧化物→含氧酸盐Na2O+H2O=2NaOHK2O+H2O=2KOHCaO+H2O=Ca(OH)2BaO+H2O=Ba(OH)2炼铁的高炉和制玻璃的反应原理3、制取:①金属与O2直接化合②含氧酸盐加热分解③不溶性碱加热分解注意:不溶性碱、难溶性碳酸盐加热易分解,可溶性的碱和可溶性的碳酸盐加热不易分解。金属 氧化物非金属氧化物碱性 氧化物酸性 氧化物大多数是一定是大多数是不一定是(1)Al2O3、ZnO等金属氧化物不是碱性氧化物;(2)CO、NO、H2O等非金属氧化物不是酸性氧化物;(3)Mn2O7是酸性氧化物但不是非金属氧化物。五、酸:电解质电离时所生成的阳离子全部是氢离子的化合物。1、酸的分类及命名酸按分子是否含氧原子无氧酸——命名“氢某酸” HCl氢氯酸(盐酸)H2S氢硫酸含氧酸——命名“某酸” HNO3硝酸、H2SO4硫酸、 H2CO3碳酸、H3PO4磷酸、 H2SO3亚硫酸等按酸电离时所能生成的氢离子的个数一元酸:HNO3、HCl三元酸:H3PO4二元酸:H2SO4、H2CO3六、碱:电解质电离时所生成的阴离子全部是氢氧根离子的化合物1、组成:金属离子(或NH4+)和一个或多个氢氧根离子构成。2、碱的分类可溶性碱:NaOH、 KOH 、 Ba(OH)2、Ca(OH)2、NH4OH不溶性碱:Cu(OH)2、Fe(OH)3、Mg(OH)23、碱的命名:“氢氧化某”4、碱的通性(可溶性)A、跟指示剂反应B、跟酸起中和反应D、跟某些可溶性盐起反应C、跟酸性氧化物起反应5、不溶性碱加热易分解为金属氧化物和水七、盐:酸和碱中和的产物1、组成:金属离子(或NH4+)和酸根离子2、分类及命名⑴正盐:酸跟碱完全中和的产物。NaCl、CuSO4、KNO3、CaCO3等。命名含氧酸盐:“甲酸乙” CuSO4硫酸铜无氧酸盐:“甲化乙” AlCl3氯化铝 FeCl2氯化亚铁⑵酸式盐:酸中的氢离子被碱部分中和生成的盐。命名:“甲酸氢乙”或“甲酸几氢乙”NaHCO3碳酸氢钠; NaH2PO4磷酸二氢钠⑶碱式盐:碱中氢氧根离子被酸部分中和生成的盐。命名:“碱式+正盐名称”Mg(OH)Cl碱式氯化镁Cu2(OH)2CO3碱式碳酸铜
