课题2 酸和碱的中和反应(共19张PPT)
文档属性
| 名称 | 课题2 酸和碱的中和反应(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-21 10:41:57 | ||
图片预览






文档简介
课件19张PPT。课 题 2 酸和碱之的中和反应 第一课时
同学们有这样的经历吗? 蜜蜂蛰伤 蚊子叮咬蚊虫叮咬时,在蚊子的口器中分泌出一种有机酸--蚁
酸,在家庭中可用浓肥皂涂抹可迅速止痒。 显碱性 为什么?[实验10-9]在烧杯中加入10mL氢氧化钠溶液,滴入几
滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌
溶液,至溶液颜色恰好变成无色为止。提出问题:酸和碱之间会发生什么反应?实验验证:稀盐酸与氢氧化钠溶液直接混合观察现象:无明显现象得出结论:没有结论你能设计出可行的方案证明酸和碱之间发生了反应吗?发生化学变化时常伴有颜色变化、放出气体、生成沉
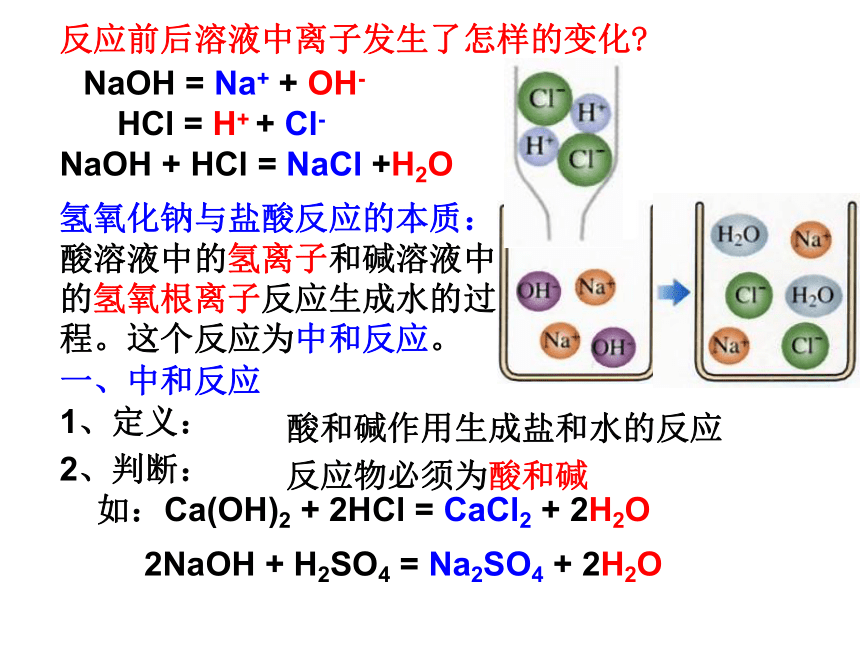
淀、能量的变化(放热、吸热、发光)等实验现象:溶液由红色变为无色得出结论:酸和碱能反应这个结论是我们需要的吗?反应前后溶液中离子发生了怎样的变化?NaOH = Na+ + OH- HCl = H+ + Cl-NaOH + HCl = NaCl +H2O氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。这个反应为中和反应。一、中和反应1、定义:酸和碱作用生成盐和水的反应2、判断:反应物必须为酸和碱如:Ca(OH)2 + 2HCl = CaCl2 + 2H2O2NaOH + H2SO4 = Na2SO4 + 2H2O1、下列反应中属于中和反应的是( )
A、Zn + 2HCl = ZnCl2 +H2↑
B、CuO + 2HCl = CuCl2+ H2O
C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
D、AgNO3+HCl = AgCl↓ +HNO3C2、下列各组物质通常借助指示剂才能证明是否反应的
是( )
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱和稀硫酸请同学们试一下D二、中和反应在实际中的应用1、改变土壤的酸碱性植物需要在一定酸碱性的土壤中生长,但近年来由于
不合理使用化肥,或酸雨的形成,破坏土壤的酸碱
性,不利于植物的生长,应怎样去改变酸性土壤?用熟石灰中和。能用生石灰代替熟石灰吗?为什么?可以:
CaO + H2O == Ca(OH)22、处理工厂的废水某硫酸厂排出的废水中含有硫酸等杂质,严重危害
当地的生态环境,你会怎样处理这些废水呢?用碱性物质(例如熟石灰)进行中和处理。你能写出化学方程式吗?请试一下Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O3、用于医药(1)胃酸的主要成分是 。胃药的主要成分氢氧
化铝。盐酸氢氧化铝能中和胃酸,你能写出化学方程式吗?Al(OH)3 + 3HCl = AlCl3 + 3H2O(2)被蚊虫叮咬后,涂一些含有碱性的物质的药水。讨论:举出生活中利用中和反应的实例。请同学们回顾本节课的主要内容:1、中和反应(酸 + 碱 = 盐 + 水)对于无明显现象的中和反应,通常要借助指示剂来帮助判断反应的发生。2、中和反应在实际生活中的应用A、农业 B、工业 C、医药 D、其他 人体酸碱性决定健康
血液是人体最重要、量最多的体液,健康血液的pH值呈
弱碱性,如果血液的pH值低于7.30,人体就处在亚健康状态,
极有可能得各种严重疾病――心脑血管病、骨质疏松、肾结石、
节炎、痛风、高血压、癌症、高脂血症等等――人体的酸化是
百病之源。
科学表明,食用碱性食物可以使体液趋碱,而酸性食物则
可以使体液变酸。饮食的酸碱不能以口味的酸和涩来区分,而
是主要看食物中所含的碱性元素、酸性元素和有机酸在人体内
代谢后的结果。比如酸醋,经过人体的吸收代谢之后,对人体
体液的贡献呈碱性,因此它其实是碱性食品。酸味的水果也同
样是碱性食品。通常来讲,绝大部分的水果、蔬菜都是碱性食
品,绝大多数肉类、精细加工的食品都酸性食品。合理的酸碱
饮食的摄入比应该为1 : 3。但现代人摄入的酸性食品过多,导
致了亚健康人群的大量增加。 科 学 小 知 识 酸性食品
蛋黄、甜点、白糖、金枪鱼、比目鱼、火腿、鸡肉、猪肉、牛肉、面包、小麦白米、花生、啤酒、海苔、巧克力、葱
碱性食品
葡萄、海带、柑橘、柿子、黄瓜、胡萝卜、大豆、番茄、香蕉、草莓、蛋白、柠檬、菠菜、红豆、苹果、豆腐、卷心菜、油菜、梨、土豆
1、在我国南方一些地区,分布着酸性土壤,不适应
某些作物生长。为改良作物生长条件,当地的农民常
用来中和土壤酸性的物质是( )
A、石灰石 B、熟石灰 C、烧碱 D、醋酸B2、在一次化学实验课上,老师让同学们对下面实验进行探究。
探究氢氧化钠溶液中是哪一种粒子能使无色酚酞溶液变色
[实验](1)在第一支试管中加入约2mL蒸馏水,滴入几滴无
色酚酞溶液。现象:溶液不变色。(2)在第二支试管中加入
约2mL氯化钠溶液,滴入几滴无色酚酞溶液。现象: 。 (3)在第三支试管中加入约2mL氢氧化钠溶液,滴入几滴无
色酚酞溶液。现象: 。
结论 。 溶液不变色溶液变红色氢氧根离子使无色酚酞溶液变红色第 二 课 时三、溶液酸碱度的表示法——pH同学们都知道判断溶液是酸性还是碱性一般用酸碱指
剂(紫色石蕊溶液、无色酚酞溶液)酸碱度:溶液的酸碱性强弱程度1、溶液酸碱度常用pH来表示, pH的范围通常在0~14之间。 2、pH<7;溶液呈酸性,数值越小酸性越强。pH>7;溶液呈碱性,数值越大碱性越强。pH=7;溶液呈中性滴入石蕊试液仍紫色,滴入无色酚酞仍无色。滴入石蕊试液变蓝色,滴入无色酚酞变红色。滴入石蕊试液变红色,滴入无色酚酞仍无色。3、测定pH最简便的方法是使用pH试纸。 测定方法:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取试液,然后在试纸的中间点一下,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。 注意: 1、不能直接把试纸浸入试液,否则会污染试液。 2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。 活动与探究1(1)测定几种酸或碱的稀溶液的pH (2)测定生活中一些物质的pH,说明它们的酸碱性。 ⑶测定雨水的pH(因溶解有二氧化碳,正常雨水的pH
约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;⑷测定人体内或排出的液体的pH,可以了解人体的健
康状况。⑵在农业生产中,农作物一般适宜在pH为7或接近7的
土壤中生长;活动与探究2 溶液酸碱度对头发的影响光泽好难正常正常很不好很易讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示? 答:碱性物质对头发有损坏作用。所以洗发液应选接近中性的,
不要选碱性大的洗发液。然后再用微酸性的护发素来保护头发。 学完本课题你应该知道:1、酸和碱能发生中和反应,生成盐和水。酸碱中和反应在生
活和生产中有广泛的应用。
2、溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱
度。
pH < 7 溶液呈酸性; pH = 7 溶液呈中性; pH > 7 溶液呈碱性。 了解溶液的酸碱度在实际中有重要的意义。
3、盐是在水溶液中能解离出金属离子和酸根离子的化合物。调查与研究1、简单测定土壤酸碱性的方法:取样,溶解,测定。学生练习:1、某学校化学课外活动小组的同学,取刚降到地面
的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数
据如下表所示:
⑴所降雨水是否为酸雨?在测定的时间内,雨水的酸性
是增强还是减弱?
pH值都小于5.6,所以是酸雨。pH值在减小,所以酸性增强。⑵经调查,这一地区有一个硫酸厂(生产过程中产生SO2)和一
个电镀厂,这些工厂使用的燃料主要是煤。另外,这一地区的
生活燃料主要也是煤,还有液化石油气。试分析造成这一地区
酸雨水的主要原因,你认为应采取什么措施?硫酸厂的废气要经过处理达标后排放。减少化石燃料(如煤)的使用,使用清洁能源。2、“测土选种”是现代农业生产常用科学方法,取武当山特区
某村土壤浸出的溶液,加入无色酚酞溶液后显红色。下表为四
种农作物适宜生长的PH范围,你认为该村土壤比较适宜种植的
农作物是:( )A.玉米 B.茶数 C.水稻 D.马铃薯A
同学们有这样的经历吗? 蜜蜂蛰伤 蚊子叮咬蚊虫叮咬时,在蚊子的口器中分泌出一种有机酸--蚁
酸,在家庭中可用浓肥皂涂抹可迅速止痒。 显碱性 为什么?[实验10-9]在烧杯中加入10mL氢氧化钠溶液,滴入几
滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌
溶液,至溶液颜色恰好变成无色为止。提出问题:酸和碱之间会发生什么反应?实验验证:稀盐酸与氢氧化钠溶液直接混合观察现象:无明显现象得出结论:没有结论你能设计出可行的方案证明酸和碱之间发生了反应吗?发生化学变化时常伴有颜色变化、放出气体、生成沉
淀、能量的变化(放热、吸热、发光)等实验现象:溶液由红色变为无色得出结论:酸和碱能反应这个结论是我们需要的吗?反应前后溶液中离子发生了怎样的变化?NaOH = Na+ + OH- HCl = H+ + Cl-NaOH + HCl = NaCl +H2O氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。这个反应为中和反应。一、中和反应1、定义:酸和碱作用生成盐和水的反应2、判断:反应物必须为酸和碱如:Ca(OH)2 + 2HCl = CaCl2 + 2H2O2NaOH + H2SO4 = Na2SO4 + 2H2O1、下列反应中属于中和反应的是( )
A、Zn + 2HCl = ZnCl2 +H2↑
B、CuO + 2HCl = CuCl2+ H2O
C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
D、AgNO3+HCl = AgCl↓ +HNO3C2、下列各组物质通常借助指示剂才能证明是否反应的
是( )
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱和稀硫酸请同学们试一下D二、中和反应在实际中的应用1、改变土壤的酸碱性植物需要在一定酸碱性的土壤中生长,但近年来由于
不合理使用化肥,或酸雨的形成,破坏土壤的酸碱
性,不利于植物的生长,应怎样去改变酸性土壤?用熟石灰中和。能用生石灰代替熟石灰吗?为什么?可以:
CaO + H2O == Ca(OH)22、处理工厂的废水某硫酸厂排出的废水中含有硫酸等杂质,严重危害
当地的生态环境,你会怎样处理这些废水呢?用碱性物质(例如熟石灰)进行中和处理。你能写出化学方程式吗?请试一下Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O3、用于医药(1)胃酸的主要成分是 。胃药的主要成分氢氧
化铝。盐酸氢氧化铝能中和胃酸,你能写出化学方程式吗?Al(OH)3 + 3HCl = AlCl3 + 3H2O(2)被蚊虫叮咬后,涂一些含有碱性的物质的药水。讨论:举出生活中利用中和反应的实例。请同学们回顾本节课的主要内容:1、中和反应(酸 + 碱 = 盐 + 水)对于无明显现象的中和反应,通常要借助指示剂来帮助判断反应的发生。2、中和反应在实际生活中的应用A、农业 B、工业 C、医药 D、其他 人体酸碱性决定健康
血液是人体最重要、量最多的体液,健康血液的pH值呈
弱碱性,如果血液的pH值低于7.30,人体就处在亚健康状态,
极有可能得各种严重疾病――心脑血管病、骨质疏松、肾结石、
节炎、痛风、高血压、癌症、高脂血症等等――人体的酸化是
百病之源。
科学表明,食用碱性食物可以使体液趋碱,而酸性食物则
可以使体液变酸。饮食的酸碱不能以口味的酸和涩来区分,而
是主要看食物中所含的碱性元素、酸性元素和有机酸在人体内
代谢后的结果。比如酸醋,经过人体的吸收代谢之后,对人体
体液的贡献呈碱性,因此它其实是碱性食品。酸味的水果也同
样是碱性食品。通常来讲,绝大部分的水果、蔬菜都是碱性食
品,绝大多数肉类、精细加工的食品都酸性食品。合理的酸碱
饮食的摄入比应该为1 : 3。但现代人摄入的酸性食品过多,导
致了亚健康人群的大量增加。 科 学 小 知 识 酸性食品
蛋黄、甜点、白糖、金枪鱼、比目鱼、火腿、鸡肉、猪肉、牛肉、面包、小麦白米、花生、啤酒、海苔、巧克力、葱
碱性食品
葡萄、海带、柑橘、柿子、黄瓜、胡萝卜、大豆、番茄、香蕉、草莓、蛋白、柠檬、菠菜、红豆、苹果、豆腐、卷心菜、油菜、梨、土豆
1、在我国南方一些地区,分布着酸性土壤,不适应
某些作物生长。为改良作物生长条件,当地的农民常
用来中和土壤酸性的物质是( )
A、石灰石 B、熟石灰 C、烧碱 D、醋酸B2、在一次化学实验课上,老师让同学们对下面实验进行探究。
探究氢氧化钠溶液中是哪一种粒子能使无色酚酞溶液变色
[实验](1)在第一支试管中加入约2mL蒸馏水,滴入几滴无
色酚酞溶液。现象:溶液不变色。(2)在第二支试管中加入
约2mL氯化钠溶液,滴入几滴无色酚酞溶液。现象: 。 (3)在第三支试管中加入约2mL氢氧化钠溶液,滴入几滴无
色酚酞溶液。现象: 。
结论 。 溶液不变色溶液变红色氢氧根离子使无色酚酞溶液变红色第 二 课 时三、溶液酸碱度的表示法——pH同学们都知道判断溶液是酸性还是碱性一般用酸碱指
剂(紫色石蕊溶液、无色酚酞溶液)酸碱度:溶液的酸碱性强弱程度1、溶液酸碱度常用pH来表示, pH的范围通常在0~14之间。 2、pH<7;溶液呈酸性,数值越小酸性越强。pH>7;溶液呈碱性,数值越大碱性越强。pH=7;溶液呈中性滴入石蕊试液仍紫色,滴入无色酚酞仍无色。滴入石蕊试液变蓝色,滴入无色酚酞变红色。滴入石蕊试液变红色,滴入无色酚酞仍无色。3、测定pH最简便的方法是使用pH试纸。 测定方法:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取试液,然后在试纸的中间点一下,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。 注意: 1、不能直接把试纸浸入试液,否则会污染试液。 2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。 活动与探究1(1)测定几种酸或碱的稀溶液的pH (2)测定生活中一些物质的pH,说明它们的酸碱性。 ⑶测定雨水的pH(因溶解有二氧化碳,正常雨水的pH
约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;⑷测定人体内或排出的液体的pH,可以了解人体的健
康状况。⑵在农业生产中,农作物一般适宜在pH为7或接近7的
土壤中生长;活动与探究2 溶液酸碱度对头发的影响光泽好难正常正常很不好很易讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示? 答:碱性物质对头发有损坏作用。所以洗发液应选接近中性的,
不要选碱性大的洗发液。然后再用微酸性的护发素来保护头发。 学完本课题你应该知道:1、酸和碱能发生中和反应,生成盐和水。酸碱中和反应在生
活和生产中有广泛的应用。
2、溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱
度。
pH < 7 溶液呈酸性; pH = 7 溶液呈中性; pH > 7 溶液呈碱性。 了解溶液的酸碱度在实际中有重要的意义。
3、盐是在水溶液中能解离出金属离子和酸根离子的化合物。调查与研究1、简单测定土壤酸碱性的方法:取样,溶解,测定。学生练习:1、某学校化学课外活动小组的同学,取刚降到地面
的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数
据如下表所示:
⑴所降雨水是否为酸雨?在测定的时间内,雨水的酸性
是增强还是减弱?
pH值都小于5.6,所以是酸雨。pH值在减小,所以酸性增强。⑵经调查,这一地区有一个硫酸厂(生产过程中产生SO2)和一
个电镀厂,这些工厂使用的燃料主要是煤。另外,这一地区的
生活燃料主要也是煤,还有液化石油气。试分析造成这一地区
酸雨水的主要原因,你认为应采取什么措施?硫酸厂的废气要经过处理达标后排放。减少化石燃料(如煤)的使用,使用清洁能源。2、“测土选种”是现代农业生产常用科学方法,取武当山特区
某村土壤浸出的溶液,加入无色酚酞溶液后显红色。下表为四
种农作物适宜生长的PH范围,你认为该村土壤比较适宜种植的
农作物是:( )A.玉米 B.茶数 C.水稻 D.马铃薯A
同课章节目录
