碱的性质[上学期]
图片预览



文档简介
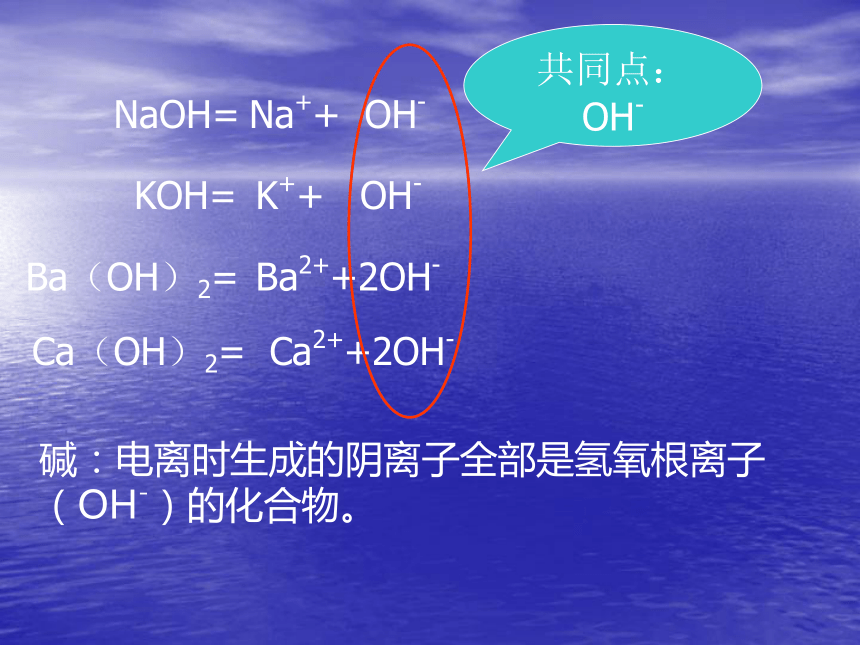
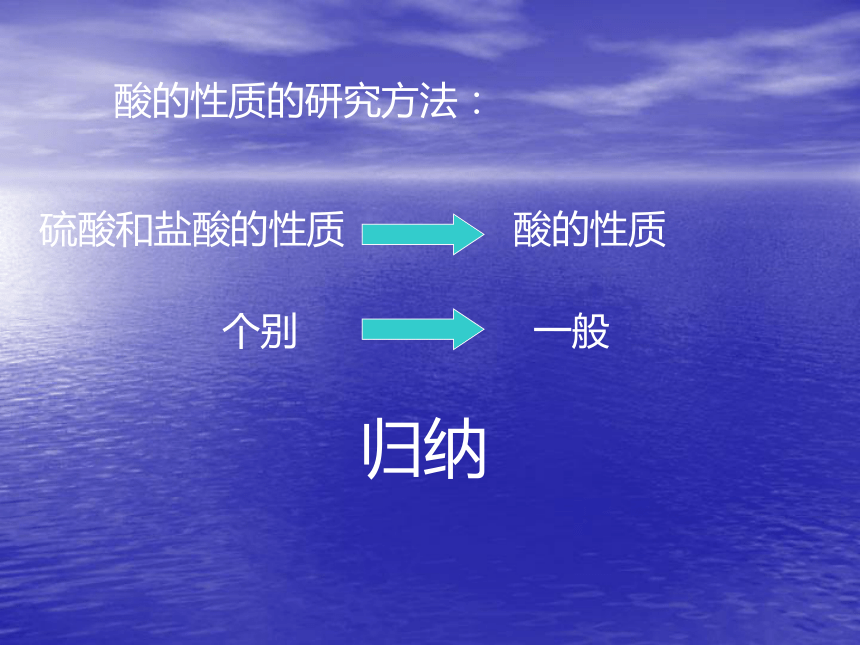
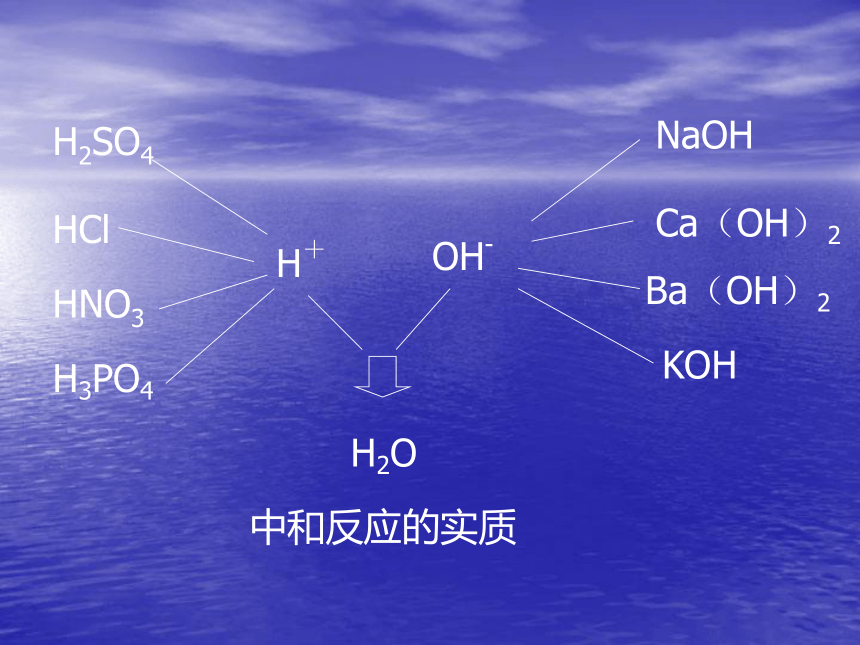
课件13张PPT。碱的性质NaOH=Na++ OH-KOH=K++ OH-Ba(OH)2=Ba2++2OH-Ca(OH)2=Ca2++2OH-共同点:OH-碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物。酸的性质的研究方法:硫酸和盐酸的性质酸的性质个别一般归纳碱的性质:1、与指示剂反应2、与酸反应思考:1、加指示剂的作用?2、滴加一定量的稀盐酸或稀硫酸后,溶液从红色变为无色,这说明溶液的酸碱性发生了什么变化?3、用什么办法能够知道在稀盐酸和氢氧化钠溶液的中和反应过程中,酸和碱没有剩余恰好完全反应?NaOH+HClNaCl+H2ONaOH+H2SO4Na2SO4+ H2O22中和反应: 作用生成 的反应。碱和酸盐和水中和反应的应用:H2SO4HNO3H+HClH3PO4NaOHCa(OH)2Ba(OH)2KOHOH-H2O中和反应的实质实验室检验二氧化碳Ca(OH)2+CO2CaCO3+H2O3、与非金属氧化物反应NaOH+CO2Na2CO3+ H2O2氢氧化钠变质的原因NaOH+SO2Na2SO3+ H2O2除去二氧化硫的方法NaOH+SiO2Na2SiO3+ H2O2装氢氧化钠的试剂瓶不能用玻璃塞的原因CuCl2+ NaOHNaCl+Cu(OH)222绿色溶液蓝色絮状沉淀FeCl3+ NaOH黄色溶液NaCl+Fe(OH)333红褐色絮状沉淀4、和盐反应小结:碱的通性1、能和指示剂反应2、碱+酸 盐+水NaOH+HCl=NaCl+H2O3、碱+非金属氧化物 盐+水Ca(OH)2+CO2=CaCO3 +H2O4、碱+盐 新盐+新碱2NaOH+CuCl2=Cu(OH)2 +H2O碱的个性一、氢氧化钠 NaOH俗称:烧碱、火碱、苛性钠氢氧化钠是强碱,有较强的腐蚀性,切不可接触皮肤白色固体易吸水潮解做干燥剂溶于水时放出大量的热二、氢氧化钙 Ca(OH)2俗称:熟石灰、消石灰、
石灰浆、石灰水Ca(OH)2+ HClCa(OH)2+H2SO4CaCl2+ H2O22CaSO4+ H2O2Na2CO3+Ca(OH)2CaCO3+ NaOH2FeCl3+ Ca(OH)2Fe(OH)3 + CaCl22233
石灰浆、石灰水Ca(OH)2+ HClCa(OH)2+H2SO4CaCl2+ H2O22CaSO4+ H2O2Na2CO3+Ca(OH)2CaCO3+ NaOH2FeCl3+ Ca(OH)2Fe(OH)3 + CaCl22233
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
