人教版化学必修1第四章第一节无机非金属材料的主角——硅课件(16张ppt)
文档属性
| 名称 | 人教版化学必修1第四章第一节无机非金属材料的主角——硅课件(16张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-24 21:44:02 | ||
图片预览






文档简介
课件16张PPT。无机非金属材料的主角——硅 硅胶干燥剂硅胶是硅酸凝胶经干燥脱水后得到的多孔的硅酸干凝胶,硅胶多孔,吸附水分能力强,常用作实验室和袋装食品、瓶装药品等的干燥剂,也可用作催化剂的载体。光导纤维石英玛瑙光导纤维哪些物质中含有SiO2 ?紫水晶沙子思考交流1、SiO2具有哪些物理性质?
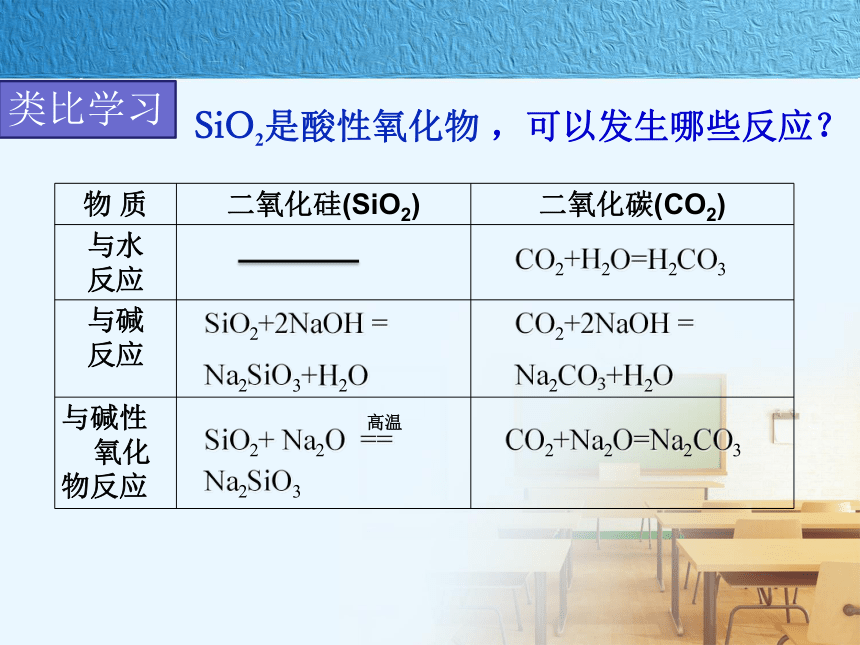
2、化学稳定性如何?根据SiO2的存在和应用,请分析以下问题:3、SiO2能发生哪些化学反应?SiO2是酸性氧化物 ,可以发生哪些反应?CO2+H2O=H2CO3CO2+2NaOH =
Na2CO3+H2OCO2+Na2O=Na2CO3SiO2+2NaOH =
Na2SiO3+H2OSiO2+ Na2O ==
Na2SiO3高温类比学习 问题:实验室盛装NaOH溶液的试剂瓶为什么不能用玻璃塞?硅酸钠水溶液俗名“水玻璃”具有黏性,可用作粘合剂。与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O思考交流7SiO2 + 4HF =SiF4↑ + 2H2O氢氟酸(HF)是唯一可以与SiO2 反应的酸问题:用什么来刻蚀玻璃?思考交流SiO2的特性:高温化学性质(2)难溶于水,不与水反应(3)不与酸反应(除氢氟酸以外)SiO2 + Na2O === Na2SiO3 SiO2 + 2NaOH == Na2SiO3 + H2O(1)是酸性氧化物4HF+SiO2==SiF4↑+2H2O 一、二氧化硅—性质稳定, 不活泼归纳小结怎样制备硅酸?提出问题小组讨论:设计制备硅酸的实验方案 实验:在试管中加入饱和Na2SiO3溶液1-2mL,滴入一滴酚酞,再逐滴滴加稀盐酸至溶液红色接近消失时停止,静置。①滴入酚酞溶液呈红色① Na2SiO3溶液呈碱性②滴入盐酸有凝胶产生②硅酸难溶于水Na2SiO3+2HCl = H2SiO3 +2NaCl实验探究(胶体)请设计实验比较硅酸与碳酸的酸性强弱?实验:制备CO2并通入Na2SiO3溶液中方程式:Na2SiO3+H2O+CO2==H2SiO3(胶体)+Na2CO3结论:硅酸是一种很弱的酸,酸性比碳酸还弱实验探究现象:注意:①注射器中的硫酸分多次加 入反应瓶中
②边通二氧化碳边振荡试管 装置:滴加酚酞的饱和
Na2SiO31-2mL约5mL稀硫酸3药匙Na2CO3固体思维拓展1、用大理石代替碳酸钠粉末,还能得出实验结论吗?2、用盐酸代替稀硫酸,实验结论还可靠吗?
二、硅酸(H2SiO3)(2)很弱的酸(酸性比碳酸还弱)(3)由于SiO2不溶于水,所以硅酸是通过可溶性硅酸盐与其它酸反应制得的。(1)溶解度很小归纳小结1、下列各组物质有关性质关系的比较,正确的是( )
A.溶解性:CO2 H2CO3
C.熔点:SiO2 > CO2(干冰) D.硬度: SiO22、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成雕花玻璃的物质是 ( )
A、烧碱 B、纯碱
C、氢氟酸 D、盐酸CC当堂达标1、学习重要的非金属元素硅的化合物二氧化硅和硅酸的化学性质。2、了解硅酸的制备、硅酸和碳酸酸性比较方法课堂小结谢谢!
2、化学稳定性如何?根据SiO2的存在和应用,请分析以下问题:3、SiO2能发生哪些化学反应?SiO2是酸性氧化物 ,可以发生哪些反应?CO2+H2O=H2CO3CO2+2NaOH =
Na2CO3+H2OCO2+Na2O=Na2CO3SiO2+2NaOH =
Na2SiO3+H2OSiO2+ Na2O ==
Na2SiO3高温类比学习 问题:实验室盛装NaOH溶液的试剂瓶为什么不能用玻璃塞?硅酸钠水溶液俗名“水玻璃”具有黏性,可用作粘合剂。与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O思考交流7SiO2 + 4HF =SiF4↑ + 2H2O氢氟酸(HF)是唯一可以与SiO2 反应的酸问题:用什么来刻蚀玻璃?思考交流SiO2的特性:高温化学性质(2)难溶于水,不与水反应(3)不与酸反应(除氢氟酸以外)SiO2 + Na2O === Na2SiO3 SiO2 + 2NaOH == Na2SiO3 + H2O(1)是酸性氧化物4HF+SiO2==SiF4↑+2H2O 一、二氧化硅—性质稳定, 不活泼归纳小结怎样制备硅酸?提出问题小组讨论:设计制备硅酸的实验方案 实验:在试管中加入饱和Na2SiO3溶液1-2mL,滴入一滴酚酞,再逐滴滴加稀盐酸至溶液红色接近消失时停止,静置。①滴入酚酞溶液呈红色① Na2SiO3溶液呈碱性②滴入盐酸有凝胶产生②硅酸难溶于水Na2SiO3+2HCl = H2SiO3 +2NaCl实验探究(胶体)请设计实验比较硅酸与碳酸的酸性强弱?实验:制备CO2并通入Na2SiO3溶液中方程式:Na2SiO3+H2O+CO2==H2SiO3(胶体)+Na2CO3结论:硅酸是一种很弱的酸,酸性比碳酸还弱实验探究现象:注意:①注射器中的硫酸分多次加 入反应瓶中
②边通二氧化碳边振荡试管 装置:滴加酚酞的饱和
Na2SiO31-2mL约5mL稀硫酸3药匙Na2CO3固体思维拓展1、用大理石代替碳酸钠粉末,还能得出实验结论吗?2、用盐酸代替稀硫酸,实验结论还可靠吗?
二、硅酸(H2SiO3)(2)很弱的酸(酸性比碳酸还弱)(3)由于SiO2不溶于水,所以硅酸是通过可溶性硅酸盐与其它酸反应制得的。(1)溶解度很小归纳小结1、下列各组物质有关性质关系的比较,正确的是( )
A.溶解性:CO2
C.熔点:SiO2 > CO2(干冰) D.硬度: SiO2
A、烧碱 B、纯碱
C、氢氟酸 D、盐酸CC当堂达标1、学习重要的非金属元素硅的化合物二氧化硅和硅酸的化学性质。2、了解硅酸的制备、硅酸和碳酸酸性比较方法课堂小结谢谢!
