少科班讲义、练习__物质的组成[下学期]
文档属性
| 名称 | 少科班讲义、练习__物质的组成[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 47.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2007-03-28 20:20:00 | ||
图片预览




文档简介
科学少科班讲义、练习
初三 第一讲参考答案
二、典型例题
1.B 2. c+d , c+d-(a-b) 3.D 4.D
5.①分子 、原子、离子 ②质子 、中子、电子 ③分子、原子、 中子
④ 电子
⑤分子 ⑥质子 、中子
⑦ 中子
6.A
三、基本练习
1. C 2. D 3. D 4. C 5. D 6. B
7. D 8. B 9. C 10.C 11. D
12.C 13. C 14.B 15. A 16.B 17. B
18.2Cl,2个氯原子,2Cl-,2个氯离子,2O3,2个臭氧分子+2,
Cu,正2价的铜元素,S2-,带2个负电荷的硫离子
19.天然水,石灰水,洁净的空气,硫磺,氢气,氖气,二氧化碳,氧化镁,
氯酸钾,二氧化碳,氯化锌,氧化镁
20.(1)3N2; (2)2Fe3+ (3)nNH3 (4)HNO3 (5)H3S
21. x:C2H6O,y:CH4O,CH3OH,饮用量大时会使人死亡。C2H6O
22. (1) FeCl2+ H2高温 Fe + 2HCl;
(2) 防止氢氧混合爆炸。
23. 2C12H30O2+37O2=24CO2+30H2O
24. (1)置换反应; (2) 缺少氧气 (3)钠的密度小于水,大于煤油
25. 氧化物,+4, 化学方程式:H2SO4+SO2+2 NaClO3= 2NaHSO4+ 2ClO2
26. Hg+S=HgS,下
27.(1) 与水反应 (2)不能,成本贵 (3)用无水硫酸铜检验遇水变蓝色。
28. 1:2
29.解:⑴设产生氨气的质量为x
2NH3+H2SO4=(NH4)2SO4
2×17 98
X 9.5 g×4.9%
X≈0.16 g (1分)
⑵氨气中氮元素的质量分数为82.4% (1分)
30 mL牛奶中含氮元素的质量为≈0.13 g (1分)
⑶30 mL牛奶中含蛋白质的质量为≈0.81 g (1分)
100 mL牛奶中含蛋白质的质量为2.70 g (1分)
因为2.70 g<2.90 g 所以蛋白质的含量没有达到质量标准 (1分)
答:氨气的质量为0.16 g,氮元素的质量为0.13g,该牛奶样品中蛋白质的含量没有达到
质量标准。
四、提高题(单科班习题)
1. D 2. C 3. B 4. C 5. D 6. B
7. C 8. C 9. B 10. C 11.A
12.1) ACE
2) 置换反应 : 一定是, 化合反应: 不一定,
分解反应: 不一定 复分解反应 : 一定不是
13. 6:9:8 14. Rn(SO4)m; Rn(CO3)m+2mHCl=nRCl2m/n+mH2O+mCO2。 15. P2O5
16.
规律 排列顺序
示例:标准状况下,密度由小到大 CH4、NH3、C2H4、O2、CO2
每个分子中原子个数由小到大 O2、CO2、NH3 、CH4、C2H4
相对分子质量由小到大 CH4、NH3、C2H4、O2、CO2
17. 31% 18.C55H75N4MgO5
科学少科班讲义、练习
初三——原子
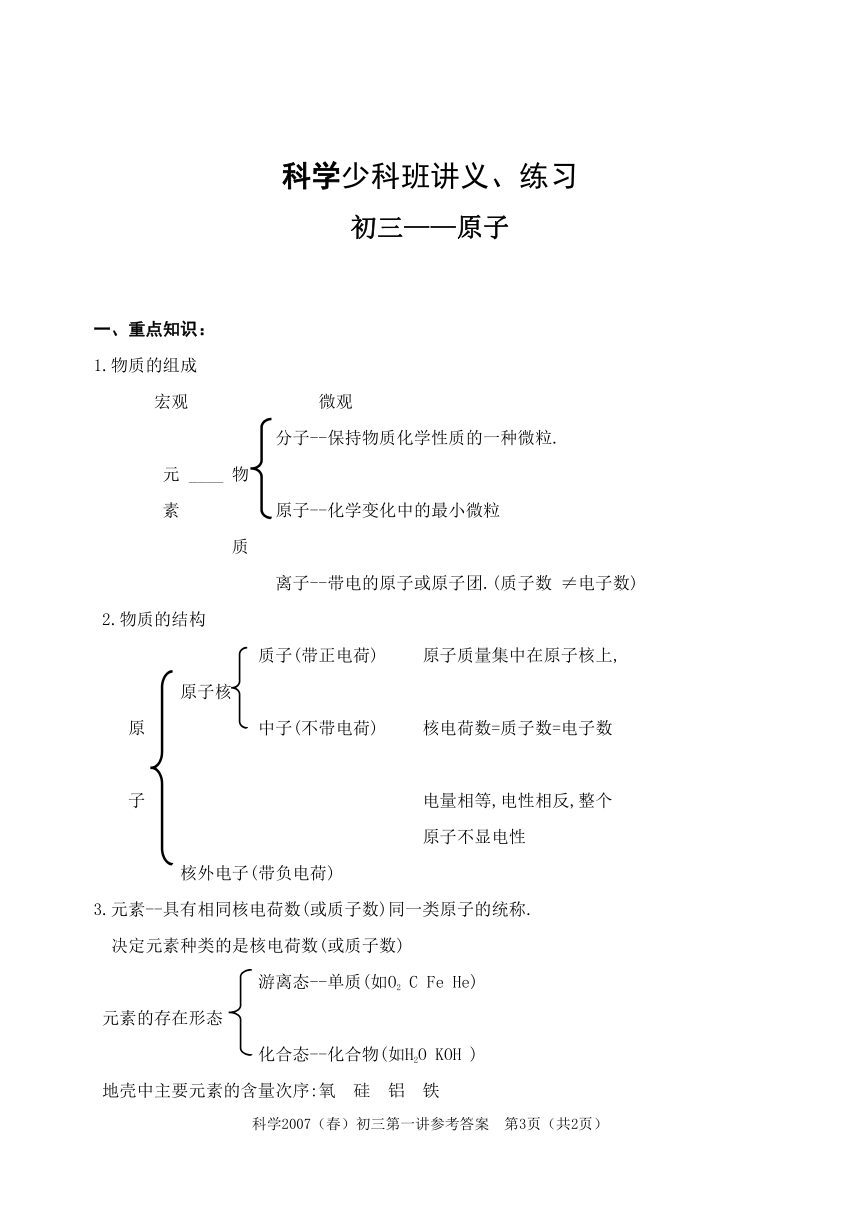
一、重点知识:
1.物质的组成
宏观 微观
分子--保持物质化学性质的一种微粒.
元 ____ 物
素 原子--化学变化中的最小微粒
质
离子--带电的原子或原子团.(质子数 ≠电子数)
2.物质的结构
质子(带正电荷) 原子质量集中在原子核上,
原子核
原 中子(不带电荷) 核电荷数=质子数=电子数
子 电量相等,电性相反,整个
原子不显电性
核外电子(带负电荷)
3.元素--具有相同核电荷数(或质子数)同一类原子的统称.
决定元素种类的是核电荷数(或质子数)
游离态--单质(如O2 C Fe He)
元素的存在形态
化合态--化合物(如H2O KOH )
地壳中主要元素的含量次序:氧 硅 铝 铁
4.物质的分类
混合物 如空气、溶液等
金属:如Fe、Cu等
固体:如C、S、P等
单质 非金属
气体:如O2、H2、N2等
物质 稀有气体:如He、Ne、Ar等
酸性氧化物:如CO2、SO2等
氧化物 碱性氧化物:如CaO、CuO等
其它氧化物:如H2O、CO等
含氧酸:如HNO3、H2SO4、H2SO3
纯净物 酸 无氧酸:如HCl、H2S等
无机化合物 可溶性碱:如NaOH、KOH、等
碱 微溶性碱:如Ca(OH)2
难溶性碱:如Cu(OH)2等
正盐:如NaCl、FeCl3、CuSO4
化合物 盐 酸式盐:如NaHSO4、NaHCO3等
碱式盐:如Cu2(OH)2CO3等
CH4
有机化合物 C2H5OH
CH3OH
CH3COOH
5.物质的性质和变化
物理性质:颜色 状态 气味 溶解性 密度 沸点
物质的性质
化学性质:可燃性 氧化性 还原性 酸碱性
物理变化--没有新物质生成,不一定伴有化学变化.
物质的变化
化学变化--有新物质生成,一定伴有物理变化.
6.化学方程式
<1>质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律的实质:原子的种类.原子数目在反应前后不变。
<2> 化学反应基本类型:分解反应 化合反应 置换反应 复分解反应
二、典型例题
1.下列有关分子、原子、离子的叙述正确的是――――――――――――――( )
A.分子是化学变化中的最小微粒 B.离子是构成物质的一种微粒
C.原子得到电子后变成阳离子 D.原子是不能再分的一种微粒
2.蜡烛燃烧前的质量为ag,燃烧后的质量为bg,生成的CO2为cg,水蒸气为dg,则产物为 薄 g,参与反应的O2 为 g。
3.硒是抗衰老元素,且能抑制癌细胞生长。“北大富硒康”中含有硒酸根离子
(SeO42-)则在硒酸根离子中硒元素的化合价为――――――――――――――( )
A.―2价 B.―4价 C.+4价 D.+6价
4.对过氧化氢(H2O2)的组成叙述正确的是――――――――――――――――( )
A.由一个氢分子和一个氧分子组成 B.由二个氢元素和二个氧元素组成
C.由一个水分子和一个氧原子结合而成 D.由氧、氢两种元素组成
5.将分子,原子,离子,质子,中子,电子等粒子名称填入下列适当空格中:
①构成物质的基本粒子有:
②构成原子的基本粒子有 :
③显示电中性的粒子有:
④质量最小的粒子有:
⑤参加化学反应一定发生变化的粒子是:
⑥原子中质量相等的粒子是:
⑦质量与氢原子质量近似相等的是:
6.某有机化合物2.2克在氧气中充分燃烧,将生成物依次通入盛有浓硫酸和石灰水的洗气瓶中,实验测得装有浓硫酸的洗气瓶增重3.6克,盛有石灰水的洗气瓶增重4.4克。则下列判断正确的是--------------------------------------------------( )
A.肯定含有碳、氢、氧三种元素 B.肯定含有碳、氢元素,可能含有氧元素
C.肯定含有碳、氢元素,不含氧元素 D.不可能同时含有碳、氢、氧三种元素
三、基本练习
1.下列变化中,前者是物理变化,后者是化学变化的是―――――――――――( )
①盐酸除锈,煤的燃烧。 ②白磷自燃,空气液化。
③三氧化硫溶于水,二氧化碳通入石灰水。 ④冰融化成水,倒置泡沫灭火器产生二氧化碳。
⑤白色硫酸铜粉末遇水变蓝,酸碱溶液使指示剂变色。
⑥ 蒸馏酒精和水的混合物,氢氧化钠溶液久置空气中,瓶口出现白色物。
A、①③ B、②⑤ C、④⑥ D、①⑤
2.下列有关物质的用途即利用了物质的物理性质,又利用了物质的化学性质的是( )
A. 干冰用于人工降雨 B. H2用于探空气球
C. 熟石灰用于改良酸性土壤 D. CO2用于灭火
3.氧化汞受热时的变化可用下图表示(图中大圆圈表示汞原子,小圆圈表示氧原子)
据图得出的下列结论错误的是――――――――――――――――――――――( )
A.氧化汞受热时能分解在汞和氧气 B.原子是化学变化中最小的粒子
C.分子在化学变化中可以再分, D.所有的物质都是由分子构成的
4.某元素在化合物中无变价,相对原子质量为137,已知其氯化物的相对分子质量为208,则其硝酸盐的相对分子质量为――――――――――――――――――――( )
A.199 B.323 C.261 D.336
5.有—种物质分子的模型如右图。则下列说法正确的是( )
A.该物质不是有机物 B.该物质的化学式是C2H5O
C.该物质是氧化物 D.该物质的化学式是C2H6O
6.下列各组物质中属于同素异形体的一组是―――――――――――――( )
A. 冰和水 B. 金刚石和石墨 C. 氧气和液氧 D. 一氧化碳和二氧化碳
7.下列物质能溶于水,且所得溶液的PH值大于7的是―――――――――( )
A.Fe2O3 B.SO3 C.NaCl D.Na2O
8.某化工厂通过电解食盐水制取一些工业的基本原料,此反应的产物中不可能存在的物质是--------------------------------------------------------------( )
A.烧碱 B.硫酸 C.氢气 D.氯气
9.下列物质中,属于纯净物的一组是―――――――――――――――――( )
①碘酒 ②胆矾 ③天然水 ④硫酸溶液 ⑤干冰 ⑥石灰石
⑦水银
A.②③④ B.①⑤ C.②⑤⑦ D.③④⑦
10.下列物质中的氮元素表现出可变化合价的种数是―――――――――――( )
HNO3、NO、NO2、N2O、N2O5、N2O3、NH3、N2、NH4NO3
A.五种 B.六种 C.七种 D.八种
11.下列方框中,符合2H2意义的示意图是――――――――――――――――( )
12.重水的主要用途是在核反应堆中作减速剂,一个重水分子是由两个重氢原子和一个氧原子构成的,重氢原子核电荷数为1,相对原子质量为2,下列说法中,正确的是( )
A.重水的相对分子质量为19 B.重氢原子核外有两个电子
C.重氢原子核内有1个中子 D.重氢原子核内有两个质子
13.天然气、液化石油气燃烧的化学方程式分别为:
CH4+2O2=CO2+2H2OC3H8+5O2=3CO2+4H2O现有一套以天然气为燃料
的灶具,要改为以液化石油气为燃料的灶具,应采取的措施是-----------------( )
A.燃料气和空气的进入量都减少 B.燃料气和空气的进入量都增大
C.减少燃料气进入量或增大空气进入量 D.增大燃料气进入量或减少空气进入量
14 .中国科学技术大学钱逸泰教授等以 CCI4。和金属钠为原料,在特定条件下制造出纳
米级 金刚石粉末。该成果发表在世界最权威的《科学》杂志上,立即被科学家们高度
评价 为“稻草变黄金”。下列说法中不正确的是--------------------------- ( )
A.金刚石属于非金属单质 B.制造金刚石过程中碳元素的化合价没有改变
C.CCl4 是一种化合物 D.制造金刚石的变化属于化学变化
15.“绿色化学”是21世纪化学发展的主导方向,它要求从根本上消灭污染,主要包括原
料绿色化、化学反应绿色化和产物的绿色化等,其中,化学反应绿色化要求原料物质中
的原子完全被利用,全部转入期望的产品中,下列反应符合“化学反应绿色化”的是( )
催化剂
A、工业生产乙醛(C2H4O):2C2H4+O2=====2C2H4O
高温
B、接触法生产硫酸中的第一步反应:4FeS2+11O2===8SO2↑+4Fe2O3
高温
C、制备高纯度的铜:CuO+CO===Cu+CO2
太阳能
D、利用太阳能完成能量的转化:2H2O======2H2+O2
16.2004 年 5 月 1 日实施的新交通法加大了对“酒后驾车”的处罚力度。交警常用装有重铬酸钾( K2Cr2O7 )的仪器,检测司机是否酒后驾车。其原理是红色的重铅酸钾遇酒精后生成蓝绿色物质。下列说法不正确的是 ----------------------------( )
A.该变化为化学变化 B.重铅酸钾中铬元素的化合价为十 3
C.分子是不断运动的 D.乙醇具有挥发性
17.地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物的分子式可能是-( )
A.XY2 B.X2Y3 C.XY D.X3Y4
18.写出下列符号中数字 "2"的意义.
2Cl____ _____ _______ 2Cl-_________ ___ 2O3________ _ __ +2
Cu____________ ___ _ _ S2-____________ __ __
19.在天然水、硫磺、氯酸钾、氢气、二氧化碳、氖气、石灰水、氯化锌、氧化镁、洁净
的空气中属于混合物___ _____ __ ___,属于单质_______ _ ___ _、
属于氧化物______ _____ ___ _,属于化合物_____ ____ ____ _
20.写出表示下列微粒的化学符号:(1)三个氮分子___ _; (2)两个铁离子___ _
(3)n个氨分子___ _ (4)硝酸___ _ (5)氢硫酸 ___ _
21.已知x、y是两种有机物,它们分别跟氧气起反应,其化学方程式如下:
,,试写出x、y的化学式:
x__ ,y_ ,其中__ 有毒,饮后会使人眼睛失明,饮用量大时会使人死亡。
22.新型材料纳米级α—Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。实验室采用气相还原法制备纳米α—Fe,方法是:将固体粉料FeCl2 nH2O脱水、真空干燥,然后在高温条件下通人高纯氮气(作保护气)和氢气(作还原剂)的混合气体,生成纳米α—Fe。请回答以下问题:
(1)写出生成纳米α-Fe的化学方程式________ ____ _________;
(2)反应中保护气的作用是______________ ____ ____ ________。
23.吸毒严重危害人的身心健康。“大麻”(其主要成分是C12H30O2)是一种常见的毒品,它
在空气中焚烧能生成二氧化碳和水。试写出这一反应的化学方程式 ___ ____ _
24.钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气:2Na+2H2O=2NaOH+H2↑,但
是它与煤油不会发生反应。把一小块银白色的金属钠投入盛有蒸馏水的烧杯中,可以看
到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和
生成的氢气都发生燃烧。如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,
可以看到金属钠悬浮在煤油和水的界面上,同样与水发生剧烈的反应,但是不发生燃烧。
(1)钠和水的反应类型是 ;
(2)在第二个实验中,钠也与水发生反应,但不发生燃烧,这是因为 _ 。
(3)在第一个实验中,钠浮在水面上;在第二个实验中,钠悬浮在煤油和水的界面上。
这两个现象说明了什么?
25.目前,饮水机的使用较为普遍。实验表明,如果饮水机不经常消毒,其中的饮用水当天就会受到来自饮水机的污染。饮水机消毒液有效成份之一为二氧化氯(ClO2),二氧化氯属于 ___ _ :(填“氧化物”、“酸”、“碱”、“盐”),其中氯元素的化合价为: ,以稀硫酸、二氧化硫与氯酸钠(NaClO3)为原料可制备二氧化氯,同时得到另一产物这硫酸氢钠(NaHSO4),写出该反应的化学方程式: __ ____ ____
26.汞蒸气有毒,万一把汞洒出,可以在微细汞滴上撒一层硫磺,这时发生反应的化学方程式是 ,室内有汞蒸气时应进行通风以降低汞蒸汽浓度,这时通风口装在墙 (上、下)部的效果高。
27.酒精是无色透明且具有特殊气味的易挥发的液体,能与水以任意比例互溶。工业酒精中约含乙醇96%,向其中加入新制生石灰加热,蒸馏出乙醇蒸气冷凝回收,即得无水酒精。试分析下列三个问题,若涉及化学反应,则写出化学反应方程式。
(1)新制生石灰作用:__________________________________
(2)能否用无水硫酸铜代替生石灰?原因是:_____________________________
(3)怎样检验一瓶酒精是否含有水?_________ ______________
28.含有相同质量的氧元素的NO2与NO中,所含氮元素的质量比为___ _。
29.为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式:NH3),再用稀硫酸吸收氨气,反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4,现取该牛奶样品30mL用“盖尔达法”分解其中的蛋白质,产 生的氨气用9.5g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
⑴产生氨气的质量是多少克?(计算结果精确到0.01g,下同)
⑵30mL牛奶中含氮元素的质量是多少克?
⑶右下图是该牛奶包装标签的部分内容。已知牛奶的蛋白质
含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到
了包装标签所标示的蛋白质的质量标准。
四、提高题(单科班习题)
1.下列符号所表示的粒子在化学变化中不能再分的是-----------------------( )
A.H2O B.O2 C.CO32- D.O
2.亚铁离子Fe2+共含有24个电子,,Fe3+离子核内含有的质子数是--------------( )
A. 24 B.25 C.26 D.27
3. 我国近年研制成功一种气体,这种气体的每个分子由质子数为8、相对原子质量为18的两个原子构成。下列说法错误的是--------------------------------------( )
A.这种气体的相对分子质量为36 B.这种原子的核外不一定有8个电子
C.这种气体中氧元素的化合价为零
D.这种原子与氢原子能构成相对分子质量为20的水分子
4.将A、B、C三种物质各10克,加热进行化合反应生成D(其中B是催化剂),当A已完全反应后,测得生成D16克,则反应后的混合物中B与C的质量比为---------( )
A.4∶1 B.5∶1 C.5∶2 D.5∶3
5.19世纪化学家对氧化锆的化学式有过争议,便进行了一系列实验来验证。经测定锆(Zr)原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为233.若锆在氯化物和氧化物中的化合价相同,则氧化锆的化学式为---------------------------( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO 2
6.如果在宇宙飞船上划燃火柴,火焰会立即熄灭,这是由于------------------( )
A. O2不够 B.在失重情况下,空气不对流
C. 宇宙飞船上温度低 D. 达不到着火点
7.某含氧酸的化学式为HnXO2n-1,该含氧酸受热分解生成的氧化物化学式不可能是( )
A.X2O B.XO2 C.X2O3 D.X2O7
8.一瓶气体经过化验知其中只有一种元素,则该气体是----------------------( )
A.一种单质 B.一种化合物
C.既可能是一种单质,也可能是几种单质的混合物
D.单质与化合物的混合物
9.钢和铝是日常生活和生产中重要的金瞩。钛( Ti )有许多神奇的性能,越来越引起人们的关注,是 21 世纪的重要金属之一。依据三种金属的性质和用途,判断下列说法错误的是 -----------------------------------------------------------( )
A.钛或钛合金放到海水中数年,取出后仍光亮如初B,这说明钛具有很强的抗腐蚀性。
B.将大小、厚薄相等的铜、铝、钛分别放人盛有稀盐酸的试管中,观察到盛钛的试 管放出气泡缓慢,盛铝的试管放出气泡快。铜的试管无现象,由此可推测三种金属的活动性顺序为 Al > Cu > Ti 。
C.某同学的钢制眼镜框表面出现了绿色物质【主要成分Cu2( OH)2CO3 ]可用稀盐酸除去。
D.高层建筑常采用铝合金门窗而不采用铁门窗,主要原因是铝的密度小且易形成一层致密的氧化物薄膜。
10.多数食品容易吸收空气中的水分变潮湿,并与空气中的氧气反应而用政。生产上多在食品中放人一小包 CaO 粉末,可使食品保持干燥。现已研究成功在食品中放人一 小包铁粉(包裹在多孔泡沫中),铁粉吸收水分和氧气变为铁锈,从而保护食品。下列说法不正确的是 ---------------------------------------------------------( )
A.两种干燥剂袋上都要有明显的“勿食”字样 B.铁粉干燥剂能与水和氧气发生化学反应
C.CaO干燥剂在空气中只与水发生反应 D.生成的铁锈是一种混合物
11.铜粉和炭粉的混合物在空气中充分灼烧后,最终得到的黑色物质与原混合物质量相等,则炭粉在原混合物中的质量分数为--------------------------------------( )
A. 20% B. 80% C. 15.8% D. 84.2%
12.在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如
0 0 +1-1 2Na+Cl2=2NaCl
反应前后,Na,Cl的化合价发生了变化,该反应是氧化还原反应。
1)根据化合价是否发生变化进行分析,下列反应属于氧化还原反应的是(填序号)( )
A.2Mg+O2点燃2MgO B.CaO+H2O=Ca(OH)2↑ C.2KClO3加热2KCl+3O2↑
D.CaCO3高温CaO+CO2↑ E.H2+CuO加热Cu+H2O F.HCl+NaOH=NaCl+H2O
2)根据上面的分析和推理,对四种基本反应类型是否属于氧化还原反应做出恰当概括
置换反应 : ___ ____ ____ _ 化合反应: ___ ____ ____ _
分解反应: ___ ____ ____ _ 复分解反应 : ___ ____ ____ _
13.三份等质量的铁分别与氧气化合,形成FeO、Fe2O3、Fe3O4三种化合物,则反应中与等质量铁相结合的氧元素的质量比为___ ____ _。
14.某金属元素R的碳酸盐的化学式为Rn(CO3)m,若R为不变价金属元素,则R的硫酸盐的化学式为___ ___ ;Rn(CO3)m与足量盐酸反应的化学方程式为___ ____ ____
15.有一包固体混合物由两种物质组成,它们可能是CuO、MgO、Fe3O4、Al2O3、P2O5,现测定
该混合物含氧量为50%,则该混合物中一定含有___ _。
16.物质之间既相互联系,又存在规律,这是我们学好化学应该掌握的一种基本方法。请你仿照下表中的示便。找出O2 CO2、NH3、 C2H4(乙稀)五种气体之间的存在的另外两个规律,并排列出顺序,将答案填在下表中的空格内。
规律 排列顺序
示例:标准状况下,密度由小到大 CH4、NH3、C2H4、O2、CO2
17.已知 和 的混合物中硫元素的质量分数为23%,则铁元素的质量分数为 ___ _
18.减弱“温室效应”有效措施之一是大量植树造林,绿色植物在叶绿素存在的光合作用是完成二氧化碳循环的重要环节。已知叶绿素的相对分子质量小于900,其分子含C 73.8%,(以下均指质量分数)、H 8.3%、N 6.3 %、Mg 2.7%、其余为0。试确定叶绿素的化学式。
(方法提示:设一个分子中有一个Mg原子)
配料:鲜牛奶
保质期:8个月
净含量:250mL/盒
营养成分:(每100mL)
钙≥0.11g
脂肪≥3.30g
蛋白质≥2.90g
科学2007(春)初三第一讲参考答案 第3页(共2页)
初三 第一讲参考答案
二、典型例题
1.B 2. c+d , c+d-(a-b) 3.D 4.D
5.①分子 、原子、离子 ②质子 、中子、电子 ③分子、原子、 中子
④ 电子
⑤分子 ⑥质子 、中子
⑦ 中子
6.A
三、基本练习
1. C 2. D 3. D 4. C 5. D 6. B
7. D 8. B 9. C 10.C 11. D
12.C 13. C 14.B 15. A 16.B 17. B
18.2Cl,2个氯原子,2Cl-,2个氯离子,2O3,2个臭氧分子+2,
Cu,正2价的铜元素,S2-,带2个负电荷的硫离子
19.天然水,石灰水,洁净的空气,硫磺,氢气,氖气,二氧化碳,氧化镁,
氯酸钾,二氧化碳,氯化锌,氧化镁
20.(1)3N2; (2)2Fe3+ (3)nNH3 (4)HNO3 (5)H3S
21. x:C2H6O,y:CH4O,CH3OH,饮用量大时会使人死亡。C2H6O
22. (1) FeCl2+ H2高温 Fe + 2HCl;
(2) 防止氢氧混合爆炸。
23. 2C12H30O2+37O2=24CO2+30H2O
24. (1)置换反应; (2) 缺少氧气 (3)钠的密度小于水,大于煤油
25. 氧化物,+4, 化学方程式:H2SO4+SO2+2 NaClO3= 2NaHSO4+ 2ClO2
26. Hg+S=HgS,下
27.(1) 与水反应 (2)不能,成本贵 (3)用无水硫酸铜检验遇水变蓝色。
28. 1:2
29.解:⑴设产生氨气的质量为x
2NH3+H2SO4=(NH4)2SO4
2×17 98
X 9.5 g×4.9%
X≈0.16 g (1分)
⑵氨气中氮元素的质量分数为82.4% (1分)
30 mL牛奶中含氮元素的质量为≈0.13 g (1分)
⑶30 mL牛奶中含蛋白质的质量为≈0.81 g (1分)
100 mL牛奶中含蛋白质的质量为2.70 g (1分)
因为2.70 g<2.90 g 所以蛋白质的含量没有达到质量标准 (1分)
答:氨气的质量为0.16 g,氮元素的质量为0.13g,该牛奶样品中蛋白质的含量没有达到
质量标准。
四、提高题(单科班习题)
1. D 2. C 3. B 4. C 5. D 6. B
7. C 8. C 9. B 10. C 11.A
12.1) ACE
2) 置换反应 : 一定是, 化合反应: 不一定,
分解反应: 不一定 复分解反应 : 一定不是
13. 6:9:8 14. Rn(SO4)m; Rn(CO3)m+2mHCl=nRCl2m/n+mH2O+mCO2。 15. P2O5
16.
规律 排列顺序
示例:标准状况下,密度由小到大 CH4、NH3、C2H4、O2、CO2
每个分子中原子个数由小到大 O2、CO2、NH3 、CH4、C2H4
相对分子质量由小到大 CH4、NH3、C2H4、O2、CO2
17. 31% 18.C55H75N4MgO5
科学少科班讲义、练习
初三——原子
一、重点知识:
1.物质的组成
宏观 微观
分子--保持物质化学性质的一种微粒.
元 ____ 物
素 原子--化学变化中的最小微粒
质
离子--带电的原子或原子团.(质子数 ≠电子数)
2.物质的结构
质子(带正电荷) 原子质量集中在原子核上,
原子核
原 中子(不带电荷) 核电荷数=质子数=电子数
子 电量相等,电性相反,整个
原子不显电性
核外电子(带负电荷)
3.元素--具有相同核电荷数(或质子数)同一类原子的统称.
决定元素种类的是核电荷数(或质子数)
游离态--单质(如O2 C Fe He)
元素的存在形态
化合态--化合物(如H2O KOH )
地壳中主要元素的含量次序:氧 硅 铝 铁
4.物质的分类
混合物 如空气、溶液等
金属:如Fe、Cu等
固体:如C、S、P等
单质 非金属
气体:如O2、H2、N2等
物质 稀有气体:如He、Ne、Ar等
酸性氧化物:如CO2、SO2等
氧化物 碱性氧化物:如CaO、CuO等
其它氧化物:如H2O、CO等
含氧酸:如HNO3、H2SO4、H2SO3
纯净物 酸 无氧酸:如HCl、H2S等
无机化合物 可溶性碱:如NaOH、KOH、等
碱 微溶性碱:如Ca(OH)2
难溶性碱:如Cu(OH)2等
正盐:如NaCl、FeCl3、CuSO4
化合物 盐 酸式盐:如NaHSO4、NaHCO3等
碱式盐:如Cu2(OH)2CO3等
CH4
有机化合物 C2H5OH
CH3OH
CH3COOH
5.物质的性质和变化
物理性质:颜色 状态 气味 溶解性 密度 沸点
物质的性质
化学性质:可燃性 氧化性 还原性 酸碱性
物理变化--没有新物质生成,不一定伴有化学变化.
物质的变化
化学变化--有新物质生成,一定伴有物理变化.
6.化学方程式
<1>质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律的实质:原子的种类.原子数目在反应前后不变。
<2> 化学反应基本类型:分解反应 化合反应 置换反应 复分解反应
二、典型例题
1.下列有关分子、原子、离子的叙述正确的是――――――――――――――( )
A.分子是化学变化中的最小微粒 B.离子是构成物质的一种微粒
C.原子得到电子后变成阳离子 D.原子是不能再分的一种微粒
2.蜡烛燃烧前的质量为ag,燃烧后的质量为bg,生成的CO2为cg,水蒸气为dg,则产物为 薄 g,参与反应的O2 为 g。
3.硒是抗衰老元素,且能抑制癌细胞生长。“北大富硒康”中含有硒酸根离子
(SeO42-)则在硒酸根离子中硒元素的化合价为――――――――――――――( )
A.―2价 B.―4价 C.+4价 D.+6价
4.对过氧化氢(H2O2)的组成叙述正确的是――――――――――――――――( )
A.由一个氢分子和一个氧分子组成 B.由二个氢元素和二个氧元素组成
C.由一个水分子和一个氧原子结合而成 D.由氧、氢两种元素组成
5.将分子,原子,离子,质子,中子,电子等粒子名称填入下列适当空格中:
①构成物质的基本粒子有:
②构成原子的基本粒子有 :
③显示电中性的粒子有:
④质量最小的粒子有:
⑤参加化学反应一定发生变化的粒子是:
⑥原子中质量相等的粒子是:
⑦质量与氢原子质量近似相等的是:
6.某有机化合物2.2克在氧气中充分燃烧,将生成物依次通入盛有浓硫酸和石灰水的洗气瓶中,实验测得装有浓硫酸的洗气瓶增重3.6克,盛有石灰水的洗气瓶增重4.4克。则下列判断正确的是--------------------------------------------------( )
A.肯定含有碳、氢、氧三种元素 B.肯定含有碳、氢元素,可能含有氧元素
C.肯定含有碳、氢元素,不含氧元素 D.不可能同时含有碳、氢、氧三种元素
三、基本练习
1.下列变化中,前者是物理变化,后者是化学变化的是―――――――――――( )
①盐酸除锈,煤的燃烧。 ②白磷自燃,空气液化。
③三氧化硫溶于水,二氧化碳通入石灰水。 ④冰融化成水,倒置泡沫灭火器产生二氧化碳。
⑤白色硫酸铜粉末遇水变蓝,酸碱溶液使指示剂变色。
⑥ 蒸馏酒精和水的混合物,氢氧化钠溶液久置空气中,瓶口出现白色物。
A、①③ B、②⑤ C、④⑥ D、①⑤
2.下列有关物质的用途即利用了物质的物理性质,又利用了物质的化学性质的是( )
A. 干冰用于人工降雨 B. H2用于探空气球
C. 熟石灰用于改良酸性土壤 D. CO2用于灭火
3.氧化汞受热时的变化可用下图表示(图中大圆圈表示汞原子,小圆圈表示氧原子)
据图得出的下列结论错误的是――――――――――――――――――――――( )
A.氧化汞受热时能分解在汞和氧气 B.原子是化学变化中最小的粒子
C.分子在化学变化中可以再分, D.所有的物质都是由分子构成的
4.某元素在化合物中无变价,相对原子质量为137,已知其氯化物的相对分子质量为208,则其硝酸盐的相对分子质量为――――――――――――――――――――( )
A.199 B.323 C.261 D.336
5.有—种物质分子的模型如右图。则下列说法正确的是( )
A.该物质不是有机物 B.该物质的化学式是C2H5O
C.该物质是氧化物 D.该物质的化学式是C2H6O
6.下列各组物质中属于同素异形体的一组是―――――――――――――( )
A. 冰和水 B. 金刚石和石墨 C. 氧气和液氧 D. 一氧化碳和二氧化碳
7.下列物质能溶于水,且所得溶液的PH值大于7的是―――――――――( )
A.Fe2O3 B.SO3 C.NaCl D.Na2O
8.某化工厂通过电解食盐水制取一些工业的基本原料,此反应的产物中不可能存在的物质是--------------------------------------------------------------( )
A.烧碱 B.硫酸 C.氢气 D.氯气
9.下列物质中,属于纯净物的一组是―――――――――――――――――( )
①碘酒 ②胆矾 ③天然水 ④硫酸溶液 ⑤干冰 ⑥石灰石
⑦水银
A.②③④ B.①⑤ C.②⑤⑦ D.③④⑦
10.下列物质中的氮元素表现出可变化合价的种数是―――――――――――( )
HNO3、NO、NO2、N2O、N2O5、N2O3、NH3、N2、NH4NO3
A.五种 B.六种 C.七种 D.八种
11.下列方框中,符合2H2意义的示意图是――――――――――――――――( )
12.重水的主要用途是在核反应堆中作减速剂,一个重水分子是由两个重氢原子和一个氧原子构成的,重氢原子核电荷数为1,相对原子质量为2,下列说法中,正确的是( )
A.重水的相对分子质量为19 B.重氢原子核外有两个电子
C.重氢原子核内有1个中子 D.重氢原子核内有两个质子
13.天然气、液化石油气燃烧的化学方程式分别为:
CH4+2O2=CO2+2H2OC3H8+5O2=3CO2+4H2O现有一套以天然气为燃料
的灶具,要改为以液化石油气为燃料的灶具,应采取的措施是-----------------( )
A.燃料气和空气的进入量都减少 B.燃料气和空气的进入量都增大
C.减少燃料气进入量或增大空气进入量 D.增大燃料气进入量或减少空气进入量
14 .中国科学技术大学钱逸泰教授等以 CCI4。和金属钠为原料,在特定条件下制造出纳
米级 金刚石粉末。该成果发表在世界最权威的《科学》杂志上,立即被科学家们高度
评价 为“稻草变黄金”。下列说法中不正确的是--------------------------- ( )
A.金刚石属于非金属单质 B.制造金刚石过程中碳元素的化合价没有改变
C.CCl4 是一种化合物 D.制造金刚石的变化属于化学变化
15.“绿色化学”是21世纪化学发展的主导方向,它要求从根本上消灭污染,主要包括原
料绿色化、化学反应绿色化和产物的绿色化等,其中,化学反应绿色化要求原料物质中
的原子完全被利用,全部转入期望的产品中,下列反应符合“化学反应绿色化”的是( )
催化剂
A、工业生产乙醛(C2H4O):2C2H4+O2=====2C2H4O
高温
B、接触法生产硫酸中的第一步反应:4FeS2+11O2===8SO2↑+4Fe2O3
高温
C、制备高纯度的铜:CuO+CO===Cu+CO2
太阳能
D、利用太阳能完成能量的转化:2H2O======2H2+O2
16.2004 年 5 月 1 日实施的新交通法加大了对“酒后驾车”的处罚力度。交警常用装有重铬酸钾( K2Cr2O7 )的仪器,检测司机是否酒后驾车。其原理是红色的重铅酸钾遇酒精后生成蓝绿色物质。下列说法不正确的是 ----------------------------( )
A.该变化为化学变化 B.重铅酸钾中铬元素的化合价为十 3
C.分子是不断运动的 D.乙醇具有挥发性
17.地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物的分子式可能是-( )
A.XY2 B.X2Y3 C.XY D.X3Y4
18.写出下列符号中数字 "2"的意义.
2Cl____ _____ _______ 2Cl-_________ ___ 2O3________ _ __ +2
Cu____________ ___ _ _ S2-____________ __ __
19.在天然水、硫磺、氯酸钾、氢气、二氧化碳、氖气、石灰水、氯化锌、氧化镁、洁净
的空气中属于混合物___ _____ __ ___,属于单质_______ _ ___ _、
属于氧化物______ _____ ___ _,属于化合物_____ ____ ____ _
20.写出表示下列微粒的化学符号:(1)三个氮分子___ _; (2)两个铁离子___ _
(3)n个氨分子___ _ (4)硝酸___ _ (5)氢硫酸 ___ _
21.已知x、y是两种有机物,它们分别跟氧气起反应,其化学方程式如下:
,,试写出x、y的化学式:
x__ ,y_ ,其中__ 有毒,饮后会使人眼睛失明,饮用量大时会使人死亡。
22.新型材料纳米级α—Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。实验室采用气相还原法制备纳米α—Fe,方法是:将固体粉料FeCl2 nH2O脱水、真空干燥,然后在高温条件下通人高纯氮气(作保护气)和氢气(作还原剂)的混合气体,生成纳米α—Fe。请回答以下问题:
(1)写出生成纳米α-Fe的化学方程式________ ____ _________;
(2)反应中保护气的作用是______________ ____ ____ ________。
23.吸毒严重危害人的身心健康。“大麻”(其主要成分是C12H30O2)是一种常见的毒品,它
在空气中焚烧能生成二氧化碳和水。试写出这一反应的化学方程式 ___ ____ _
24.钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气:2Na+2H2O=2NaOH+H2↑,但
是它与煤油不会发生反应。把一小块银白色的金属钠投入盛有蒸馏水的烧杯中,可以看
到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和
生成的氢气都发生燃烧。如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,
可以看到金属钠悬浮在煤油和水的界面上,同样与水发生剧烈的反应,但是不发生燃烧。
(1)钠和水的反应类型是 ;
(2)在第二个实验中,钠也与水发生反应,但不发生燃烧,这是因为 _ 。
(3)在第一个实验中,钠浮在水面上;在第二个实验中,钠悬浮在煤油和水的界面上。
这两个现象说明了什么?
25.目前,饮水机的使用较为普遍。实验表明,如果饮水机不经常消毒,其中的饮用水当天就会受到来自饮水机的污染。饮水机消毒液有效成份之一为二氧化氯(ClO2),二氧化氯属于 ___ _ :(填“氧化物”、“酸”、“碱”、“盐”),其中氯元素的化合价为: ,以稀硫酸、二氧化硫与氯酸钠(NaClO3)为原料可制备二氧化氯,同时得到另一产物这硫酸氢钠(NaHSO4),写出该反应的化学方程式: __ ____ ____
26.汞蒸气有毒,万一把汞洒出,可以在微细汞滴上撒一层硫磺,这时发生反应的化学方程式是 ,室内有汞蒸气时应进行通风以降低汞蒸汽浓度,这时通风口装在墙 (上、下)部的效果高。
27.酒精是无色透明且具有特殊气味的易挥发的液体,能与水以任意比例互溶。工业酒精中约含乙醇96%,向其中加入新制生石灰加热,蒸馏出乙醇蒸气冷凝回收,即得无水酒精。试分析下列三个问题,若涉及化学反应,则写出化学反应方程式。
(1)新制生石灰作用:__________________________________
(2)能否用无水硫酸铜代替生石灰?原因是:_____________________________
(3)怎样检验一瓶酒精是否含有水?_________ ______________
28.含有相同质量的氧元素的NO2与NO中,所含氮元素的质量比为___ _。
29.为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式:NH3),再用稀硫酸吸收氨气,反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4,现取该牛奶样品30mL用“盖尔达法”分解其中的蛋白质,产 生的氨气用9.5g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
⑴产生氨气的质量是多少克?(计算结果精确到0.01g,下同)
⑵30mL牛奶中含氮元素的质量是多少克?
⑶右下图是该牛奶包装标签的部分内容。已知牛奶的蛋白质
含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到
了包装标签所标示的蛋白质的质量标准。
四、提高题(单科班习题)
1.下列符号所表示的粒子在化学变化中不能再分的是-----------------------( )
A.H2O B.O2 C.CO32- D.O
2.亚铁离子Fe2+共含有24个电子,,Fe3+离子核内含有的质子数是--------------( )
A. 24 B.25 C.26 D.27
3. 我国近年研制成功一种气体,这种气体的每个分子由质子数为8、相对原子质量为18的两个原子构成。下列说法错误的是--------------------------------------( )
A.这种气体的相对分子质量为36 B.这种原子的核外不一定有8个电子
C.这种气体中氧元素的化合价为零
D.这种原子与氢原子能构成相对分子质量为20的水分子
4.将A、B、C三种物质各10克,加热进行化合反应生成D(其中B是催化剂),当A已完全反应后,测得生成D16克,则反应后的混合物中B与C的质量比为---------( )
A.4∶1 B.5∶1 C.5∶2 D.5∶3
5.19世纪化学家对氧化锆的化学式有过争议,便进行了一系列实验来验证。经测定锆(Zr)原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为233.若锆在氯化物和氧化物中的化合价相同,则氧化锆的化学式为---------------------------( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO 2
6.如果在宇宙飞船上划燃火柴,火焰会立即熄灭,这是由于------------------( )
A. O2不够 B.在失重情况下,空气不对流
C. 宇宙飞船上温度低 D. 达不到着火点
7.某含氧酸的化学式为HnXO2n-1,该含氧酸受热分解生成的氧化物化学式不可能是( )
A.X2O B.XO2 C.X2O3 D.X2O7
8.一瓶气体经过化验知其中只有一种元素,则该气体是----------------------( )
A.一种单质 B.一种化合物
C.既可能是一种单质,也可能是几种单质的混合物
D.单质与化合物的混合物
9.钢和铝是日常生活和生产中重要的金瞩。钛( Ti )有许多神奇的性能,越来越引起人们的关注,是 21 世纪的重要金属之一。依据三种金属的性质和用途,判断下列说法错误的是 -----------------------------------------------------------( )
A.钛或钛合金放到海水中数年,取出后仍光亮如初B,这说明钛具有很强的抗腐蚀性。
B.将大小、厚薄相等的铜、铝、钛分别放人盛有稀盐酸的试管中,观察到盛钛的试 管放出气泡缓慢,盛铝的试管放出气泡快。铜的试管无现象,由此可推测三种金属的活动性顺序为 Al > Cu > Ti 。
C.某同学的钢制眼镜框表面出现了绿色物质【主要成分Cu2( OH)2CO3 ]可用稀盐酸除去。
D.高层建筑常采用铝合金门窗而不采用铁门窗,主要原因是铝的密度小且易形成一层致密的氧化物薄膜。
10.多数食品容易吸收空气中的水分变潮湿,并与空气中的氧气反应而用政。生产上多在食品中放人一小包 CaO 粉末,可使食品保持干燥。现已研究成功在食品中放人一 小包铁粉(包裹在多孔泡沫中),铁粉吸收水分和氧气变为铁锈,从而保护食品。下列说法不正确的是 ---------------------------------------------------------( )
A.两种干燥剂袋上都要有明显的“勿食”字样 B.铁粉干燥剂能与水和氧气发生化学反应
C.CaO干燥剂在空气中只与水发生反应 D.生成的铁锈是一种混合物
11.铜粉和炭粉的混合物在空气中充分灼烧后,最终得到的黑色物质与原混合物质量相等,则炭粉在原混合物中的质量分数为--------------------------------------( )
A. 20% B. 80% C. 15.8% D. 84.2%
12.在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如
0 0 +1-1 2Na+Cl2=2NaCl
反应前后,Na,Cl的化合价发生了变化,该反应是氧化还原反应。
1)根据化合价是否发生变化进行分析,下列反应属于氧化还原反应的是(填序号)( )
A.2Mg+O2点燃2MgO B.CaO+H2O=Ca(OH)2↑ C.2KClO3加热2KCl+3O2↑
D.CaCO3高温CaO+CO2↑ E.H2+CuO加热Cu+H2O F.HCl+NaOH=NaCl+H2O
2)根据上面的分析和推理,对四种基本反应类型是否属于氧化还原反应做出恰当概括
置换反应 : ___ ____ ____ _ 化合反应: ___ ____ ____ _
分解反应: ___ ____ ____ _ 复分解反应 : ___ ____ ____ _
13.三份等质量的铁分别与氧气化合,形成FeO、Fe2O3、Fe3O4三种化合物,则反应中与等质量铁相结合的氧元素的质量比为___ ____ _。
14.某金属元素R的碳酸盐的化学式为Rn(CO3)m,若R为不变价金属元素,则R的硫酸盐的化学式为___ ___ ;Rn(CO3)m与足量盐酸反应的化学方程式为___ ____ ____
15.有一包固体混合物由两种物质组成,它们可能是CuO、MgO、Fe3O4、Al2O3、P2O5,现测定
该混合物含氧量为50%,则该混合物中一定含有___ _。
16.物质之间既相互联系,又存在规律,这是我们学好化学应该掌握的一种基本方法。请你仿照下表中的示便。找出O2 CO2、NH3、 C2H4(乙稀)五种气体之间的存在的另外两个规律,并排列出顺序,将答案填在下表中的空格内。
规律 排列顺序
示例:标准状况下,密度由小到大 CH4、NH3、C2H4、O2、CO2
17.已知 和 的混合物中硫元素的质量分数为23%,则铁元素的质量分数为 ___ _
18.减弱“温室效应”有效措施之一是大量植树造林,绿色植物在叶绿素存在的光合作用是完成二氧化碳循环的重要环节。已知叶绿素的相对分子质量小于900,其分子含C 73.8%,(以下均指质量分数)、H 8.3%、N 6.3 %、Mg 2.7%、其余为0。试确定叶绿素的化学式。
(方法提示:设一个分子中有一个Mg原子)
配料:鲜牛奶
保质期:8个月
净含量:250mL/盒
营养成分:(每100mL)
钙≥0.11g
脂肪≥3.30g
蛋白质≥2.90g
科学2007(春)初三第一讲参考答案 第3页(共2页)
同课章节目录
- 第1章 科学入门
- 第1节 科学并不神秘
- 第2节 走进科学实验室
- 第3节 科学观察
- 第4节 科学测量
- 第5节 科学探究
- 第2章 观察生物
- 第1节 生物与非生物
- 第2节 细胞
- 第3节 生物体的结构层次
- 第4节 常见的动物
- 第5节 常见的植物
- 第6节 物种的多样性
- 第3章 人类的家园——地球
- 第1节 地球的形状和内部结构
- 第2节 地球仪和地图
- 第3节 组成地壳的岩石
- 第4节 地壳变动和火山地震
- 第5节 泥石流
- 第6节 地球表面的板块
- 第7节 地形和地形图
- 第4章 物质的特性
- 第1节 物质的构成
- 第2节 质量的测量
- 第3节 物质的密度
- 第4节 物质的比热
- 第5节 熔化与凝固
- 第6节 汽化与液化
- 第7节 升华与凝华
- 第8节 物理性质和化学性质
- 研究性学习课题
- 一 收集生物样品,尝试生物分类
- 二 观察动物的形态和生活习性
- 三 调查当地主要岩石类型
- 四 蒸馏法海水淡化
