化学第二轮复习[下学期]
图片预览




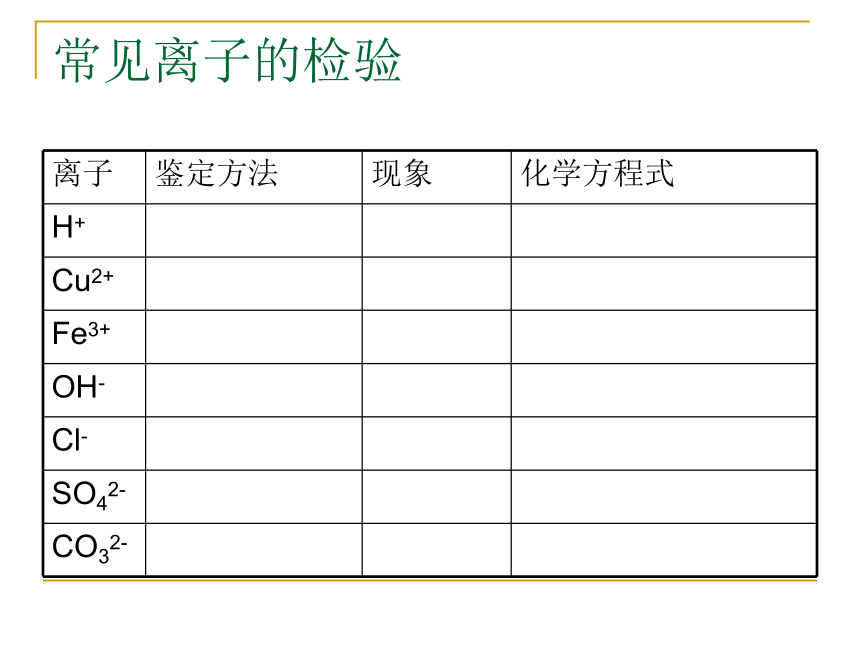

文档简介
课件12张PPT。化学第二轮复习重、难点知识
1,氧气的化学性质
2,制取氧气的原理
3,实验的基本操作
4,分子的含义
5,单质、化合物、氧化物的概念
6,有关化学式的计算
7,根据化合价写出分子式,根据分子式判断化合价8,质量守恒定律
9,氢气的制取及性质的操作
10,根据化学方程式的计算
11,二氧化碳的化学性质
12,实验室制取二氧化碳的操作
13,饱和溶液与不饱和溶液的含义
14,溶解度的概念及计算
15,溶解、蒸发、过滤的基本操作
16,有关溶液的计算
17,溶液的配制18,硫酸的性质及实验的操作
19,氢氧化钠的性质
20,碱和盐的性质实验
21,复分解反应的条件
22,常见的无机物间的关系。常见物质的鉴别常见离子的检验常见的题目类型1,在下列物质的溶液中,分别滴加氢氧化钠溶液,能产生红褐色沉淀的是
A CuCl2 ; B, BaCl2 C ,MgCl2 ; D, FeCl3
2、请你只用一种试剂将食盐水、氢氧化钠溶液、稀硫酸一次性鉴别出来,这种试剂是
A 稀盐酸 B 酚酞试液 C 石蕊试液 D石灰水
3、下列各组物质的溶液混合后(各组中最后一种物质的溶液过量),最终有沉淀生成的是
A ZnSO4 NaOH H2SO4 ,
B Na2CO3 NaCl HCl
C CaCl2 Na2CO3 HCl , D ZnSO4 Ba(OH)2 HNO34,被誉为”江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河。卤其“石有胭脂色”而
得名。胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色
石块A,粉碎后对其成分进行实验探究,实验记录如下图所示。 请你根据实验推断:A中含有的原子团是 (写离子符号)。
B中肯定含有的溶质是 (写化学式)。
写出实验中有关反应的化学方程式:②
⑤ 5.下列所示分别是二氧化碳的制取、干燥、收集和性质检验的装置图,其中正确的是 ( )
6,生铁和钢都是铁的合金,生铁中碳的含量在2.0%~4.3%之间,钢中碳的含量在0.03%~2.0%之间。将一块质量为8.5g的铁合金放入锥形瓶中,再向锥形瓶中加入91.9g稀H2SO4,恰好使铁合金中的铁完全反应(碳不溶于稀H2SO4,铁合金中其它元素含量很低,可忽略不计),测得生成H2的质量为0.3g。
试根据计算回答:
(1)该铁合金是生铁还是钢?
(2)反应后所得溶液的溶质质量分数。7.某化学兴趣小组设计了四套实验方案,来证明固体炭粉中是否含有氧化铜。其中可行的是
A.在样品中加水,是否有蓝色沉淀
B.在样品中加稀硫酸,充分反应后,是否有固体剩余
C.在空气中充分加热样品,恢复到原温度后,固体质量是否减小
D.在样品中加稀硫酸,充分反应后,溶液是否呈蓝色8.下列除杂的实验过程都正确的是(括号内为杂质)
A.MnO2 (KCl) 加水溶解、过滤、蒸发、结晶
B.BaSO4(BaCO3) 加足量稀盐酸、过滤、洗涤、干燥
C.CuO(Cu) 加足量稀盐酸、过滤、洗涤、干燥
D.KCl(K2CO3) 加足量稀盐酸、过滤、蒸发、结晶9,在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0 g后,再加入68.9 g
稀盐酸恰好完全反应。反应过程用精密仪器测得烧杯连同药品的总质量(m)与
反应时间(t)的关系如右图所示。烧杯连同药品的起始总质量为165.0 g。
反应的方程式为:NaHCO3+HCl==NaCl+H2O+CO2↑
试回答下列问题:
(1)完全反应时产生二氧化碳的质量为_____g
(2)原混合物中氯化钠的质量。
(3)反应后所得氯化钠溶液中溶质质量分数。
1,氧气的化学性质
2,制取氧气的原理
3,实验的基本操作
4,分子的含义
5,单质、化合物、氧化物的概念
6,有关化学式的计算
7,根据化合价写出分子式,根据分子式判断化合价8,质量守恒定律
9,氢气的制取及性质的操作
10,根据化学方程式的计算
11,二氧化碳的化学性质
12,实验室制取二氧化碳的操作
13,饱和溶液与不饱和溶液的含义
14,溶解度的概念及计算
15,溶解、蒸发、过滤的基本操作
16,有关溶液的计算
17,溶液的配制18,硫酸的性质及实验的操作
19,氢氧化钠的性质
20,碱和盐的性质实验
21,复分解反应的条件
22,常见的无机物间的关系。常见物质的鉴别常见离子的检验常见的题目类型1,在下列物质的溶液中,分别滴加氢氧化钠溶液,能产生红褐色沉淀的是
A CuCl2 ; B, BaCl2 C ,MgCl2 ; D, FeCl3
2、请你只用一种试剂将食盐水、氢氧化钠溶液、稀硫酸一次性鉴别出来,这种试剂是
A 稀盐酸 B 酚酞试液 C 石蕊试液 D石灰水
3、下列各组物质的溶液混合后(各组中最后一种物质的溶液过量),最终有沉淀生成的是
A ZnSO4 NaOH H2SO4 ,
B Na2CO3 NaCl HCl
C CaCl2 Na2CO3 HCl , D ZnSO4 Ba(OH)2 HNO34,被誉为”江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河。卤其“石有胭脂色”而
得名。胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色
石块A,粉碎后对其成分进行实验探究,实验记录如下图所示。 请你根据实验推断:A中含有的原子团是 (写离子符号)。
B中肯定含有的溶质是 (写化学式)。
写出实验中有关反应的化学方程式:②
⑤ 5.下列所示分别是二氧化碳的制取、干燥、收集和性质检验的装置图,其中正确的是 ( )
6,生铁和钢都是铁的合金,生铁中碳的含量在2.0%~4.3%之间,钢中碳的含量在0.03%~2.0%之间。将一块质量为8.5g的铁合金放入锥形瓶中,再向锥形瓶中加入91.9g稀H2SO4,恰好使铁合金中的铁完全反应(碳不溶于稀H2SO4,铁合金中其它元素含量很低,可忽略不计),测得生成H2的质量为0.3g。
试根据计算回答:
(1)该铁合金是生铁还是钢?
(2)反应后所得溶液的溶质质量分数。7.某化学兴趣小组设计了四套实验方案,来证明固体炭粉中是否含有氧化铜。其中可行的是
A.在样品中加水,是否有蓝色沉淀
B.在样品中加稀硫酸,充分反应后,是否有固体剩余
C.在空气中充分加热样品,恢复到原温度后,固体质量是否减小
D.在样品中加稀硫酸,充分反应后,溶液是否呈蓝色8.下列除杂的实验过程都正确的是(括号内为杂质)
A.MnO2 (KCl) 加水溶解、过滤、蒸发、结晶
B.BaSO4(BaCO3) 加足量稀盐酸、过滤、洗涤、干燥
C.CuO(Cu) 加足量稀盐酸、过滤、洗涤、干燥
D.KCl(K2CO3) 加足量稀盐酸、过滤、蒸发、结晶9,在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0 g后,再加入68.9 g
稀盐酸恰好完全反应。反应过程用精密仪器测得烧杯连同药品的总质量(m)与
反应时间(t)的关系如右图所示。烧杯连同药品的起始总质量为165.0 g。
反应的方程式为:NaHCO3+HCl==NaCl+H2O+CO2↑
试回答下列问题:
(1)完全反应时产生二氧化碳的质量为_____g
(2)原混合物中氯化钠的质量。
(3)反应后所得氯化钠溶液中溶质质量分数。
