化学式[下学期]
图片预览




文档简介
(共26张PPT)
物质分类及其变化规律
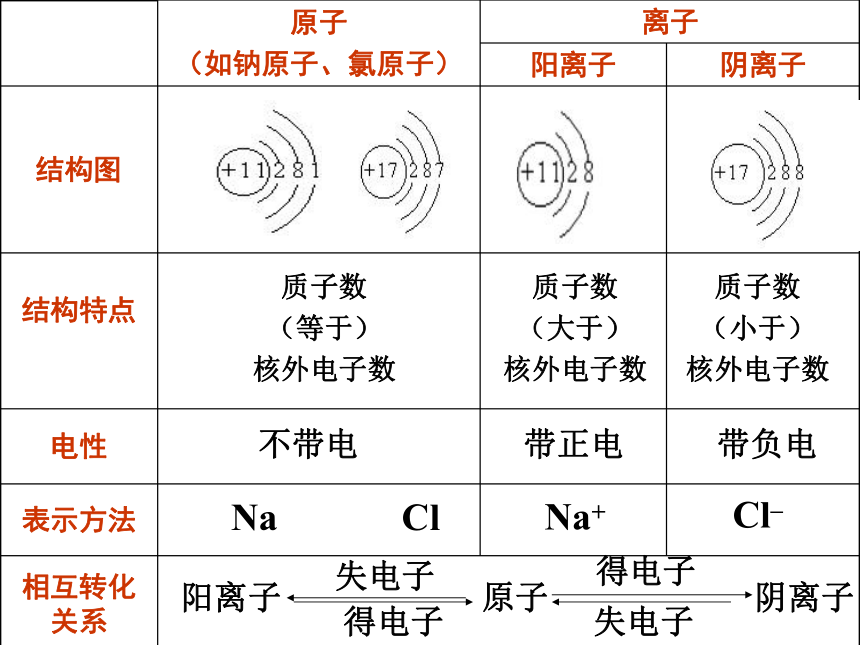
原子
(如钠原子、氯原子) 离子
阳离子 阴离子
结构图
结构特点
电性
表示方法
相互转化关系
质子数
(等于)
核外电子数
质子数
(大于)
核外电子数
质子数
(小于)
核外电子数
不带电
带正电
带负电
Na Cl
Na+
Cl–
原子
阳离子
阴离子
失电子
得电子
得电子
失电子
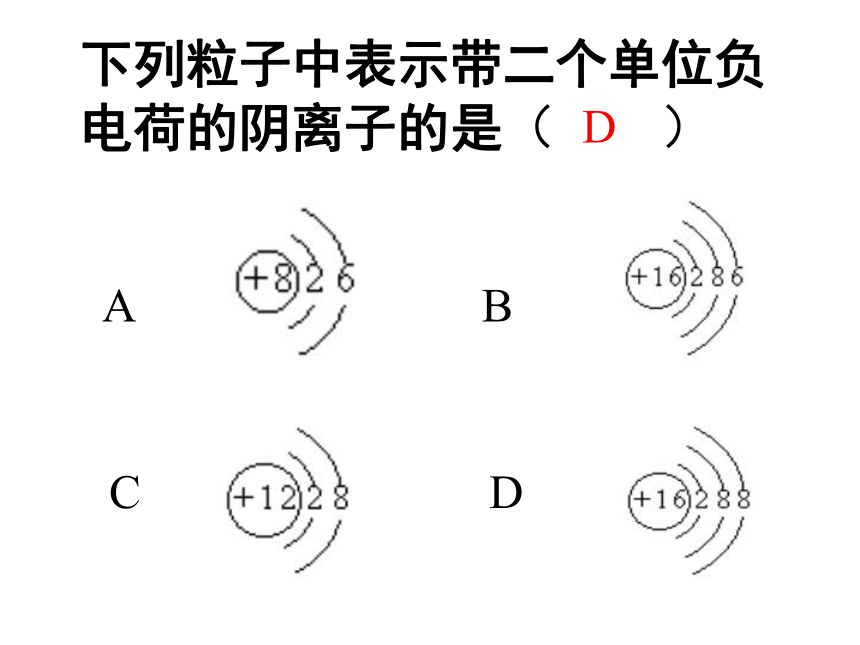
下列粒子中表示带二个单位负电荷的阴离子的是( )
A
B
C
D
D
+12
2
8
2
+13
2
8
3
复习与练习
1、分别画出钠、镁、铝、氧、氟、氯六种原子的结构示意图。
钠原子 Na
+9
2
7
+17
2
8
7
镁原子 Mg
铝原子 Al
氧原子 O
氟原子 F
氯原子 Cl
2、根据上题中各原子结构的特点,指出它们在化学反应中是容易失去电子还是容易获得电子,分别说明理由 。
+11
2
8
1
+8
2
6
金属与非金属互相起化学反应时,化合物是如何形成的?
1.化学反应的实质是原子的重新组合,在组合过程中,元素的原子总是力求使自身的结构趋于或达到稳定结构。
2.稳定结构是指类似于稀有气体元素原
子的最外层电子数达到最多(2个或8个)
的结构。
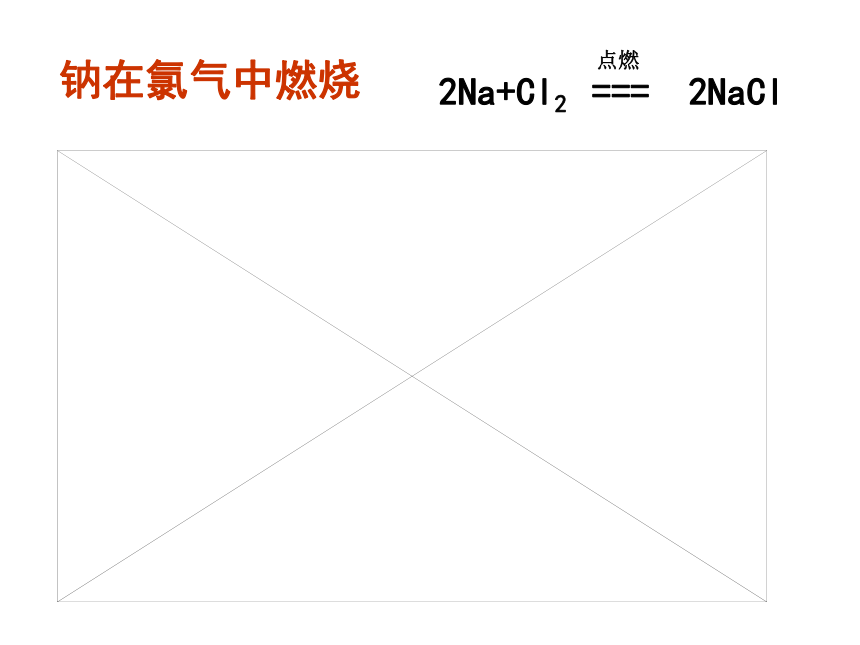
钠在氯气中燃烧
2Na+Cl2 === 2NaCl
点燃
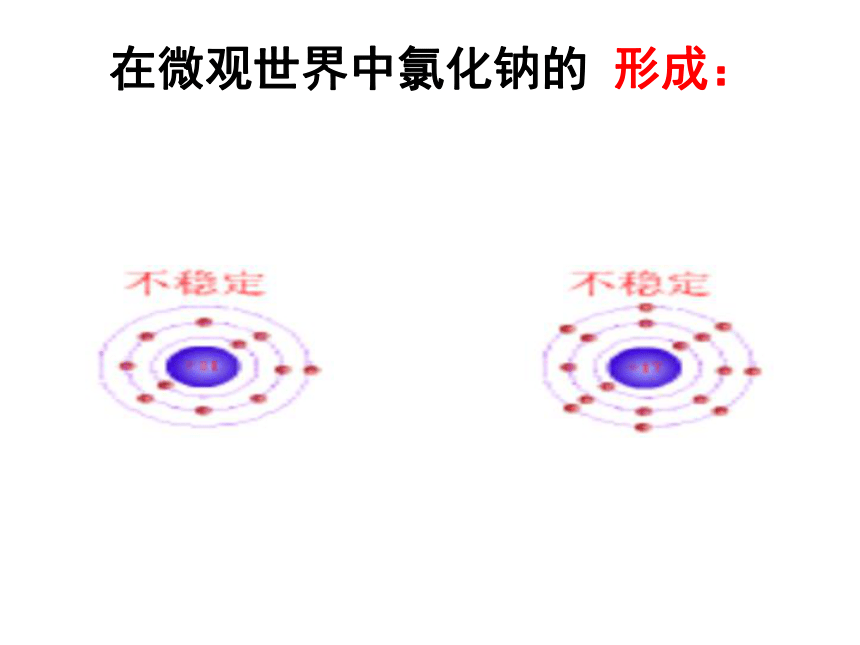
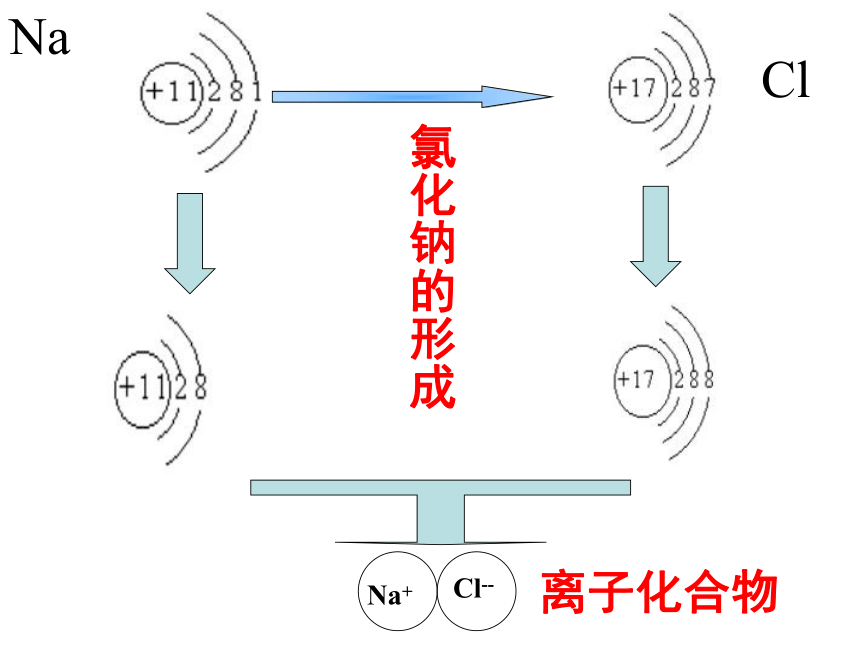
在微观世界中氯化钠的 形成:
Na
Cl
Na+
Cl--
氯化钠的形成
离子化合物
当钠原子与氯原子相遇时,钠原子把最外层的1个电子转移给氯原子,使两者分别变成最外电子层达到稳定结构的钠离子Na+和氯离子Cl-。而钠离子带1个单位正电荷,氯离子带1 个单位负电荷,它们既相互吸引,又相互排斥,当引力和斥力达到平衡时就形成了不再带有电性的化合物氯化钠了。
分析
离子化合物:
3、构成离子化合物的微粒:
(如:金属氧化物、碱、盐)
2、特点:一般 由金属元素、非金属元素组成的化合物是离子化合物。
1概念:阴阳离子相互作用构成的化合物。
如:氯化钠 Na + 和 Cl-
硫酸锌 Zn2+ 和 SO42-
如 MgCl2,ZnSO4,NaOH,Na2S
离子
非金属与非金属互相起化学反应时,化合物是如何形成的?
以氢气在氯气中燃烧为例:
H2 + Cl2====2HCl
点燃
在微观世界中氯化氢的 形成:
共用电子对
各提供最外层一个电子,组成电子对作为它们的共用电子,并在两个原子的核外空间运动,使两者都达到稳定结构
氢气在氯气中燃烧的化学反应方程式为:
氯化氢的形成过程:
当氢原子与氯原子相遇时,由于两者都是非金属元素的原子,不可能通过一种原子失去电子,另一种原子得到电子来化合,而是各提供最外层一个电子,组成电子对作为它们的共用电子,并在两个原子的核外空间运动,使两者都达到稳定结构。这对共用电子对受两个原子核的吸引,使两个原子形成化合物的分子。
H2 + Cl2====2HCl
点燃
苍白色火焰,瓶口有白雾出现,白雾的主要成分是什么?
在氯化氢分子中,共用电子对偏向氯原子而偏离氢原子,使氯原子略显负电性,氢原子略显正电性,但整个氯化氢分子呈电中性。
H
Cl
.
×
δ+
δ-
整个分子不显电性
1、概念:以共用电子对形成分子的化合物。
2、特点:共价化合物中的组成元素一般是非金属元素
3、构成共价化合物的微粒:
共价化合物:
如 : H2O , CO2, NH3 , CH4, H2 SO4
(如: 非金属氧化物 、 酸 )
分子
如:水是由水分子构成
化合物 离子化合物 共价化合物
定义
组成元素
形成方式
组成微粒
实例
结论
由阴阳离子相互作用而构成的化合物
以共用电子形成分子的化合物
活泼金属与活泼非金属
非金属元素之间
(硝酸铵等除外)
通过得失电子成为阴、阳离子
通过共用电子对形成化合物
离子
分子
NaCl
HCl
原子、分子或离子都可以直接构成物质
离子化合物与共价化合物中化合价的确定
离子化合物 共价化合物
化合价
的数值 1个原子得失电子的数目。
如:氯化镁中,1个镁原子失去2个电子,故镁显2价。 1个原子与其他元素的原子形成共用电子对的数目。如:水分子中,1个氧原子与氢原子形成两对共用电子对,故氧显2价。
化合价 的正负 失去电子的原子显正价;
获得电子的原子显负价。 电子对偏离的原子显正价;
电子对偏向的原子显负价。
看看谁正确!
物质
化学式 构成的微粒
氯化钠
硫酸
二氧化碳
氧气
金刚石
NaCl
离子
H2SO4
分子
CO2
分子
分子
O2
C
原子
化学式是用 来表示 的式子。
元素符号
物质组成
稀有气体、金属单质、
多数固态非金属单质
①原子直接构成
直接用元素符号
如:氩气____ 镁____
Ar
Mg
②由分子构成
双原子分子构成的单质:
如:氢气__ 氧气___
H2
O2
氮气__ 氯气___
N2
Cl2
共价化合物:
如:水____ 硝酸_____
H2O
HNO3
化学式的写法:
用分子式来表示
③由离子构成
离子化合物
可根据化合价来写
+9
2
8
1、分子式是 的式子。 如硫酸的分子式是 ,氧化铁的分子式是 。
2、写出下列符号中各数字表示的意义:
①3Cl2中的“3”表示 ,“2”表示 ;
②4NH3中的“4”表示 ,“3”表示 ;
③5Mg2+中的“5”表示 ,“2+”表示 ;
④(SO3)中的“3”表示 ,“-2”表示 ; ⑤ 中的“9”表示 ,
“2”表示 ,
“8”表示 。
-2
表示物质分子组成
H2SO4
Fe2O3
3个氯分子
1个氯分子由2个氯原子构成
4个氨分子
1个氨分子中有3个氢原子
5个镁离子
镁离子带2个单位正电荷
1个亚硫酸根中有3个氧原子
亚硫酸根显-2价
氟离子原子核内有9个质子
氟离子第一电子层上有2个电子
氟离子第二电子层(最外层)上有8个电子
判断正误:
1、不论是在离子化合物还是在共价化合物中,元素的 正负化合价的代数和等于零。 ( )
对
2、元素的化学性质主要取决于原子结构中的电子层数。 ( )
错
3、离子化合物中,元素的化合价数值,就是这种元素的所有原子得失电子的数目。 ( )
错
1、某离子带2个单位的正电荷,核外有10个电子,且其相对原子质量的为24,则该元素的原子核内中子数是 ( )
A 、12 B 、14 C 、16 D、24
A
2、根据下列粒子的结构示意图,在括号中写出所表示的粒子符号
S
F-
Mg2+
Al3+
Li+
3.下列各组化合物中,前者是离子化合物,后者是共价化合物的一组是
A.NaCl,CaCl2 B.HCl,KCl
C.CO2,H2O D.ZnSO4,NH3
4.下列各组数字代表了元素的核电荷数,其中能组成AB2型离子化合物的一组是
A.11和7 B.12和17
C.8和12 D.11和16
5.M元素的离子为M2+,其核外电子数为a,核内中子数为b,则M的相对原子质量为
A.a+b+2 B.a+b-2 C.a+b D.b+2
6.下列微粒中,与Na+的质子数和电子数都相同的是
A.F- B.H2O C.NH4+ D.OH-
7、有A、B、C、D、E五种微粒:
①A微粒核内有14个中子,核外M电子层上有2个电子;
②B微粒得到2个电子后,其电子层结构与Ne相同;
③C微粒带有一个单位的正电荷,核电荷数为11;
④D微粒核外有18个电子,当失去1个电子时呈电中性;
⑤E微粒不带电,其相对原子质量为1。
试回答下列问题:
(1)依次写出A、B、C、D、E各微粒的符号 、 、 、 、 ;
(2)B、C、E所属元素两两组合时,可形成哪些离子化合物和共价化合物,写出它们的化学式:
(3)B、C、D所属三种元素共同组合时所形成的物质有多种,请写出它们的化学式:
物质分类及其变化规律
原子
(如钠原子、氯原子) 离子
阳离子 阴离子
结构图
结构特点
电性
表示方法
相互转化关系
质子数
(等于)
核外电子数
质子数
(大于)
核外电子数
质子数
(小于)
核外电子数
不带电
带正电
带负电
Na Cl
Na+
Cl–
原子
阳离子
阴离子
失电子
得电子
得电子
失电子
下列粒子中表示带二个单位负电荷的阴离子的是( )
A
B
C
D
D
+12
2
8
2
+13
2
8
3
复习与练习
1、分别画出钠、镁、铝、氧、氟、氯六种原子的结构示意图。
钠原子 Na
+9
2
7
+17
2
8
7
镁原子 Mg
铝原子 Al
氧原子 O
氟原子 F
氯原子 Cl
2、根据上题中各原子结构的特点,指出它们在化学反应中是容易失去电子还是容易获得电子,分别说明理由 。
+11
2
8
1
+8
2
6
金属与非金属互相起化学反应时,化合物是如何形成的?
1.化学反应的实质是原子的重新组合,在组合过程中,元素的原子总是力求使自身的结构趋于或达到稳定结构。
2.稳定结构是指类似于稀有气体元素原
子的最外层电子数达到最多(2个或8个)
的结构。
钠在氯气中燃烧
2Na+Cl2 === 2NaCl
点燃
在微观世界中氯化钠的 形成:
Na
Cl
Na+
Cl--
氯化钠的形成
离子化合物
当钠原子与氯原子相遇时,钠原子把最外层的1个电子转移给氯原子,使两者分别变成最外电子层达到稳定结构的钠离子Na+和氯离子Cl-。而钠离子带1个单位正电荷,氯离子带1 个单位负电荷,它们既相互吸引,又相互排斥,当引力和斥力达到平衡时就形成了不再带有电性的化合物氯化钠了。
分析
离子化合物:
3、构成离子化合物的微粒:
(如:金属氧化物、碱、盐)
2、特点:一般 由金属元素、非金属元素组成的化合物是离子化合物。
1概念:阴阳离子相互作用构成的化合物。
如:氯化钠 Na + 和 Cl-
硫酸锌 Zn2+ 和 SO42-
如 MgCl2,ZnSO4,NaOH,Na2S
离子
非金属与非金属互相起化学反应时,化合物是如何形成的?
以氢气在氯气中燃烧为例:
H2 + Cl2====2HCl
点燃
在微观世界中氯化氢的 形成:
共用电子对
各提供最外层一个电子,组成电子对作为它们的共用电子,并在两个原子的核外空间运动,使两者都达到稳定结构
氢气在氯气中燃烧的化学反应方程式为:
氯化氢的形成过程:
当氢原子与氯原子相遇时,由于两者都是非金属元素的原子,不可能通过一种原子失去电子,另一种原子得到电子来化合,而是各提供最外层一个电子,组成电子对作为它们的共用电子,并在两个原子的核外空间运动,使两者都达到稳定结构。这对共用电子对受两个原子核的吸引,使两个原子形成化合物的分子。
H2 + Cl2====2HCl
点燃
苍白色火焰,瓶口有白雾出现,白雾的主要成分是什么?
在氯化氢分子中,共用电子对偏向氯原子而偏离氢原子,使氯原子略显负电性,氢原子略显正电性,但整个氯化氢分子呈电中性。
H
Cl
.
×
δ+
δ-
整个分子不显电性
1、概念:以共用电子对形成分子的化合物。
2、特点:共价化合物中的组成元素一般是非金属元素
3、构成共价化合物的微粒:
共价化合物:
如 : H2O , CO2, NH3 , CH4, H2 SO4
(如: 非金属氧化物 、 酸 )
分子
如:水是由水分子构成
化合物 离子化合物 共价化合物
定义
组成元素
形成方式
组成微粒
实例
结论
由阴阳离子相互作用而构成的化合物
以共用电子形成分子的化合物
活泼金属与活泼非金属
非金属元素之间
(硝酸铵等除外)
通过得失电子成为阴、阳离子
通过共用电子对形成化合物
离子
分子
NaCl
HCl
原子、分子或离子都可以直接构成物质
离子化合物与共价化合物中化合价的确定
离子化合物 共价化合物
化合价
的数值 1个原子得失电子的数目。
如:氯化镁中,1个镁原子失去2个电子,故镁显2价。 1个原子与其他元素的原子形成共用电子对的数目。如:水分子中,1个氧原子与氢原子形成两对共用电子对,故氧显2价。
化合价 的正负 失去电子的原子显正价;
获得电子的原子显负价。 电子对偏离的原子显正价;
电子对偏向的原子显负价。
看看谁正确!
物质
化学式 构成的微粒
氯化钠
硫酸
二氧化碳
氧气
金刚石
NaCl
离子
H2SO4
分子
CO2
分子
分子
O2
C
原子
化学式是用 来表示 的式子。
元素符号
物质组成
稀有气体、金属单质、
多数固态非金属单质
①原子直接构成
直接用元素符号
如:氩气____ 镁____
Ar
Mg
②由分子构成
双原子分子构成的单质:
如:氢气__ 氧气___
H2
O2
氮气__ 氯气___
N2
Cl2
共价化合物:
如:水____ 硝酸_____
H2O
HNO3
化学式的写法:
用分子式来表示
③由离子构成
离子化合物
可根据化合价来写
+9
2
8
1、分子式是 的式子。 如硫酸的分子式是 ,氧化铁的分子式是 。
2、写出下列符号中各数字表示的意义:
①3Cl2中的“3”表示 ,“2”表示 ;
②4NH3中的“4”表示 ,“3”表示 ;
③5Mg2+中的“5”表示 ,“2+”表示 ;
④(SO3)中的“3”表示 ,“-2”表示 ; ⑤ 中的“9”表示 ,
“2”表示 ,
“8”表示 。
-2
表示物质分子组成
H2SO4
Fe2O3
3个氯分子
1个氯分子由2个氯原子构成
4个氨分子
1个氨分子中有3个氢原子
5个镁离子
镁离子带2个单位正电荷
1个亚硫酸根中有3个氧原子
亚硫酸根显-2价
氟离子原子核内有9个质子
氟离子第一电子层上有2个电子
氟离子第二电子层(最外层)上有8个电子
判断正误:
1、不论是在离子化合物还是在共价化合物中,元素的 正负化合价的代数和等于零。 ( )
对
2、元素的化学性质主要取决于原子结构中的电子层数。 ( )
错
3、离子化合物中,元素的化合价数值,就是这种元素的所有原子得失电子的数目。 ( )
错
1、某离子带2个单位的正电荷,核外有10个电子,且其相对原子质量的为24,则该元素的原子核内中子数是 ( )
A 、12 B 、14 C 、16 D、24
A
2、根据下列粒子的结构示意图,在括号中写出所表示的粒子符号
S
F-
Mg2+
Al3+
Li+
3.下列各组化合物中,前者是离子化合物,后者是共价化合物的一组是
A.NaCl,CaCl2 B.HCl,KCl
C.CO2,H2O D.ZnSO4,NH3
4.下列各组数字代表了元素的核电荷数,其中能组成AB2型离子化合物的一组是
A.11和7 B.12和17
C.8和12 D.11和16
5.M元素的离子为M2+,其核外电子数为a,核内中子数为b,则M的相对原子质量为
A.a+b+2 B.a+b-2 C.a+b D.b+2
6.下列微粒中,与Na+的质子数和电子数都相同的是
A.F- B.H2O C.NH4+ D.OH-
7、有A、B、C、D、E五种微粒:
①A微粒核内有14个中子,核外M电子层上有2个电子;
②B微粒得到2个电子后,其电子层结构与Ne相同;
③C微粒带有一个单位的正电荷,核电荷数为11;
④D微粒核外有18个电子,当失去1个电子时呈电中性;
⑤E微粒不带电,其相对原子质量为1。
试回答下列问题:
(1)依次写出A、B、C、D、E各微粒的符号 、 、 、 、 ;
(2)B、C、E所属元素两两组合时,可形成哪些离子化合物和共价化合物,写出它们的化学式:
(3)B、C、D所属三种元素共同组合时所形成的物质有多种,请写出它们的化学式:
