第五册第二章复习[上学期]
图片预览











文档简介
课件50张PPT。第2章 物质转化与材料利用
复习课一、本章特点 1 . 知识结构严谨、逻辑性强。
两块(物质的转化、材料的利用)
两线(金属及其化合物的转化、非金属及其化合物的转化)
一重心(物质转化规律的发现和运用)物质
转化材料
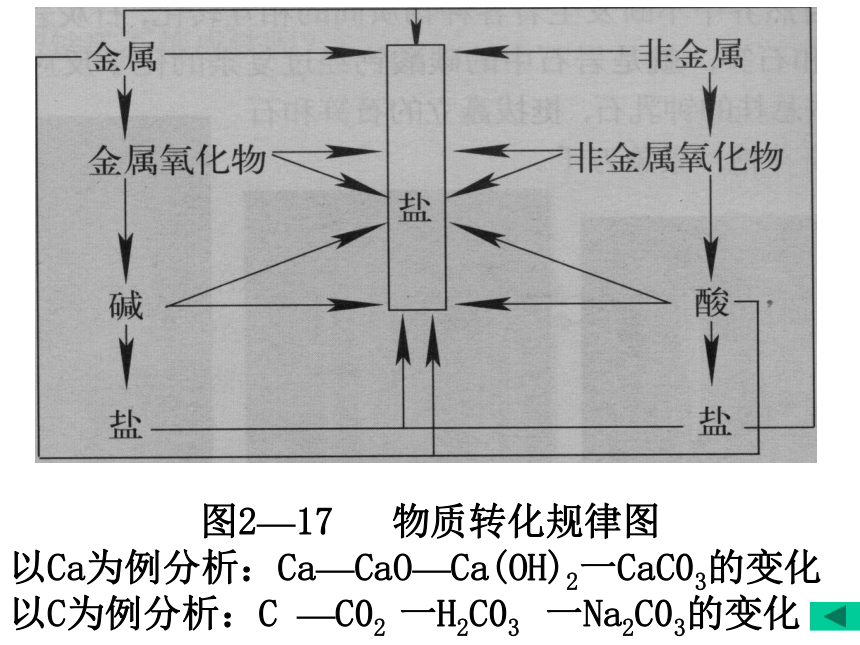
利用图2—17 物质转化规律图
以Ca为例分析:Ca—CaO—Ca(OH)2一CaC03的变化
以C为例分析:C —C02 一H2C03 一Na2C03的变化 2 .重视学法指导——复习、巩固、归纳提高。
分类 生物分类方法——物质分类方法;
(感性的)性质分类方法——(理性的)构成分类方法
归纳(已有知识、观察结果—物质转化规律—规律的应用)
理论联系实际(规律的发现、应用、对材料发展和利用的指导作用)一、本章特点1)根据金属的性质确定其用途。
如:银是最佳的导热体,为什么银不宜用来制造食器皿?
为什么食品罐头一般用镀锡的铁制造,而不用锡制造?
2)物质鉴别(厨房中的物质鉴别)
3)生活中的垃圾分类回收。
如:铝罐、废铁的回收和废电池的处理与日常生活及工农业生产联系紧密
(科学、技术与社会)4)各种材料的特点及应用:
如:
A水泥的运输或贮存问题---遇水为什么会很快结块变硬?
B各年代都有保存完好的精美瓷器出土,这说明陶瓷具有什么特性?
C厨房里的物品,它们是由什么材料制成的?
D牙齿的矫形---记忆合金有何特性?
E纳米材料、超导材料、先进复合材料有何特性?有何应用?。涉及实验较多,现象及操作中蕴藏着复杂的科学原理。演示实验
1)硫的燃烧;
2)CO2通入石蕊试液;
3)铁粉与硫黄的加热;
4)生石灰与水的反应;
5)碳、氢气还原氧化铜;
6)一氧化碳还原氧化铁.
7)生鸡蛋与盐酸的反应;
8)铝、锡、铅的硬度及导电性、熔点的比较等学生实验
氯化钡等物质的鉴别可用于探究的材料非常丰富。(1)1.1:每只烧杯中装了什么物质?
(设计方案;收集证据,得出结论)
(2)3.1:铁锈蚀的条件
(设计方案,收集证据,得出结论)
(3)3.2:废干电池的综合利用.
查阅讨论成分及用途;设计提取成分的方案.
调查了解我国金属的回收状况,并提出建议.
(4)4.1:怎样以铜为主要原料制备硫酸铜
(方法、原理、及从“绿色工艺”角度进行方案的评估)可以用于自主、合作学习的内容较多:(除实验探究外)1)1.3:查阅钛、铝、金、汞、银、铜、铁、锡、溴、碳、硫、硅、磷等物质的性质及用途。
2)2.1:查阅赤铁矿、方铅矿、和孔雀石的主要成份及用途。
3)3.1:查阅资料,回答不锈钢是由什么成分组成的合金。
4)3.2:查阅资料,讨论干电池内含有哪些主要物质及各种物质的主要用途
5)3.3课后作业:试收集有关“弃置金属所带来的环境问题”的资料,---
6)查阅有关人类使用金属的历史资料,了解在不同时代金属的使用的状况。
7)4.1查阅并收集有关“材料技术发展对社会进步的贡献”的资料,并在班里进行交流。二、本章相关的几个观点
1、组成决定性质。
(例:有机物的性质)
(利用性质可以推测组成)
2、性质决定用途。
(例:合金、塑料的性质与用途)
3、理论对实践有重要的指导作用。
(例:利用铜制取硫酸铜的探究)三、本章重点、难点重点:
物质的分类方法
物质转化的规律
材料的发展和利用对人类文明的促进作用难点:
系统掌握物质的分类方法
寻找物质转化的规律
运用物质转化的规律指导材料的发展和利用
培养科学思维能力难点突破:
从学生已有知识出发学习物质的分类方法
运用大量实验和观察来寻找物质转化的规律
把握课标的要求,不任意加深教学要求回忆原有
知识技能:对原有知识
技能的再认识:学习新知识、
新方法:运用新知识、
方法形成新技能:对分类的认识对分类方法的比较了解按物质的组成进行分类的方法、及相关概念。用实验法获取物质的性质并进行物质鉴别(探究)第1节:物质的分类和利用问题:
1、生活中为什么要对物品进行分类?如何分类?
2、科学家如何对动物或植物进行分类?有何目的?
如:脊柱的有无、器官的特征--;
种子的有无、胚的特征 ---)
如:更准确,更好地了解其生理特点。
---结构决定功能 )一、对分类的认识 二、对分类方法的比较 交流结果:练习: 对氯化钠、硫酸、氧气、醋酸、氯气、氧化镁、高锰酸钾等七种物质进行分类。
要求一:分别按颜色、状态进行分类;
要求二:其它方法进行分类。思考与讨论:
1、科学家为什么要对物质进行分类?如何分类?
运用实验的方法了解性质与组成,根据物质的组成进行分类。
2、按物质的组成对物质进行分类的优点有哪些?
如:更好地了解性质,更好地知道用途并用它为人类服务。
(不同的组成会有不同的性质,而性质又决定用途)科学分类的结果:
纯净物的分类(以组成为主要依据)纯净物单质化合物无机化合物有机化合物思考:
有机化合物有哪些相似的组成和性质?相似组成: 含碳元素.
相似性质:
大多能在空气中燃烧生成二氧化碳 (和水)
不完全燃烧时会有黑色的碳产生.
大多难溶于水
注:本问题的目的:①了解有机物的一般特点
②初步感知组成与性质关系归纳:
根据已知物质和未知物质的特性,
如状态、颜色、溶解性,可燃性
等,运用实验的方法,通过对比
可对物质进行鉴别和分类。
回忆原有
知识技能:完善原有
知识技能:运用知识
技能巩固知识
技能按组成对物质分类完善物质分类的结果对给出的多种
物质进行分类复习巩固酸
碱盐和氧化物
的组成与性质 三、常见的物质纯
净
物单
质化
合
物无机
化合物有机
化合物氧化物酸物质分类:混合
物物质碱盐金属非金属金属
氧化物非金属
氧化物四、物质分类的运用:根据上述物质分类图,对
镁、硫、氧气、氧化镁、二氧化锰、盐酸、氢氧化钙、氯化钠、高锰酸钾
等进行分类。五、巩固物质分类:
(复习)1、酸的组成和共性:
2、碱的组成和共性:
3、盐的组成和性质:
4、氧化物(二氧化碳和氧化铜)
的组成和性质:六、区别金属和非金属1、几种金属的主要性质铜:呈紫红色光泽的金属,密度8.92克/厘米3。熔点1083.4±0.2℃,沸点2567℃。稍硬、极坚韧、耐磨损。还有很好的延展性。导热和导电性能较好。铜的最大用途是在电器工业上。广泛用于制作电线、电缆和各种电器设备。 银:银白色金属。密度:10.5克/厘米3。熔点:961.93℃,沸点2213℃。化合价+1。富延展性,是导热、导电性能很好的金属。用于制合金、焊药、银箔、银盐、化学仪器等,并用于制银币和底银等方面。铁:是一种光亮的银白色金属。密度7.86克/厘米3。熔点1535℃,沸点2750℃。常见化合价+2和+3,有好的延展性和导热性。也能导电。纯铁既能磁化,又可去磁,且均很迅速 。它的最大用途是用于炼钢;也大量用来制造铸铁和煅铁。 铝:银白色有光泽金属,密度2.702克/厘米3,熔点660.37℃,沸点2467℃。化合价±3。具有良好的导热性、导电性,和延展性。其合金质轻而坚韧,是制造飞机、火箭、汽车的结构材料。纯铝大量用于电缆。 2、几种常见非金属的性质硫:为淡黄色晶体。密度2.07克/厘米3,熔点112.8℃,沸点444.674℃;单质硫,密度1.96克/厘米3,熔点120.0℃,沸点444.6℃。导热性和导电性都差。性松脆,不溶于水。大部分用于制造硫酸。橡胶制品工业、火柴、烟火、硫酸盐、亚硫酸盐、硫化物等产品中也需要很多硫磺。部分用于制造药物、杀虫剂以及漂染剂等 磷:白磷或黄磷是无色或淡黄色的透明结晶固体。密度1.82克/厘米3。熔点44.1℃,沸点280℃,着火点是40℃。放于暗处有磷光发出。有恶臭。剧毒。几乎不溶于水。红磷是红棕色粉末,无毒,密度2.34克/厘米3,熔点59℃,沸点200℃。讨论解决的问题:
1、为什么可乐、啤酒等常采用铝罐而不是铁或铜罐?
2、银是优良的导电体,为什么导线内芯不用银而用铜?
3、银是最佳的导热体,为什么常用煮食器皿一般采用铁或铝而不宜用来银制造?
4、为什么装食品的罐头一般用镀锡的铁来制造?而不全用铁或锡?
5、根据石墨、金、钛的性质特点,你认为它们各有哪些用途?第2节 物质转化的规律本节特点: 既是重点又是难点.
对复习中几个实验的建议:
1、硫的燃烧实验中,硫的量要少些;向燃烧后的集气瓶中倒入氢氧化钠溶液。
(1)可以消除污染。
(2)加深对氢氧化钠和二氧化硫的性质的认识。2、硫黄与铁粉的混合加热实验:
(1)硫与铁的质量比可为5:7。防止剩余的铁对实验结果的干扰。
(2)铁与硫的混合要均匀。
(3)实验可在石棉网上进行,燃烧后用镊子处理即可。复习建议
通过实验方法,寻找物质间的转化规律。以典型反应研究单质和化合物之间的转化,重点把握两条变化的线索。
金属冶炼是转化规律应用
的实例。
(还原剂:C、H2、CO)
3、实验方法学习:易燃物质的点燃、有毒气体的处理、产物CO2的鉴定。4、纯度计算:数学方法的应用,解题的思路、规范。
5、读图,理解物质间相互转化的规律,掌握常见的反应(把握到已出现过的反应即可)。
6、物质制备的教学要求(原料分析、规律应用、实现途径、环境保护)。第3节 常见的材料常
见
的
材
料金属材料
(合金)无机非金属
材料(水泥、玻璃、陶瓷)有机合成材料
(合成塑料等)合金的概念合金性质的实验研究钢铁锈蚀条件研究及防锈措施金属污染及对策
(废电池的综合利用)性质与用途
危害与对策需要解决的问题:
1、材料的种类有哪些?材料与元素有什么关系?(几十万与一百多;元素组成材料)
2、合金的性质有哪些特点?如何用实验加以研究?(电阻率、硬度、熔点)
3、合金有哪些用途?与什么性质有关?
(不锈钢、铅锡合金为例;性质决定用途)
4、金属锈蚀的条件有哪些?如何用实验验证?(外/内 条件)
5、如何防锈?(外 / 内 措施)关于“金属锈蚀的条件有哪些?” 学习:
1、交流常见的金属(合金)的用途
(课前已收集好)
2、归纳:金属(合金)由于在导电、导热、硬度、延展性等方面具有良好的性质而得到了广泛的应用。
问题: 你能说出金属有哪些缺点吗?
3、选择学生表达结果。转入:
问题:易锈蚀是许多金属的共同弊端。
许多金属为什么易锈蚀,产生锈蚀的条件有哪些呢?(学生结合经验猜测)4、引导分析各种猜测的可能性。
(锈蚀的条件有:空气、水、---)
5、展示提供的器材:带塞子的试管若干支,普通铁片若干,纯铁片,蒸馏水,干燥剂。
要求:根据所提供的器材,设计实验方案,以验证锈蚀的条件,并画出装置图。
(小组合作完成,交流完善)
6、针对方案,展示实验结果。(多种准备)A:普通铁片,水、空气
B:普通铁片,空气。(内有干燥剂)
C:普通铁片,蒸馏水。(无空气)
D:纯铁片,水、空气。分析:哪一个是对照组?如何比较以得出结论?7、观察、比较、分析,得出结论:
铁锈蚀的外部条件:( B与A ,C 与A )
同时具备空气和水。
铁锈蚀的内部条件:( D与A )
与内部结构有关。需解决的问题:
1、废弃金属对环境的有哪些危害?
2、我国如何解决废弃金属问题?
3、以废干电池为例,根据所含物质的性质,设计方案以综合回收利用。1.查阅有关资料讨论干电池内含有哪些主要物质及各种物质的主要用途.
(合理认识废旧干电池中潜在的危害)
2.设计实验方案,指出如何提取这些物质.
3.调查我国金属的回收状况,提出合理建议废干电池的综合利用注: 给探究预留充足的时间, 在课前应有充分的准备,课内应有必要的拓展.废干电池所含物质1号废旧锌锰电池的组成(约70克):
锌皮(7克) 碳棒(5.2克)
锰粉(25克) 铜帽(0.5克)
汞(微量) 其他:约32克.
其它电池:铅、镉、镍等。
方案例举:
1、对锌的回收:
剥下干电池外面的锌皮,并用小刀或纱纸去掉表面的杂质,洗净干燥。 (可用作实验室制氢气的原料)
2、对汞的回收:(Hg2+)
向初步处理后的废液中,加入铜屑、铁屑或锌粒,置换出汞。
3、对镉、镍的回收:(Cd2+、Ni2+)
提示:Cd(OH)2、Ni(OH)2难溶于水。
向含Cd2+的废液中,加入可溶性碱,生成沉淀。过滤,洗涤,干燥。发达国家的政策:
美国、日本、欧盟未把群众日常生活使用的普通干电池作为危险废物对待,也没有强制单独收集处理普通干电池的法律。
在电池管理政策上,主要分两类:
第一类是针对普通干电池的。政府要求制造商逐步降低电池中的汞含量,最终禁止向电池中添加汞。对企业回收,国家既不鼓励也不限制。
第二类政策是针对可充电电池的。立法淘汰镍镉电池, 用镍氢、锂电池取代。并通过以旧换新方式回收.我国政策:
借鉴发达国家相关政策,2006达到无汞水平。谨慎收集废电池:
1.分散的废电池随生活垃圾填埋一般不会造成太大污染。
2.把大量的废电池集中到一个地方,加上处理不善(如剥开外壳,回收有价值部分,将残渣随意抛弃),则有可能引起局部地区的汞污染。
3.对已收集的废干电池,应交专业部门处理。 (1)水泥在运输或贮存过程中要注意什么?为什么水泥遇水很快结块变硬?
(2)取一包水泥,修补一下你家、学校、社区破损地面或墙体,想一想怎样修补才能牢固?
(3)在工农业生产及日常生活中,哪些物品是用玻璃制成的?知道它们的特点吗?
(4)我国各个年代都有保存完好的精美瓷器出土,据此你能说出陶瓷具有什么特性?
(5)比较下图中所列的塑料制品,它们各有什么特点?
(6)厨房里的物品,它们是由什么材料制成的.第4节 材料的发展2)材料制造与环境保护(+探究活动)
为了减少材料制造对环境污染的影响,有两种主要途径:
A、减少“三废”的排放(阅读材料)
B、改进材料制造的方法(绿色新工艺—探究活动)1)材料发展与人类文明的关系
明白材料的发展过程:探究:怎样以铜为主要原料制备硫酸铜?1、设计制备的方法: (物质转化规律的运用)
(1)已知硫酸铜与浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫和水。
(2)铜加热变为氧化铜,氧化铜再与稀硫酸反应,生成硫酸铜。
(3)铜和氯气反应得得氯化铜,氯化铜和氢氧化钠的反应制得氢氧化铜,氢氧化铜和硫酸反应制得硫酸铜。
(4)其它方法
2、写出实验原理(化学方程式):略
要求思考和讨论:以上方法在原料的利用率及产生的污染方面进行讨论,指出绿色工艺的可行性。根据讨论情况,引导提示:1.Cu CuSO4 + SO2 + H2OH2SO4(浓)2.Cu CuO CuSO4O2H2SO4利用率高,污染程度低(Cl2有毒) 污染严重 (成本高)注: 1.从利用率和对环境污染程度加以考虑
2.其他: 过程的复杂程度,安全性,及对 设备的要求程度
3.成本问题利用率低,污染严重
复习课一、本章特点 1 . 知识结构严谨、逻辑性强。
两块(物质的转化、材料的利用)
两线(金属及其化合物的转化、非金属及其化合物的转化)
一重心(物质转化规律的发现和运用)物质
转化材料
利用图2—17 物质转化规律图
以Ca为例分析:Ca—CaO—Ca(OH)2一CaC03的变化
以C为例分析:C —C02 一H2C03 一Na2C03的变化 2 .重视学法指导——复习、巩固、归纳提高。
分类 生物分类方法——物质分类方法;
(感性的)性质分类方法——(理性的)构成分类方法
归纳(已有知识、观察结果—物质转化规律—规律的应用)
理论联系实际(规律的发现、应用、对材料发展和利用的指导作用)一、本章特点1)根据金属的性质确定其用途。
如:银是最佳的导热体,为什么银不宜用来制造食器皿?
为什么食品罐头一般用镀锡的铁制造,而不用锡制造?
2)物质鉴别(厨房中的物质鉴别)
3)生活中的垃圾分类回收。
如:铝罐、废铁的回收和废电池的处理与日常生活及工农业生产联系紧密
(科学、技术与社会)4)各种材料的特点及应用:
如:
A水泥的运输或贮存问题---遇水为什么会很快结块变硬?
B各年代都有保存完好的精美瓷器出土,这说明陶瓷具有什么特性?
C厨房里的物品,它们是由什么材料制成的?
D牙齿的矫形---记忆合金有何特性?
E纳米材料、超导材料、先进复合材料有何特性?有何应用?。涉及实验较多,现象及操作中蕴藏着复杂的科学原理。演示实验
1)硫的燃烧;
2)CO2通入石蕊试液;
3)铁粉与硫黄的加热;
4)生石灰与水的反应;
5)碳、氢气还原氧化铜;
6)一氧化碳还原氧化铁.
7)生鸡蛋与盐酸的反应;
8)铝、锡、铅的硬度及导电性、熔点的比较等学生实验
氯化钡等物质的鉴别可用于探究的材料非常丰富。(1)1.1:每只烧杯中装了什么物质?
(设计方案;收集证据,得出结论)
(2)3.1:铁锈蚀的条件
(设计方案,收集证据,得出结论)
(3)3.2:废干电池的综合利用.
查阅讨论成分及用途;设计提取成分的方案.
调查了解我国金属的回收状况,并提出建议.
(4)4.1:怎样以铜为主要原料制备硫酸铜
(方法、原理、及从“绿色工艺”角度进行方案的评估)可以用于自主、合作学习的内容较多:(除实验探究外)1)1.3:查阅钛、铝、金、汞、银、铜、铁、锡、溴、碳、硫、硅、磷等物质的性质及用途。
2)2.1:查阅赤铁矿、方铅矿、和孔雀石的主要成份及用途。
3)3.1:查阅资料,回答不锈钢是由什么成分组成的合金。
4)3.2:查阅资料,讨论干电池内含有哪些主要物质及各种物质的主要用途
5)3.3课后作业:试收集有关“弃置金属所带来的环境问题”的资料,---
6)查阅有关人类使用金属的历史资料,了解在不同时代金属的使用的状况。
7)4.1查阅并收集有关“材料技术发展对社会进步的贡献”的资料,并在班里进行交流。二、本章相关的几个观点
1、组成决定性质。
(例:有机物的性质)
(利用性质可以推测组成)
2、性质决定用途。
(例:合金、塑料的性质与用途)
3、理论对实践有重要的指导作用。
(例:利用铜制取硫酸铜的探究)三、本章重点、难点重点:
物质的分类方法
物质转化的规律
材料的发展和利用对人类文明的促进作用难点:
系统掌握物质的分类方法
寻找物质转化的规律
运用物质转化的规律指导材料的发展和利用
培养科学思维能力难点突破:
从学生已有知识出发学习物质的分类方法
运用大量实验和观察来寻找物质转化的规律
把握课标的要求,不任意加深教学要求回忆原有
知识技能:对原有知识
技能的再认识:学习新知识、
新方法:运用新知识、
方法形成新技能:对分类的认识对分类方法的比较了解按物质的组成进行分类的方法、及相关概念。用实验法获取物质的性质并进行物质鉴别(探究)第1节:物质的分类和利用问题:
1、生活中为什么要对物品进行分类?如何分类?
2、科学家如何对动物或植物进行分类?有何目的?
如:脊柱的有无、器官的特征--;
种子的有无、胚的特征 ---)
如:更准确,更好地了解其生理特点。
---结构决定功能 )一、对分类的认识 二、对分类方法的比较 交流结果:练习: 对氯化钠、硫酸、氧气、醋酸、氯气、氧化镁、高锰酸钾等七种物质进行分类。
要求一:分别按颜色、状态进行分类;
要求二:其它方法进行分类。思考与讨论:
1、科学家为什么要对物质进行分类?如何分类?
运用实验的方法了解性质与组成,根据物质的组成进行分类。
2、按物质的组成对物质进行分类的优点有哪些?
如:更好地了解性质,更好地知道用途并用它为人类服务。
(不同的组成会有不同的性质,而性质又决定用途)科学分类的结果:
纯净物的分类(以组成为主要依据)纯净物单质化合物无机化合物有机化合物思考:
有机化合物有哪些相似的组成和性质?相似组成: 含碳元素.
相似性质:
大多能在空气中燃烧生成二氧化碳 (和水)
不完全燃烧时会有黑色的碳产生.
大多难溶于水
注:本问题的目的:①了解有机物的一般特点
②初步感知组成与性质关系归纳:
根据已知物质和未知物质的特性,
如状态、颜色、溶解性,可燃性
等,运用实验的方法,通过对比
可对物质进行鉴别和分类。
回忆原有
知识技能:完善原有
知识技能:运用知识
技能巩固知识
技能按组成对物质分类完善物质分类的结果对给出的多种
物质进行分类复习巩固酸
碱盐和氧化物
的组成与性质 三、常见的物质纯
净
物单
质化
合
物无机
化合物有机
化合物氧化物酸物质分类:混合
物物质碱盐金属非金属金属
氧化物非金属
氧化物四、物质分类的运用:根据上述物质分类图,对
镁、硫、氧气、氧化镁、二氧化锰、盐酸、氢氧化钙、氯化钠、高锰酸钾
等进行分类。五、巩固物质分类:
(复习)1、酸的组成和共性:
2、碱的组成和共性:
3、盐的组成和性质:
4、氧化物(二氧化碳和氧化铜)
的组成和性质:六、区别金属和非金属1、几种金属的主要性质铜:呈紫红色光泽的金属,密度8.92克/厘米3。熔点1083.4±0.2℃,沸点2567℃。稍硬、极坚韧、耐磨损。还有很好的延展性。导热和导电性能较好。铜的最大用途是在电器工业上。广泛用于制作电线、电缆和各种电器设备。 银:银白色金属。密度:10.5克/厘米3。熔点:961.93℃,沸点2213℃。化合价+1。富延展性,是导热、导电性能很好的金属。用于制合金、焊药、银箔、银盐、化学仪器等,并用于制银币和底银等方面。铁:是一种光亮的银白色金属。密度7.86克/厘米3。熔点1535℃,沸点2750℃。常见化合价+2和+3,有好的延展性和导热性。也能导电。纯铁既能磁化,又可去磁,且均很迅速 。它的最大用途是用于炼钢;也大量用来制造铸铁和煅铁。 铝:银白色有光泽金属,密度2.702克/厘米3,熔点660.37℃,沸点2467℃。化合价±3。具有良好的导热性、导电性,和延展性。其合金质轻而坚韧,是制造飞机、火箭、汽车的结构材料。纯铝大量用于电缆。 2、几种常见非金属的性质硫:为淡黄色晶体。密度2.07克/厘米3,熔点112.8℃,沸点444.674℃;单质硫,密度1.96克/厘米3,熔点120.0℃,沸点444.6℃。导热性和导电性都差。性松脆,不溶于水。大部分用于制造硫酸。橡胶制品工业、火柴、烟火、硫酸盐、亚硫酸盐、硫化物等产品中也需要很多硫磺。部分用于制造药物、杀虫剂以及漂染剂等 磷:白磷或黄磷是无色或淡黄色的透明结晶固体。密度1.82克/厘米3。熔点44.1℃,沸点280℃,着火点是40℃。放于暗处有磷光发出。有恶臭。剧毒。几乎不溶于水。红磷是红棕色粉末,无毒,密度2.34克/厘米3,熔点59℃,沸点200℃。讨论解决的问题:
1、为什么可乐、啤酒等常采用铝罐而不是铁或铜罐?
2、银是优良的导电体,为什么导线内芯不用银而用铜?
3、银是最佳的导热体,为什么常用煮食器皿一般采用铁或铝而不宜用来银制造?
4、为什么装食品的罐头一般用镀锡的铁来制造?而不全用铁或锡?
5、根据石墨、金、钛的性质特点,你认为它们各有哪些用途?第2节 物质转化的规律本节特点: 既是重点又是难点.
对复习中几个实验的建议:
1、硫的燃烧实验中,硫的量要少些;向燃烧后的集气瓶中倒入氢氧化钠溶液。
(1)可以消除污染。
(2)加深对氢氧化钠和二氧化硫的性质的认识。2、硫黄与铁粉的混合加热实验:
(1)硫与铁的质量比可为5:7。防止剩余的铁对实验结果的干扰。
(2)铁与硫的混合要均匀。
(3)实验可在石棉网上进行,燃烧后用镊子处理即可。复习建议
通过实验方法,寻找物质间的转化规律。以典型反应研究单质和化合物之间的转化,重点把握两条变化的线索。
金属冶炼是转化规律应用
的实例。
(还原剂:C、H2、CO)
3、实验方法学习:易燃物质的点燃、有毒气体的处理、产物CO2的鉴定。4、纯度计算:数学方法的应用,解题的思路、规范。
5、读图,理解物质间相互转化的规律,掌握常见的反应(把握到已出现过的反应即可)。
6、物质制备的教学要求(原料分析、规律应用、实现途径、环境保护)。第3节 常见的材料常
见
的
材
料金属材料
(合金)无机非金属
材料(水泥、玻璃、陶瓷)有机合成材料
(合成塑料等)合金的概念合金性质的实验研究钢铁锈蚀条件研究及防锈措施金属污染及对策
(废电池的综合利用)性质与用途
危害与对策需要解决的问题:
1、材料的种类有哪些?材料与元素有什么关系?(几十万与一百多;元素组成材料)
2、合金的性质有哪些特点?如何用实验加以研究?(电阻率、硬度、熔点)
3、合金有哪些用途?与什么性质有关?
(不锈钢、铅锡合金为例;性质决定用途)
4、金属锈蚀的条件有哪些?如何用实验验证?(外/内 条件)
5、如何防锈?(外 / 内 措施)关于“金属锈蚀的条件有哪些?” 学习:
1、交流常见的金属(合金)的用途
(课前已收集好)
2、归纳:金属(合金)由于在导电、导热、硬度、延展性等方面具有良好的性质而得到了广泛的应用。
问题: 你能说出金属有哪些缺点吗?
3、选择学生表达结果。转入:
问题:易锈蚀是许多金属的共同弊端。
许多金属为什么易锈蚀,产生锈蚀的条件有哪些呢?(学生结合经验猜测)4、引导分析各种猜测的可能性。
(锈蚀的条件有:空气、水、---)
5、展示提供的器材:带塞子的试管若干支,普通铁片若干,纯铁片,蒸馏水,干燥剂。
要求:根据所提供的器材,设计实验方案,以验证锈蚀的条件,并画出装置图。
(小组合作完成,交流完善)
6、针对方案,展示实验结果。(多种准备)A:普通铁片,水、空气
B:普通铁片,空气。(内有干燥剂)
C:普通铁片,蒸馏水。(无空气)
D:纯铁片,水、空气。分析:哪一个是对照组?如何比较以得出结论?7、观察、比较、分析,得出结论:
铁锈蚀的外部条件:( B与A ,C 与A )
同时具备空气和水。
铁锈蚀的内部条件:( D与A )
与内部结构有关。需解决的问题:
1、废弃金属对环境的有哪些危害?
2、我国如何解决废弃金属问题?
3、以废干电池为例,根据所含物质的性质,设计方案以综合回收利用。1.查阅有关资料讨论干电池内含有哪些主要物质及各种物质的主要用途.
(合理认识废旧干电池中潜在的危害)
2.设计实验方案,指出如何提取这些物质.
3.调查我国金属的回收状况,提出合理建议废干电池的综合利用注: 给探究预留充足的时间, 在课前应有充分的准备,课内应有必要的拓展.废干电池所含物质1号废旧锌锰电池的组成(约70克):
锌皮(7克) 碳棒(5.2克)
锰粉(25克) 铜帽(0.5克)
汞(微量) 其他:约32克.
其它电池:铅、镉、镍等。
方案例举:
1、对锌的回收:
剥下干电池外面的锌皮,并用小刀或纱纸去掉表面的杂质,洗净干燥。 (可用作实验室制氢气的原料)
2、对汞的回收:(Hg2+)
向初步处理后的废液中,加入铜屑、铁屑或锌粒,置换出汞。
3、对镉、镍的回收:(Cd2+、Ni2+)
提示:Cd(OH)2、Ni(OH)2难溶于水。
向含Cd2+的废液中,加入可溶性碱,生成沉淀。过滤,洗涤,干燥。发达国家的政策:
美国、日本、欧盟未把群众日常生活使用的普通干电池作为危险废物对待,也没有强制单独收集处理普通干电池的法律。
在电池管理政策上,主要分两类:
第一类是针对普通干电池的。政府要求制造商逐步降低电池中的汞含量,最终禁止向电池中添加汞。对企业回收,国家既不鼓励也不限制。
第二类政策是针对可充电电池的。立法淘汰镍镉电池, 用镍氢、锂电池取代。并通过以旧换新方式回收.我国政策:
借鉴发达国家相关政策,2006达到无汞水平。谨慎收集废电池:
1.分散的废电池随生活垃圾填埋一般不会造成太大污染。
2.把大量的废电池集中到一个地方,加上处理不善(如剥开外壳,回收有价值部分,将残渣随意抛弃),则有可能引起局部地区的汞污染。
3.对已收集的废干电池,应交专业部门处理。 (1)水泥在运输或贮存过程中要注意什么?为什么水泥遇水很快结块变硬?
(2)取一包水泥,修补一下你家、学校、社区破损地面或墙体,想一想怎样修补才能牢固?
(3)在工农业生产及日常生活中,哪些物品是用玻璃制成的?知道它们的特点吗?
(4)我国各个年代都有保存完好的精美瓷器出土,据此你能说出陶瓷具有什么特性?
(5)比较下图中所列的塑料制品,它们各有什么特点?
(6)厨房里的物品,它们是由什么材料制成的.第4节 材料的发展2)材料制造与环境保护(+探究活动)
为了减少材料制造对环境污染的影响,有两种主要途径:
A、减少“三废”的排放(阅读材料)
B、改进材料制造的方法(绿色新工艺—探究活动)1)材料发展与人类文明的关系
明白材料的发展过程:探究:怎样以铜为主要原料制备硫酸铜?1、设计制备的方法: (物质转化规律的运用)
(1)已知硫酸铜与浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫和水。
(2)铜加热变为氧化铜,氧化铜再与稀硫酸反应,生成硫酸铜。
(3)铜和氯气反应得得氯化铜,氯化铜和氢氧化钠的反应制得氢氧化铜,氢氧化铜和硫酸反应制得硫酸铜。
(4)其它方法
2、写出实验原理(化学方程式):略
要求思考和讨论:以上方法在原料的利用率及产生的污染方面进行讨论,指出绿色工艺的可行性。根据讨论情况,引导提示:1.Cu CuSO4 + SO2 + H2OH2SO4(浓)2.Cu CuO CuSO4O2H2SO4利用率高,污染程度低(Cl2有毒) 污染严重 (成本高)注: 1.从利用率和对环境污染程度加以考虑
2.其他: 过程的复杂程度,安全性,及对 设备的要求程度
3.成本问题利用率低,污染严重
同课章节目录
