专题复习——金属的化学性质习题课
图片预览






文档简介
课件20张PPT。——金属的化学性质习题课专题复习例1、芯片是电脑、“智能”加点的核心部件,它是用高纯度硅制成的。下面是生产单质硅过程中的一个重要反应:
SiO2 + 2C Si +2CO↑,该反应的基本类型是
A.化合反应 B.分解反应
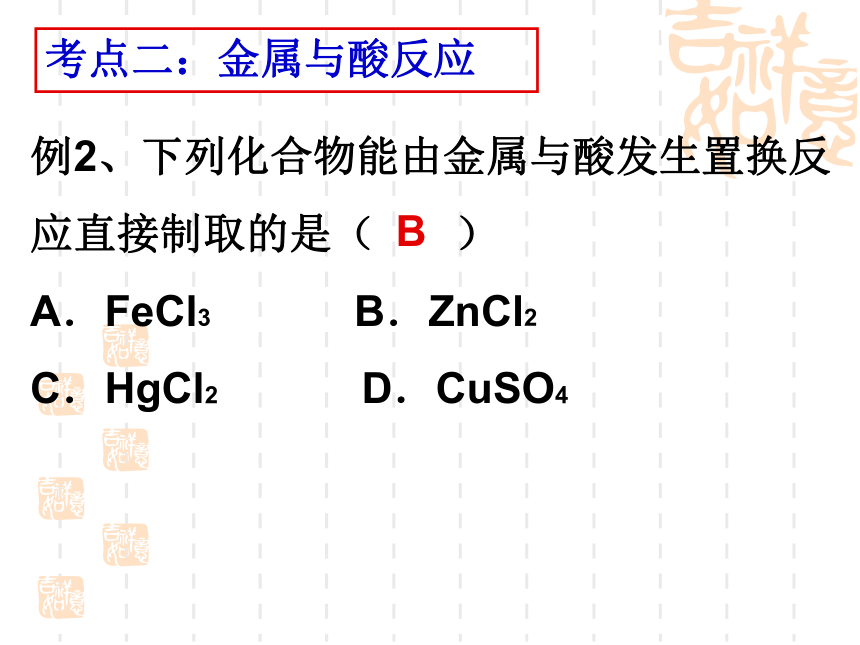
C.置换反应 D.复分解反应C考点一:置换反应的概念思考:你学过那些反应属于置换反应?例2、下列化合物能由金属与酸发生置换反应直接制取的是( )
A.FeCl3 B.ZnCl2
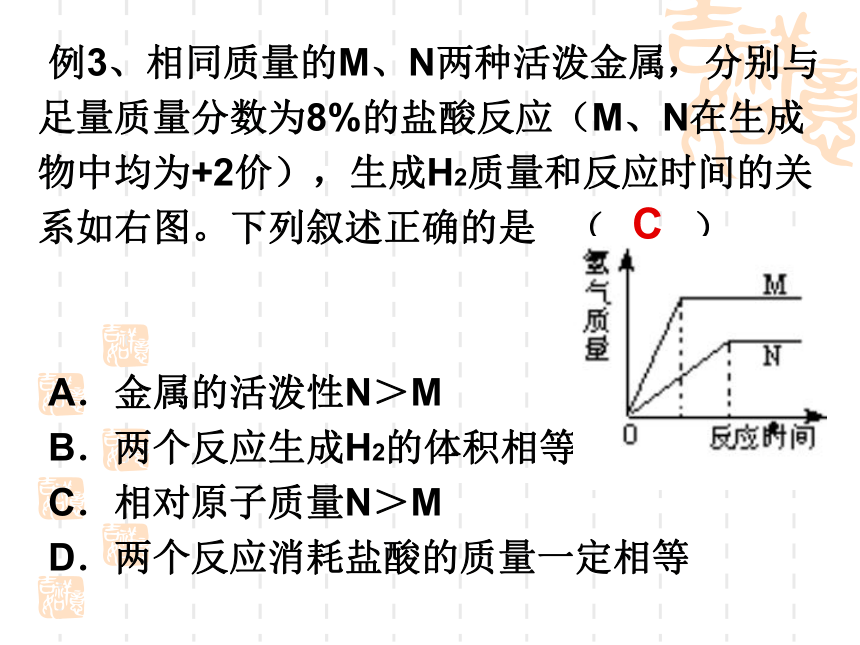
C.HgCl2 D.CuSO4 考点二:金属与酸反应B铁与酸反应的注意事项:1、只有金属活动顺序中H以前的金属才能与HCl和稀H2SO4反应生成H2;2、Fe与HCl和稀H2SO4反应生成亚铁盐;3、金属与浓硫酸或硝酸反应不生成氢气,而生产其它气体。例3、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
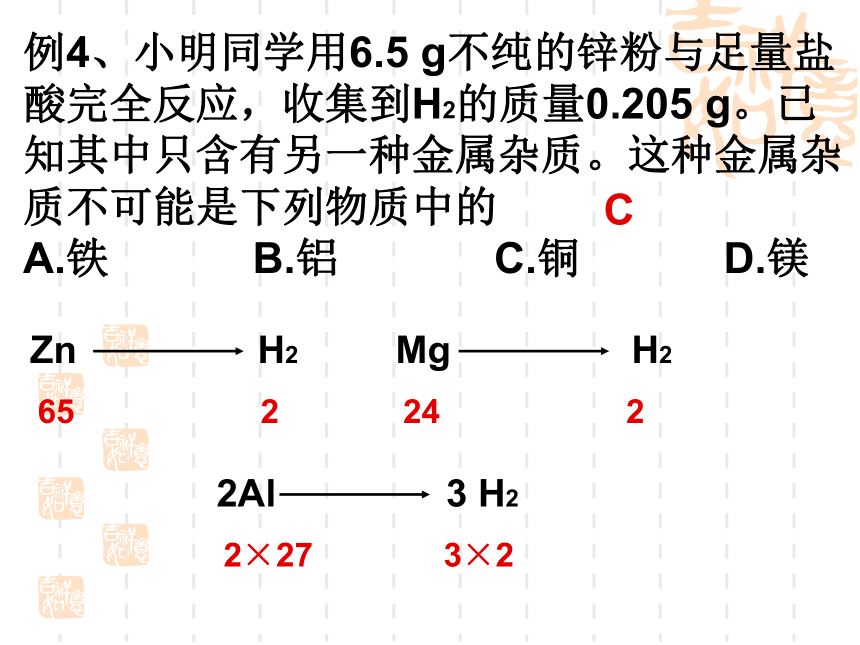
D.两个反应消耗盐酸的质量一定相等 C做此类图像题的要点为:1、曲线先拐表示反应速率快,金属活动性较强;2、在金属价态相同的前提下,等质量的金属与足量酸反应生成氢气越多,则金属的相对原子质量越小。例4、小明同学用6.5 g不纯的锌粉与足量盐酸完全反应,收集到H2的质量0.205 g。已知其中只含有另一种金属杂质。这种金属杂质不可能是下列物质中的
A.铁 B.铝 C.铜 D.镁 C考点三:金属间的置换反应例5、向Cu(NO3)2溶液中加入一定量的铁粉充分反应,下列情况中可能出现的是
①溶液中有Fe2+、Cu2+、不溶物为Cu
②溶液中有Fe2+、Cu2+、不溶物为Fe
③溶液中只有Cu2+、不溶物为Fe
④溶液中只有Fe2+、不溶物为Fe,Cu
A. ①③ B.①④ C.②③ D.③④ B金属间的置换反应注意事项:1、K、Ca、Na因活动性太强,要与水反应,故其不发生金属间的置换;2、必须为金属活动顺序中前面的金属将后面的金属从其化合物中置换出来;3、盐必须是可溶性盐,反应在水溶液中进行。例6、在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生。下列判断正确的是( )
A.滤出的固体中一定含有铜,可能含有铁和镁
B.滤出的固体一定含有铜,一定不含铁和镁
C.滤液中一定含有氯化镁和氯化亚铁,可能含有氯化铜
D.滤液中一定含有氯化镁、氯化亚铁、氯化铜 先:CuCl2 + Mg = MgCl2 + Cu后:FeCl2 + Mg = MgCl2 + Fe 因剩余固体不与酸反应,故只发生第一个反应。剩余固体全为Cu。滤液中一定含有氯化镁和氯化亚铁,可能有氯化铜。此类题中反应先后判断的规律是:较活泼的金属与较不活泼的金属对应的盐优先反应。例7、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mn、Mg、Cu B.Mg、Mn、Cu
C.Cu、Mg、Mn D.Cu、Mn、Mg B考点四:金属活动性强弱比较金属活动性强弱比较的一般方法:1、常见金属,可利用金属活动顺序直接得出结论;2、陌生金属,可利用:
⑴金属与O2反应的条件及反应的剧烈程度;⑵金属能否与酸反应及反应的剧烈程度;⑶金属间的置换反应。例8、A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D
C.D、C、A、B D.D、C、B、A C例9、铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)不锈钢是一种 (填“合金”或“金属”)。
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
①三种金属的活动性由强到弱的顺序是 。
②从上述探究实验可知,Cr 跟CuSO4溶液反应。若反应,请写出反应的化学方程式_________________。 合金Mg>Cr>Cu能Cr + CuSO4 = CrSO4 + Cu例10、为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③铝片浸入硫酸亚铁溶液中。 这组实验还不能完全证明三种金属的活动性顺序,请补充一个实验来达到目的(写出实验步骤、现象和化学方程式)。 实验步骤:将铁片浸入硫酸铜溶液中;现象:铁片表面有红色固体析出,溶液由
蓝色变为浅绿色;Fe + CuSO4 = FeSO4 + Cu例11、某校同学以“比较锰、铁、铜3种金属的活动性”为课题进行探究。(提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液。)
【做出猜想】他们考虑到铁的活动性比铜强,对3种金属的活动性顺序作出如下猜想。
猜想一:锰>铁>铜; 猜想二:铁>铜>锰;
猜想三: 。
【设计实验】为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案。
(1)验证猜想一。实验方案是将锰片、铁片分别放入稀盐酸中,观察现象。
(2)验证猜想二。实验方案是将锰片放入 中,观察现象。
(3)验证猜想三。实验方案是(只用两个实验):
。铁>锰>铜硫酸铜溶液将两片锰分别放入硫酸亚铁溶液和硫酸铜溶液中 考点五:天平问题例12、如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左 分析: 反应开始时,锌的反应速率较快,放出氢气的质量较大,所以天平先向右偏; 反应结束时,因铁的相对原子质量较小(两种金属价态相同),所以铁与酸反应生成氢气较多,天平又向左偏。
SiO2 + 2C Si +2CO↑,该反应的基本类型是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应C考点一:置换反应的概念思考:你学过那些反应属于置换反应?例2、下列化合物能由金属与酸发生置换反应直接制取的是( )
A.FeCl3 B.ZnCl2
C.HgCl2 D.CuSO4 考点二:金属与酸反应B铁与酸反应的注意事项:1、只有金属活动顺序中H以前的金属才能与HCl和稀H2SO4反应生成H2;2、Fe与HCl和稀H2SO4反应生成亚铁盐;3、金属与浓硫酸或硝酸反应不生成氢气,而生产其它气体。例3、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C做此类图像题的要点为:1、曲线先拐表示反应速率快,金属活动性较强;2、在金属价态相同的前提下,等质量的金属与足量酸反应生成氢气越多,则金属的相对原子质量越小。例4、小明同学用6.5 g不纯的锌粉与足量盐酸完全反应,收集到H2的质量0.205 g。已知其中只含有另一种金属杂质。这种金属杂质不可能是下列物质中的
A.铁 B.铝 C.铜 D.镁 C考点三:金属间的置换反应例5、向Cu(NO3)2溶液中加入一定量的铁粉充分反应,下列情况中可能出现的是
①溶液中有Fe2+、Cu2+、不溶物为Cu
②溶液中有Fe2+、Cu2+、不溶物为Fe
③溶液中只有Cu2+、不溶物为Fe
④溶液中只有Fe2+、不溶物为Fe,Cu
A. ①③ B.①④ C.②③ D.③④ B金属间的置换反应注意事项:1、K、Ca、Na因活动性太强,要与水反应,故其不发生金属间的置换;2、必须为金属活动顺序中前面的金属将后面的金属从其化合物中置换出来;3、盐必须是可溶性盐,反应在水溶液中进行。例6、在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生。下列判断正确的是( )
A.滤出的固体中一定含有铜,可能含有铁和镁
B.滤出的固体一定含有铜,一定不含铁和镁
C.滤液中一定含有氯化镁和氯化亚铁,可能含有氯化铜
D.滤液中一定含有氯化镁、氯化亚铁、氯化铜 先:CuCl2 + Mg = MgCl2 + Cu后:FeCl2 + Mg = MgCl2 + Fe 因剩余固体不与酸反应,故只发生第一个反应。剩余固体全为Cu。滤液中一定含有氯化镁和氯化亚铁,可能有氯化铜。此类题中反应先后判断的规律是:较活泼的金属与较不活泼的金属对应的盐优先反应。例7、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mn、Mg、Cu B.Mg、Mn、Cu
C.Cu、Mg、Mn D.Cu、Mn、Mg B考点四:金属活动性强弱比较金属活动性强弱比较的一般方法:1、常见金属,可利用金属活动顺序直接得出结论;2、陌生金属,可利用:
⑴金属与O2反应的条件及反应的剧烈程度;⑵金属能否与酸反应及反应的剧烈程度;⑶金属间的置换反应。例8、A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D
C.D、C、A、B D.D、C、B、A C例9、铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)不锈钢是一种 (填“合金”或“金属”)。
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
①三种金属的活动性由强到弱的顺序是 。
②从上述探究实验可知,Cr 跟CuSO4溶液反应。若反应,请写出反应的化学方程式_________________。 合金Mg>Cr>Cu能Cr + CuSO4 = CrSO4 + Cu例10、为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③铝片浸入硫酸亚铁溶液中。 这组实验还不能完全证明三种金属的活动性顺序,请补充一个实验来达到目的(写出实验步骤、现象和化学方程式)。 实验步骤:将铁片浸入硫酸铜溶液中;现象:铁片表面有红色固体析出,溶液由
蓝色变为浅绿色;Fe + CuSO4 = FeSO4 + Cu例11、某校同学以“比较锰、铁、铜3种金属的活动性”为课题进行探究。(提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液。)
【做出猜想】他们考虑到铁的活动性比铜强,对3种金属的活动性顺序作出如下猜想。
猜想一:锰>铁>铜; 猜想二:铁>铜>锰;
猜想三: 。
【设计实验】为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案。
(1)验证猜想一。实验方案是将锰片、铁片分别放入稀盐酸中,观察现象。
(2)验证猜想二。实验方案是将锰片放入 中,观察现象。
(3)验证猜想三。实验方案是(只用两个实验):
。铁>锰>铜硫酸铜溶液将两片锰分别放入硫酸亚铁溶液和硫酸铜溶液中 考点五:天平问题例12、如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左 分析: 反应开始时,锌的反应速率较快,放出氢气的质量较大,所以天平先向右偏; 反应结束时,因铁的相对原子质量较小(两种金属价态相同),所以铁与酸反应生成氢气较多,天平又向左偏。
