常见的化合物[下学期]
图片预览






文档简介
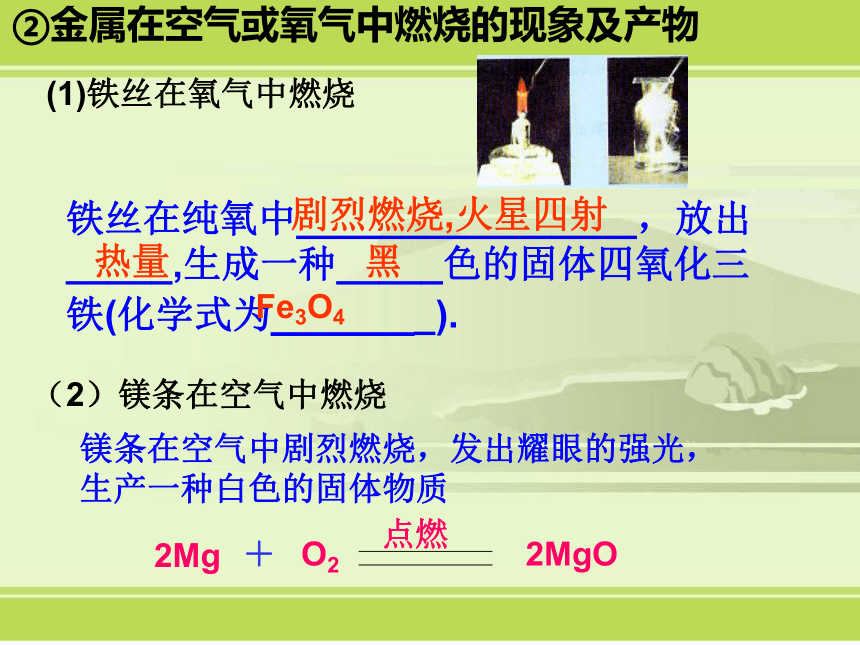
课件16张PPT。第5节 常见的化合物①单质:由同种元素组成的纯净物。可分为金属、非金属及稀有气体。1.单质和化合物②金属在空气或氧气中燃烧的现象及产物铁丝在纯氧中________________,放出 _____,生成一种_____色的固体四氧化三铁(化学式为_______).剧烈燃烧,火星四射热量黑Fe3O4(1)铁丝在氧气中燃烧(2)镁条在空气中燃烧镁条在空气中剧烈燃烧,发出耀眼的强光,生产一种白色的固体物质非金属在空气或氧气中燃烧的现象及产物硫在空气中燃烧发出___________色火焰硫在纯氧中燃烧发出_____________色火焰,反应后生成一种具有___________气味的二氧化硫手摸集气瓶外壁的感觉是_______,说明硫燃烧能_______热.微弱的淡蓝刺激性明亮的蓝紫色热放(1)硫在氧气中燃烧(2)红磷在氧气中燃烧的现象:红磷在氧气中燃烧发出白光,冒出白烟,放出热量.(3)氢气在空气中燃烧的现象:纯洁的氢气在空气中能安静的燃烧,发出淡蓝色的火焰, 放出热量.可分为有机化合物和无机化合物,无机化合物又可分为氧化物、酸、碱和盐。③化合物:由不同种元素组成的纯净物。2.重要的盐什么是盐:是酸与碱中和的产物,能电离出金属阳离子(或铵根NH4+ )和酸根阴离子的化合物。①描述食盐的主要性质及用途氯化钠(NaCl)⑴俗称食盐,有咸味,无色晶体,易溶于水⑵制取:晾晒海水、开采盐矿等⑶用途:调味、腌渍食品、重要化工原料(Na+和Cl-的利用)、制0.9%的生理盐水等。 ②碳酸钠(Na2CO3)⑴俗称纯碱或苏打,易溶于水,其水溶液呈碱性。其结晶水合物(Na2CO3?10H2O)易风化,失去结晶水而形成粉末状Na2CO3
补充
碳酸根离子的鉴别方法:用稀盐酸和澄清的石灰水。
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
Na2CO3+ Ca(OH)2= CaCO3↓+H2O ⑵用途:制造玻璃、蒸馒头,利用碱性制肥皂,造纸、纺织品等??????③碳酸钙(CaCO3)⑴纯净的碳酸钙是一种白色块状固体,难溶于水,是大理石、石灰石的主要成分;
⑵高温条件下能够分解:
这也是工业上制CO2的主要方法。⑶用途:建筑材料、制水泥和玻璃的原料、炼铁的助熔剂 ①③列举常见酸、碱的主要的性质和用途(参考《导引》P58表格)酸:电离时生成的阳离子全部都是氢离子(H+)的化合物。3.酸和碱碱:电离时产生的阴离子全部是氢氧根离子(OH-)的化合物。⑴ 酸能使紫色的石蕊变红,无色酚酞不变色。⑵酸 + 碱 = 盐 + 水 ⑸酸 + 盐 = 新盐 + 新酸⑶酸 +金属氧化物= 盐 + 水⑷酸+金属 = 盐 + 氢气②酸的共性:碱的共性(可溶性碱)(1)碱性物质能使紫色石蕊变蓝,无色酚酞变红.(3)碱跟酸作用生成盐和水
这种反应也叫中和反应。(2)非金属氧化物跟碱反应生成盐和水(4)盐和碱反应生成另一种碱和另一种盐 (1)酸碱指示剂(石蕊试液或试纸、酚酞试液)
(2) pH试纸
测定pH的最简便方法:使用pH试纸,用洁净的玻璃棒蘸取待测溶液,滴在pH试纸上,然后将试纸显示的颜色与标准比色卡对照。④测定溶液酸碱性酸(或碱)流到实验台上——用适量碳酸氢钠溶液(或稀醋酸)冲洗——水洗——布擦;
碱溶液滴到皮肤上——水洗——涂硼酸;
酸溶液滴到皮肤上——水洗——涂3%~5%碳酸氢钠溶液(若是浓硫酸应先布擦再水洗)。⑤知道强酸、强碱的使用注意事项浓硫酸易溶于水,同时放出大量的热,且密度比水大,稀释时应做到:①一定要注酸入水,万勿注水入酸。
②慢慢地沿玻璃棒(或器壁)倒入。
③不断地搅拌,使产生的热量迅速地扩散。补充:浓硫酸稀释时的注意事项2).中和反应的应用:3)中和反应的实质:
实质是酸电离的H+与碱电离的OH-结合成中性的水。
H++OH-=H2O4.中和反应:1)定义:碱跟酸作用生成盐和水的反应叫中和反应。
补充
碳酸根离子的鉴别方法:用稀盐酸和澄清的石灰水。
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
Na2CO3+ Ca(OH)2= CaCO3↓+H2O ⑵用途:制造玻璃、蒸馒头,利用碱性制肥皂,造纸、纺织品等??????③碳酸钙(CaCO3)⑴纯净的碳酸钙是一种白色块状固体,难溶于水,是大理石、石灰石的主要成分;
⑵高温条件下能够分解:
这也是工业上制CO2的主要方法。⑶用途:建筑材料、制水泥和玻璃的原料、炼铁的助熔剂 ①③列举常见酸、碱的主要的性质和用途(参考《导引》P58表格)酸:电离时生成的阳离子全部都是氢离子(H+)的化合物。3.酸和碱碱:电离时产生的阴离子全部是氢氧根离子(OH-)的化合物。⑴ 酸能使紫色的石蕊变红,无色酚酞不变色。⑵酸 + 碱 = 盐 + 水 ⑸酸 + 盐 = 新盐 + 新酸⑶酸 +金属氧化物= 盐 + 水⑷酸+金属 = 盐 + 氢气②酸的共性:碱的共性(可溶性碱)(1)碱性物质能使紫色石蕊变蓝,无色酚酞变红.(3)碱跟酸作用生成盐和水
这种反应也叫中和反应。(2)非金属氧化物跟碱反应生成盐和水(4)盐和碱反应生成另一种碱和另一种盐 (1)酸碱指示剂(石蕊试液或试纸、酚酞试液)
(2) pH试纸
测定pH的最简便方法:使用pH试纸,用洁净的玻璃棒蘸取待测溶液,滴在pH试纸上,然后将试纸显示的颜色与标准比色卡对照。④测定溶液酸碱性酸(或碱)流到实验台上——用适量碳酸氢钠溶液(或稀醋酸)冲洗——水洗——布擦;
碱溶液滴到皮肤上——水洗——涂硼酸;
酸溶液滴到皮肤上——水洗——涂3%~5%碳酸氢钠溶液(若是浓硫酸应先布擦再水洗)。⑤知道强酸、强碱的使用注意事项浓硫酸易溶于水,同时放出大量的热,且密度比水大,稀释时应做到:①一定要注酸入水,万勿注水入酸。
②慢慢地沿玻璃棒(或器壁)倒入。
③不断地搅拌,使产生的热量迅速地扩散。补充:浓硫酸稀释时的注意事项2).中和反应的应用:3)中和反应的实质:
实质是酸电离的H+与碱电离的OH-结合成中性的水。
H++OH-=H2O4.中和反应:1)定义:碱跟酸作用生成盐和水的反应叫中和反应。
