2007初三科学复习物质专题1 物质的微粒(广东省深圳市罗湖区)
文档属性
| 名称 | 2007初三科学复习物质专题1 物质的微粒(广东省深圳市罗湖区) |  | |
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2008-02-04 01:34:00 | ||
图片预览





文档简介
课件66张PPT。2007初三科学复习
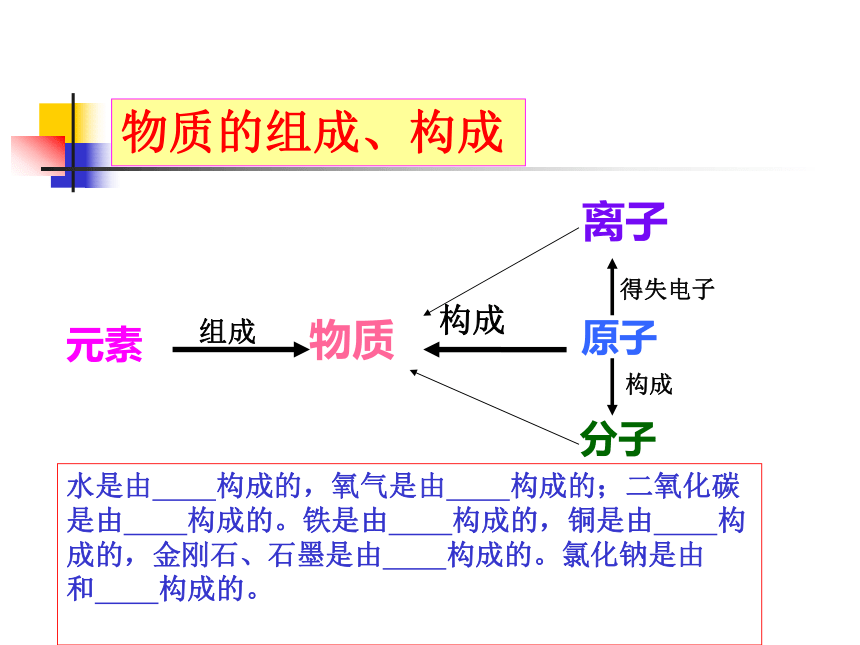
物质专题1 物质的微粒物质的组成、构成物质原子分子离子元素得失电子构成水是由 构成的,氧气是由 构成的;二氧化碳是由 构成的。铁是由 构成的,铜是由 构成的,金刚石、石墨是由 构成的。氯化钠是由 和 构成的。
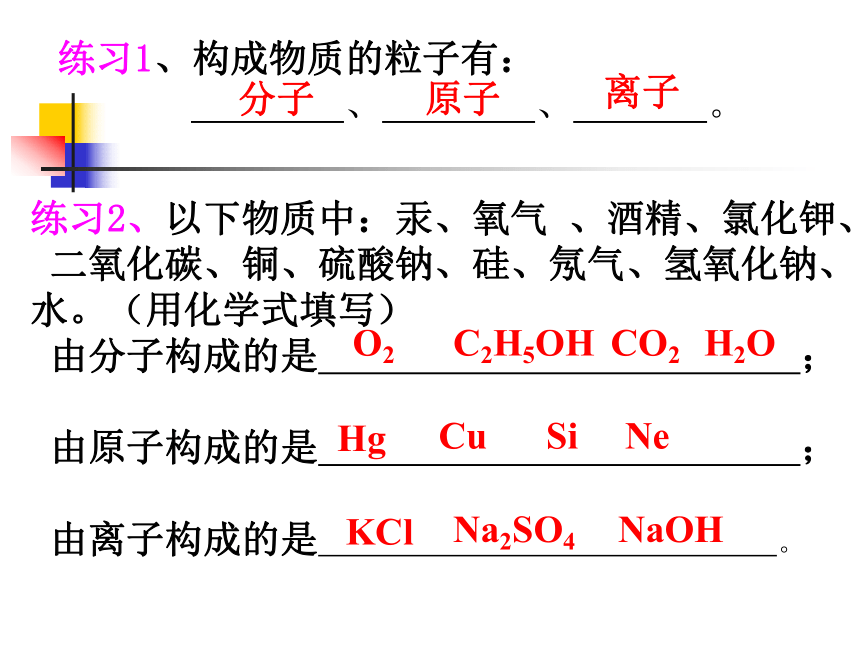
练习1、构成物质的粒子有:
、 、 。
分子原子离子练习2、以下物质中:汞、氧气 、酒精、氯化钾、
二氧化碳、铜、硫酸钠、硅、氖气、氢氧化钠、
水。(用化学式填写)
由分子构成的是 ;
由原子构成的是 ;
由离子构成的是 。
HgO2C2H5OHKClCO2CuNa2SO4SiNeNaOHH2O原子与分子 分子是 的一种粒子,
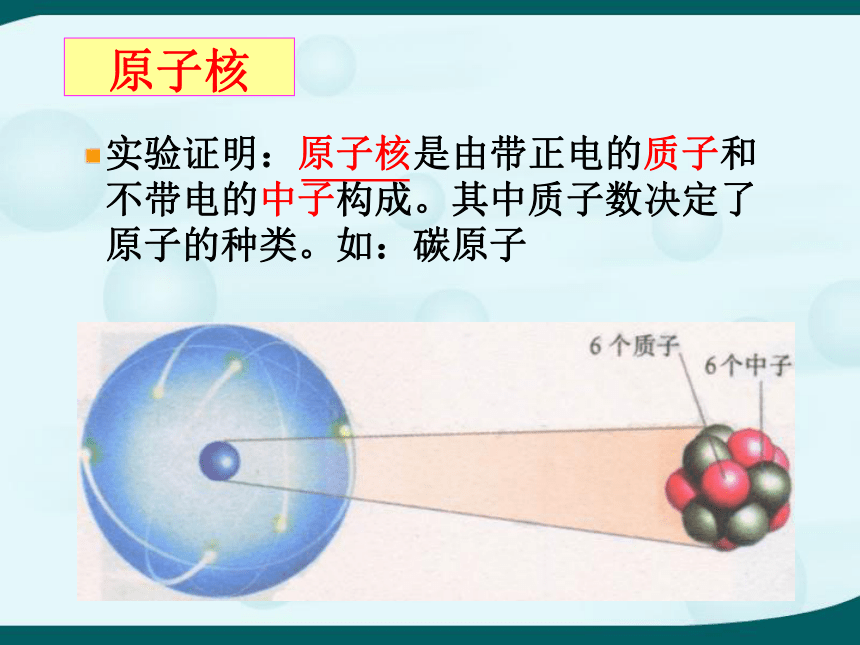
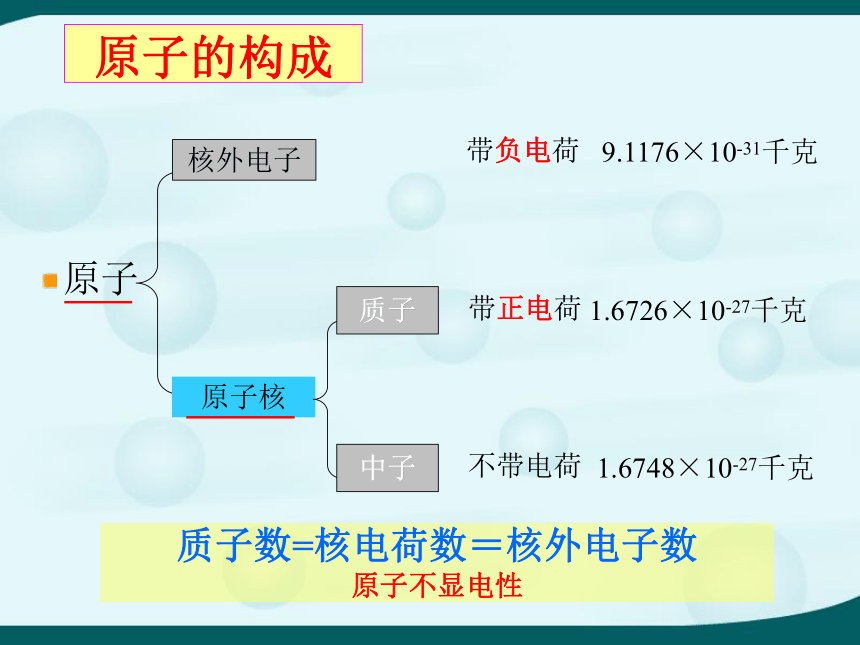
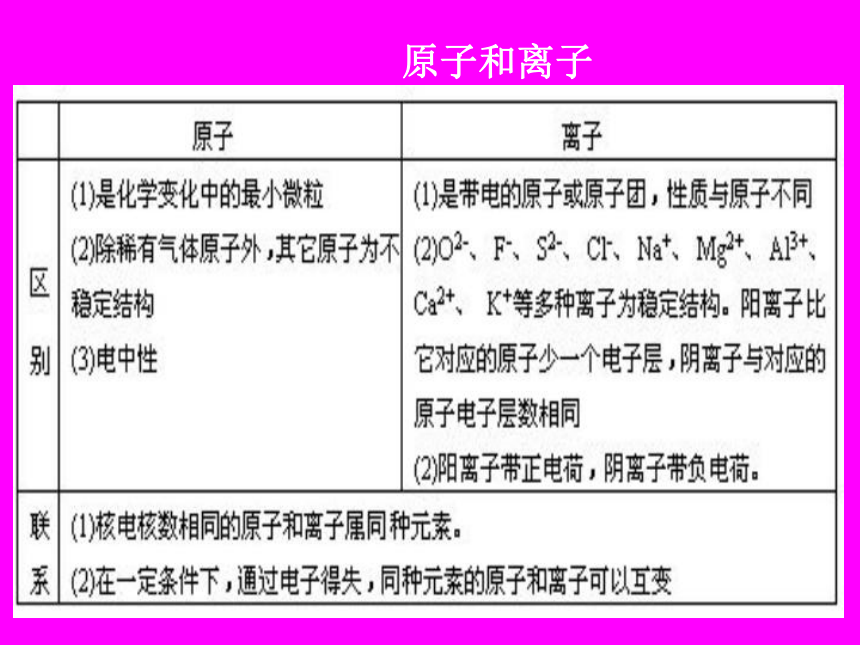
原子是 中的最小粒子。 保持物质化学性质化学变化理解:化学变化的实质是分子破坏原子,原子重新组合成新分子。分子、原子、离子的概念分子是保持物质化学性质的微粒 ①很小 ②有间隙 ③不断运动 原子是化学变化中最小的微粒。 ①很小 ②有间隙③不断运动离子是带电的原子和原子团。 如:Na+ 、SO42- 分子与原子的根本区别: 在化学反应中分子可分,原子不可分。 原子核实验证明:原子核是由带正电的质子和不带电的中子构成。其中质子数决定了原子的种类。如:碳原子原子的构成原子
原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数=核电荷数=核外电子数
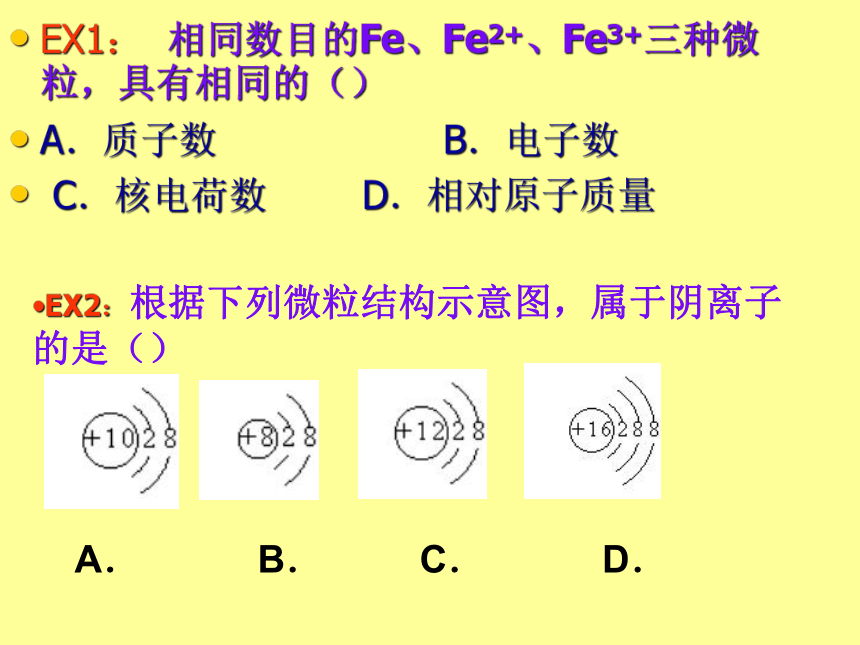
原子不显电性核外电子原子和离子EX1: 相同数目的Fe、Fe2+、Fe3+三种微粒,具有相同的()
A.质子数 B.电子数
C.核电荷数 D.相对原子质量EX2:根据下列微粒结构示意图,属于阴离子的是()
A. B. C. D.
1、基本概念:
元素是具有相同 核电荷数 (即 质子数 )的同一类原子的总称。
不同元素的最本质的区别是:元素原子的核电荷数 (即 质子数 )是否相同。
2、元素的分类:
金属元素、非金属元素、稀有气体元素物质的组成——元素填空:氢 He 碳 N 氧 F 氖
Na 镁 Al 硅 P 硫 Cl
氩 K 钙 Mn 铁 Cu 锌
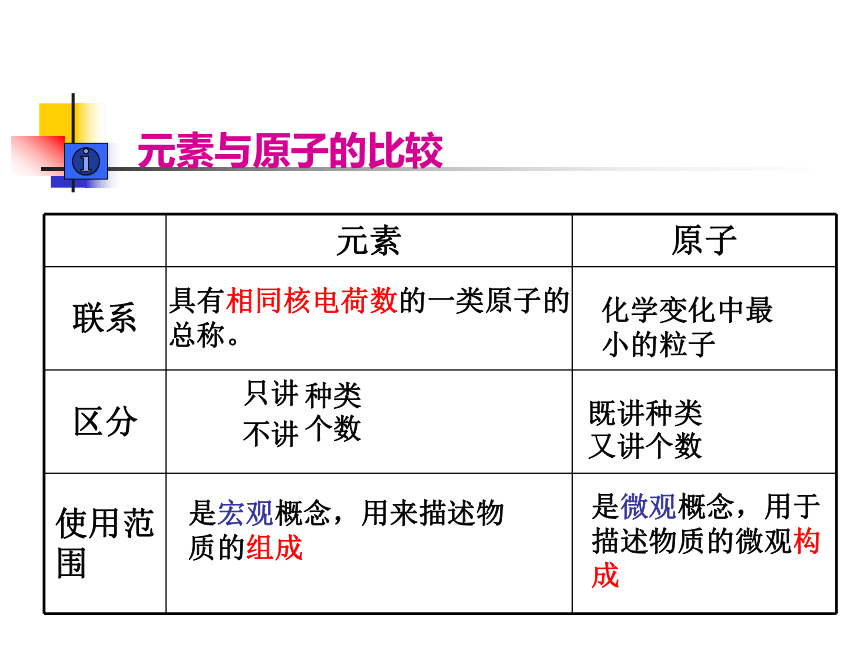
Ag 钡 Pt 汞 I 具有相同核电荷数的一类原子的总称。化学变化中最小的粒子种类
个数既讲种类
又讲个数是宏观概念,用来描述物质的组成是微观概念,用于描述物质的微观构成元素与原子的比较 [例1] 某药品说明书中标明:本品含碘15mg、镁65mg、铜2mg、锌1.5mg、锰1mg。这里标明的各种成分是指()
A.分子 B.原子 C.元素 D.单质 [例2] 下列化学用语中,既可以表示元素,又可以表示这种元素的一个原子,还可以表示由这种元素组成的单质的是()
A.N2 B.Mg C.2O2 D.H
元素符号的意义:表示元素;元素的一个原子。化学式1.定义:用元素符号表示物质组成的式子。A1.下列符号不能表示化学式的是 。
A H B O2 C Fe D NaCl表示一个水分子表示水这种物质表示一个水分子由此2个氢原子和1个氧原子构成表示水由氢元素和氧元素组成一个化学式给你传递了什么信息?CO2一个化学式给你传递了什么信息?一个二氧化碳分子一个二氧化碳分子中有两个氢原子和一个氧原子二氧化碳二氧化碳由碳和氧元素组成熟记常用物质的化学式单质、氧化物、酸、碱、盐?元素的化合价(要求背诵)元素的化合价(要求背诵)一价 K Na Cl Ag H
二价Ca Mg O Ba Zn
三Al 四 Si 五 N P
单质状态都为0化合物中元素化合价的代数和为??标化合价KClO3+5HnRO2n-1 ·+1-2x(+1)× n+x+(-2) ×(2n-1)=0x= +(3n-2)+5-1+7+10HClO4 KClO3 Ca(ClO)2 Cl2 KCl氯元素的化合价由高到低排列的是:KClO3 KCl HClO4 Ca(ClO)2 Cl2结束根据化合价写化学式:根据下列元素(或原子团)在化合物中的化合价:K(+1)、O (-2)、Cl (0)、H (+1)、S (+4)、CO3 (-2)写出下列类别物质的化学式及名称。K2CO3H2CO3Cl2K2OSO2KOHH2SO3K2SO3常见的化学反应①质量守恒定律: 参加化学反应的各物质的质量总和,等于反应
后各物质的质量总和。 例: 在化学反应 A + B ==== C + D 中,已知
15克A与20克B恰好完全反应,生成5克C,
若实际反应时生成了6克D,则参加反应的
B的质量是 克. 4例:在煤气中加入的少量有特殊气味的
乙硫醇(C2H5SH)也可以燃烧,其反应
的化学方程式为:
2C2H5SH + 9O2 == 4CO2+ 2X + 6H2O,
则x的化学式是 。 SO2 ②化学方程式的书写步骤和强化训练。 书写步骤:(1)根据化学反应事实写出反应物和生成物
的化学式(需要时要标上反应条件)
(2)根据质量守恒定律将方程式配平 (3)准确写出“↓”和“↑”符号
练习:写出有二氧化碳生成的化合反应、分解反应、置换反应和复分解反应各一个。燃料及其利用1.燃烧与灭火燃烧的条件:(1)可燃物; (2)氧气(或空气);
(3)达到燃烧所需的最低温度(也叫着火点)灭火原理:(1)清除可燃物或使可燃物与其他物品隔离(釜底抽薪);
(2)隔绝氧气(或空气);
(3)将温度降低到可燃物的着火点以下。 (1)可燃物本身属性;
(2)氧气的浓度;
(3)可燃物与氧气(或空气)的
接触面积。影响燃烧现象的因素:2.燃料的燃烧和对环境的影响化石燃料煤
石油
天然气(主要成分:CH4) 煤燃烧会排放出二氧化硫(SO2)、二氧化氮(NO2)和一氧化碳(CO)等污染物。其中的SO2、NO2等溶于雨水,会形成酸雨。酸雨会对环境造成较大的破坏。煤的燃烧污染:如太阳能、风能、潮汐能、地热、核能、氢能、酒精等,以减少化石燃料的燃烧利用。通常开发新能源有:化学反应中能量的变化通常表现为热量的变化:化学用语小结: 物质的分类物质混合物纯净物化合物单质金属单质 Fe非金属单质C、O2氧化物 MO酸HA稀有气体He依据是:
物质种类依据是:
元素种类盐MA:NaCl、 Na2CO3碱MOH 纯净物和混合物两种多种不同一种同种 空气
(N2、 O2等) 水
(H2O)1、下图是表示气体微粒示意图,图中●和○分别表示两种不同的原子,请根据条件填写答案。想一想、做一做(1)表示纯净物的是 ;
(2)表示混合物的是 ;
(3)表示单质的是 ;
(4)表示化合物的是 。A、CBCA
2.有下列物质:①镁条②液态氧③氯酸钾④冰水混合物
⑤五氧化二磷⑥食盐水⑦氖气⑧空气
将它们的序号填入相应的横线上:
属于混合物的是 ;属于单质是 ;
属于氧化物的是 ;属于化合物的是 。
3.人们常说豆制品中富含蛋白质,菠菜中含丰富的铁质,这里的“铁质”指的是铁 。(用元素、单质、原子、分子回答)⑥ ⑧ ① ② ⑦④ ⑤③ ④ ⑤ 元素识别典型的酸、碱、盐酸:物质的水溶液中的 离子全部是 的化合物;
碱:物质的水溶液中的 离子全部是 的化合物;
盐:由 和 组成的化合物。
常见的酸有 、 、 等;
常见的碱有 、 等;
常见的盐有 、 、 等;知道指示剂的颜色变化C物质的变化(由分子构成的物质)①复分解反应:两种化合物相互交换成分,生成两种新的化合物的反应。AB+ CD = AC+ CB
发生条件:两种物质在溶液中相互交换离子,若生成沉淀,或气体,或水,那么复分解反应就可以发生。
②置换反应:a+bc==b+ac
在溶液中,一种活泼性较强的金属,能将活泼性较弱的金属(或H)从它们的盐(或酸)溶液中置换出来。
A、盐1+金属1=盐2+金属2
B、酸+金属=盐+氢气
发生条件:活动性强的置换活动性弱的
附加条件:盐要可溶于水
③化合反应: A+B=AB
④分解反应: AB=A+B水的电解H2O通电H2 + O2氧化汞的分解结论:化学变化中旧分子分解为原子,原子重新组合,生成新的分子。
也就是在化学变化中分子可分,而原子不可分。旧分子新分子用分子的观点解释一下水的电解与水的蒸发有什么不同呢?水蒸发水电解分子不变分子改变讨论下图中同种符号表示同种分子,则A→B属于 变化,
C →D属于 变化。物理化学酸与活泼金属反应酸 + 氢前金属 = 盐 + 氢气 (注意条件) 酸与金属氧化物反应酸与碱反应酸与盐反应小测 1.判断某原子属于何种元素的依据是( )
A.电子数 B.质子数 C.相对原子质量 D.化学性质
2. 二氧化碳、氧化镁、氧气中都含有的是( )
A.氧气 B.氧原子 C.氧元素 D.氧分子
3.水是由 和 组成的;一个水分子是由
和 构成的。
4.铁矿石、钢铁、铁锈中都含有铁 。
5.二氧化碳是由 构成的;汞是由 构成的。BC氢元素氧元素两个氢原子一个氧原子元素二氧化碳分子汞原子动脑筋1.化学谜语(各打一元素)2.用大写字母A、B和小写字母a、g、r可以写成的元素有 。铁钾金Ag、Ar、Ba、Br汞溶液部分的知识1、溶液的概念;溶质、溶剂、溶液之关系。 2、饱和溶液与不饱和溶液的有关知识: 3、溶解度概念; 溶解度曲线;
区分溶解度和溶解性。 4、溶质质量分数的概念及计算 5、溶液的配制 1、溶液的概念;溶质、溶剂、溶液之关系。
溶液的概念 一种或几种物质分散到另一种物质里,
形成均一的、稳定的混合物,叫做溶液溶液的组成及关系溶液溶液质量 = 溶质质量 + 溶剂质量
(溶剂不指明时,一般指水溶液) 例:食盐溶液:溶质是食盐,溶剂是水。硫酸锌溶液:溶质是硫酸锌,溶剂是水。碘酒溶液:溶质是碘,溶剂是酒精。训练水硫酸铜水氯化氢碳酸钠水氯化铁水酒精水碘酒精1、溶液一定是 ( )
A:一种固体溶解在一种液体里形成的。
B:均一、稳定、无色、透明的。
C:固态物质溶于水形成的。
D:至少由两种物质组成的均一的稳定的混合物D2、关于溶液的特征。下列叙述不正确的是( )
A:溶液一定是无色的液体。
B:溶液一定是混合物
C:当外界条件不变时,只要溶剂不减少,温度不变
化,不管放置多久溶质不会从溶液中分离出来。
D:溶液形成后,溶液中各部分的性质相同,浓稀一样。A2、饱和溶液与不饱和溶液的有关知识 ①概念一定温度下,在一定量的溶剂里,不能再溶解
某种溶质的溶液叫做饱和溶液。
还能再溶解某种溶质的溶液叫做不饱和溶液②识别: 一般的说,要确定某一溶液是否饱和,只要看在
一定 温度下,有没有不能继续溶解的剩余溶质存在,
如有就为饱和溶液。例:(2005年深圳升中考化学试题)
A、B、C三烧杯中分别装有等质量的水,在相同
的温度下,向A、B、C烧杯杯分别加入25g、15 g、
5 g某固体溶质,充分溶解后,静置,现象如下图:
回答下列问题(填编号)
CBAABC3、溶解度概念;溶解度曲线;区分溶解度和溶解性。 (1)区分溶解度和溶解性 根据溶解度大小分:易溶、可溶、微溶、难溶。 (2)溶解度概念:
定义:一定温度下,某固态物质在100克溶剂里
达到饱和状态时所溶解的质量。 意义:例:20℃时,氯酸钾的溶解度为7.4克。 表示:20℃时,100克水溶解了7.4克氯酸钾达到饱和。 训练:20℃时,50克水溶解18克食盐达到饱和,
问20℃时,食盐的溶解度是: 。
36克(3)溶解度曲线: ①制作曲线 :实验测定硝酸钾溶解度数据如下:
0 ℃ 10 ℃ 20 ℃ 30 ℃ 40 ℃ 50 ℃ 60 ℃ 70 ℃
13.3 g 20.9 g 31.6 g 45.8 g 63.9 g 85.5 g 110 g 138 g
根据以上实验数据作出溶解度曲线: ②会看曲线:100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的交点表示什么意义? 练习:2、
40℃时氯化铵的溶解度为______,
70℃时氯化铵的溶解度为______。
70℃时氯化钾的溶解度为____。47g44g60gA.0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃熟石灰的溶解度曲线:溶解度曲线一般规律: 大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。 少数固体物质溶解度受温度影响不大, 例如食盐。 极少数固体物质溶解度随温度 升高反而减小,例如熟石灰。甲乙丙B温度(℃)溶解度
(g)T1 T2(1)T2时,溶解度最大的是________;(2)B点代表的含义是
___________________________________;(3)T1时的甲溶液升温到T2,甲溶液变成
______________. 甲T1℃时,甲、丙两种物质的溶解度相等不饱和溶液想一想:[讨论] 天气闷热时,鱼儿为什么总爱在水面上进行呼吸?气体的溶解度随温度的增加而减小.随压强的减小而减小
4、溶液质量分数的概念计算溶质的质量分数 = 溶质质量(克) ×100%
溶液质量(克)
例1、配制150Kg质量分数为16%食盐溶液,
需要食盐和水多少Kg?解:食盐质量=150 Kg×16% = 24 Kg
水的质量=150 Kg – 24 Kg = 126 Kg
答:需要食盐24 Kg,水126 Kg.
** 例2:20℃时,食盐的溶解度为36克,
(1)计算此温度下饱和食盐水的食盐的质量分数?(2)能否配制出20℃溶质质量分数为30%的食盐水?不能答:食盐水中食盐的质量分数是26.5%。**例3、把100克63%的HNO3溶液稀释成10%
硝酸溶液, 需要加水多少克?解:设需要加水的质量为X
100g×63% = (100g+X)×10%X = 530g
答:需要加水530克.例4:配制50克5%的氯化钠溶液。(1)计算:需要称取食盐 克,
量取水 毫升。2.547.5(2)称量(3)溶解5、溶液的配制溶液的配制过程3、根据化学式的计算3.碳酸钙(化学式为CaCO3)是石灰石、大理石的主要成分,它不仅是一种建筑装饰材料,还是一种很好的补钙药品。
(1) CaCO3的相对分子质量为 。
(2)CaCO3中钙、碳、氧元素的质量比为 (最简整数比)
(3)CaCO3中钙元素的质量分数为 。
10010:3:1240%(1)求相对分子质量(2)求各元素的质量比(3)求各元素的质量分数
练习1、构成物质的粒子有:
、 、 。
分子原子离子练习2、以下物质中:汞、氧气 、酒精、氯化钾、
二氧化碳、铜、硫酸钠、硅、氖气、氢氧化钠、
水。(用化学式填写)
由分子构成的是 ;
由原子构成的是 ;
由离子构成的是 。
HgO2C2H5OHKClCO2CuNa2SO4SiNeNaOHH2O原子与分子 分子是 的一种粒子,
原子是 中的最小粒子。 保持物质化学性质化学变化理解:化学变化的实质是分子破坏原子,原子重新组合成新分子。分子、原子、离子的概念分子是保持物质化学性质的微粒 ①很小 ②有间隙 ③不断运动 原子是化学变化中最小的微粒。 ①很小 ②有间隙③不断运动离子是带电的原子和原子团。 如:Na+ 、SO42- 分子与原子的根本区别: 在化学反应中分子可分,原子不可分。 原子核实验证明:原子核是由带正电的质子和不带电的中子构成。其中质子数决定了原子的种类。如:碳原子原子的构成原子
原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数=核电荷数=核外电子数
原子不显电性核外电子原子和离子EX1: 相同数目的Fe、Fe2+、Fe3+三种微粒,具有相同的()
A.质子数 B.电子数
C.核电荷数 D.相对原子质量EX2:根据下列微粒结构示意图,属于阴离子的是()
A. B. C. D.
1、基本概念:
元素是具有相同 核电荷数 (即 质子数 )的同一类原子的总称。
不同元素的最本质的区别是:元素原子的核电荷数 (即 质子数 )是否相同。
2、元素的分类:
金属元素、非金属元素、稀有气体元素物质的组成——元素填空:氢 He 碳 N 氧 F 氖
Na 镁 Al 硅 P 硫 Cl
氩 K 钙 Mn 铁 Cu 锌
Ag 钡 Pt 汞 I 具有相同核电荷数的一类原子的总称。化学变化中最小的粒子种类
个数既讲种类
又讲个数是宏观概念,用来描述物质的组成是微观概念,用于描述物质的微观构成元素与原子的比较 [例1] 某药品说明书中标明:本品含碘15mg、镁65mg、铜2mg、锌1.5mg、锰1mg。这里标明的各种成分是指()
A.分子 B.原子 C.元素 D.单质 [例2] 下列化学用语中,既可以表示元素,又可以表示这种元素的一个原子,还可以表示由这种元素组成的单质的是()
A.N2 B.Mg C.2O2 D.H
元素符号的意义:表示元素;元素的一个原子。化学式1.定义:用元素符号表示物质组成的式子。A1.下列符号不能表示化学式的是 。
A H B O2 C Fe D NaCl表示一个水分子表示水这种物质表示一个水分子由此2个氢原子和1个氧原子构成表示水由氢元素和氧元素组成一个化学式给你传递了什么信息?CO2一个化学式给你传递了什么信息?一个二氧化碳分子一个二氧化碳分子中有两个氢原子和一个氧原子二氧化碳二氧化碳由碳和氧元素组成熟记常用物质的化学式单质、氧化物、酸、碱、盐?元素的化合价(要求背诵)元素的化合价(要求背诵)一价 K Na Cl Ag H
二价Ca Mg O Ba Zn
三Al 四 Si 五 N P
单质状态都为0化合物中元素化合价的代数和为??标化合价KClO3+5HnRO2n-1 ·+1-2x(+1)× n+x+(-2) ×(2n-1)=0x= +(3n-2)+5-1+7+10HClO4 KClO3 Ca(ClO)2 Cl2 KCl氯元素的化合价由高到低排列的是:KClO3 KCl HClO4 Ca(ClO)2 Cl2结束根据化合价写化学式:根据下列元素(或原子团)在化合物中的化合价:K(+1)、O (-2)、Cl (0)、H (+1)、S (+4)、CO3 (-2)写出下列类别物质的化学式及名称。K2CO3H2CO3Cl2K2OSO2KOHH2SO3K2SO3常见的化学反应①质量守恒定律: 参加化学反应的各物质的质量总和,等于反应
后各物质的质量总和。 例: 在化学反应 A + B ==== C + D 中,已知
15克A与20克B恰好完全反应,生成5克C,
若实际反应时生成了6克D,则参加反应的
B的质量是 克. 4例:在煤气中加入的少量有特殊气味的
乙硫醇(C2H5SH)也可以燃烧,其反应
的化学方程式为:
2C2H5SH + 9O2 == 4CO2+ 2X + 6H2O,
则x的化学式是 。 SO2 ②化学方程式的书写步骤和强化训练。 书写步骤:(1)根据化学反应事实写出反应物和生成物
的化学式(需要时要标上反应条件)
(2)根据质量守恒定律将方程式配平 (3)准确写出“↓”和“↑”符号
练习:写出有二氧化碳生成的化合反应、分解反应、置换反应和复分解反应各一个。燃料及其利用1.燃烧与灭火燃烧的条件:(1)可燃物; (2)氧气(或空气);
(3)达到燃烧所需的最低温度(也叫着火点)灭火原理:(1)清除可燃物或使可燃物与其他物品隔离(釜底抽薪);
(2)隔绝氧气(或空气);
(3)将温度降低到可燃物的着火点以下。 (1)可燃物本身属性;
(2)氧气的浓度;
(3)可燃物与氧气(或空气)的
接触面积。影响燃烧现象的因素:2.燃料的燃烧和对环境的影响化石燃料煤
石油
天然气(主要成分:CH4) 煤燃烧会排放出二氧化硫(SO2)、二氧化氮(NO2)和一氧化碳(CO)等污染物。其中的SO2、NO2等溶于雨水,会形成酸雨。酸雨会对环境造成较大的破坏。煤的燃烧污染:如太阳能、风能、潮汐能、地热、核能、氢能、酒精等,以减少化石燃料的燃烧利用。通常开发新能源有:化学反应中能量的变化通常表现为热量的变化:化学用语小结: 物质的分类物质混合物纯净物化合物单质金属单质 Fe非金属单质C、O2氧化物 MO酸HA稀有气体He依据是:
物质种类依据是:
元素种类盐MA:NaCl、 Na2CO3碱MOH 纯净物和混合物两种多种不同一种同种 空气
(N2、 O2等) 水
(H2O)1、下图是表示气体微粒示意图,图中●和○分别表示两种不同的原子,请根据条件填写答案。想一想、做一做(1)表示纯净物的是 ;
(2)表示混合物的是 ;
(3)表示单质的是 ;
(4)表示化合物的是 。A、CBCA
2.有下列物质:①镁条②液态氧③氯酸钾④冰水混合物
⑤五氧化二磷⑥食盐水⑦氖气⑧空气
将它们的序号填入相应的横线上:
属于混合物的是 ;属于单质是 ;
属于氧化物的是 ;属于化合物的是 。
3.人们常说豆制品中富含蛋白质,菠菜中含丰富的铁质,这里的“铁质”指的是铁 。(用元素、单质、原子、分子回答)⑥ ⑧ ① ② ⑦④ ⑤③ ④ ⑤ 元素识别典型的酸、碱、盐酸:物质的水溶液中的 离子全部是 的化合物;
碱:物质的水溶液中的 离子全部是 的化合物;
盐:由 和 组成的化合物。
常见的酸有 、 、 等;
常见的碱有 、 等;
常见的盐有 、 、 等;知道指示剂的颜色变化C物质的变化(由分子构成的物质)①复分解反应:两种化合物相互交换成分,生成两种新的化合物的反应。AB+ CD = AC+ CB
发生条件:两种物质在溶液中相互交换离子,若生成沉淀,或气体,或水,那么复分解反应就可以发生。
②置换反应:a+bc==b+ac
在溶液中,一种活泼性较强的金属,能将活泼性较弱的金属(或H)从它们的盐(或酸)溶液中置换出来。
A、盐1+金属1=盐2+金属2
B、酸+金属=盐+氢气
发生条件:活动性强的置换活动性弱的
附加条件:盐要可溶于水
③化合反应: A+B=AB
④分解反应: AB=A+B水的电解H2O通电H2 + O2氧化汞的分解结论:化学变化中旧分子分解为原子,原子重新组合,生成新的分子。
也就是在化学变化中分子可分,而原子不可分。旧分子新分子用分子的观点解释一下水的电解与水的蒸发有什么不同呢?水蒸发水电解分子不变分子改变讨论下图中同种符号表示同种分子,则A→B属于 变化,
C →D属于 变化。物理化学酸与活泼金属反应酸 + 氢前金属 = 盐 + 氢气 (注意条件) 酸与金属氧化物反应酸与碱反应酸与盐反应小测 1.判断某原子属于何种元素的依据是( )
A.电子数 B.质子数 C.相对原子质量 D.化学性质
2. 二氧化碳、氧化镁、氧气中都含有的是( )
A.氧气 B.氧原子 C.氧元素 D.氧分子
3.水是由 和 组成的;一个水分子是由
和 构成的。
4.铁矿石、钢铁、铁锈中都含有铁 。
5.二氧化碳是由 构成的;汞是由 构成的。BC氢元素氧元素两个氢原子一个氧原子元素二氧化碳分子汞原子动脑筋1.化学谜语(各打一元素)2.用大写字母A、B和小写字母a、g、r可以写成的元素有 。铁钾金Ag、Ar、Ba、Br汞溶液部分的知识1、溶液的概念;溶质、溶剂、溶液之关系。 2、饱和溶液与不饱和溶液的有关知识: 3、溶解度概念; 溶解度曲线;
区分溶解度和溶解性。 4、溶质质量分数的概念及计算 5、溶液的配制 1、溶液的概念;溶质、溶剂、溶液之关系。
溶液的概念 一种或几种物质分散到另一种物质里,
形成均一的、稳定的混合物,叫做溶液溶液的组成及关系溶液溶液质量 = 溶质质量 + 溶剂质量
(溶剂不指明时,一般指水溶液) 例:食盐溶液:溶质是食盐,溶剂是水。硫酸锌溶液:溶质是硫酸锌,溶剂是水。碘酒溶液:溶质是碘,溶剂是酒精。训练水硫酸铜水氯化氢碳酸钠水氯化铁水酒精水碘酒精1、溶液一定是 ( )
A:一种固体溶解在一种液体里形成的。
B:均一、稳定、无色、透明的。
C:固态物质溶于水形成的。
D:至少由两种物质组成的均一的稳定的混合物D2、关于溶液的特征。下列叙述不正确的是( )
A:溶液一定是无色的液体。
B:溶液一定是混合物
C:当外界条件不变时,只要溶剂不减少,温度不变
化,不管放置多久溶质不会从溶液中分离出来。
D:溶液形成后,溶液中各部分的性质相同,浓稀一样。A2、饱和溶液与不饱和溶液的有关知识 ①概念一定温度下,在一定量的溶剂里,不能再溶解
某种溶质的溶液叫做饱和溶液。
还能再溶解某种溶质的溶液叫做不饱和溶液②识别: 一般的说,要确定某一溶液是否饱和,只要看在
一定 温度下,有没有不能继续溶解的剩余溶质存在,
如有就为饱和溶液。例:(2005年深圳升中考化学试题)
A、B、C三烧杯中分别装有等质量的水,在相同
的温度下,向A、B、C烧杯杯分别加入25g、15 g、
5 g某固体溶质,充分溶解后,静置,现象如下图:
回答下列问题(填编号)
CBAABC3、溶解度概念;溶解度曲线;区分溶解度和溶解性。 (1)区分溶解度和溶解性 根据溶解度大小分:易溶、可溶、微溶、难溶。 (2)溶解度概念:
定义:一定温度下,某固态物质在100克溶剂里
达到饱和状态时所溶解的质量。 意义:例:20℃时,氯酸钾的溶解度为7.4克。 表示:20℃时,100克水溶解了7.4克氯酸钾达到饱和。 训练:20℃时,50克水溶解18克食盐达到饱和,
问20℃时,食盐的溶解度是: 。
36克(3)溶解度曲线: ①制作曲线 :实验测定硝酸钾溶解度数据如下:
0 ℃ 10 ℃ 20 ℃ 30 ℃ 40 ℃ 50 ℃ 60 ℃ 70 ℃
13.3 g 20.9 g 31.6 g 45.8 g 63.9 g 85.5 g 110 g 138 g
根据以上实验数据作出溶解度曲线: ②会看曲线:100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的交点表示什么意义? 练习:2、
40℃时氯化铵的溶解度为______,
70℃时氯化铵的溶解度为______。
70℃时氯化钾的溶解度为____。47g44g60gA.0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃熟石灰的溶解度曲线:溶解度曲线一般规律: 大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。 少数固体物质溶解度受温度影响不大, 例如食盐。 极少数固体物质溶解度随温度 升高反而减小,例如熟石灰。甲乙丙B温度(℃)溶解度
(g)T1 T2(1)T2时,溶解度最大的是________;(2)B点代表的含义是
___________________________________;(3)T1时的甲溶液升温到T2,甲溶液变成
______________. 甲T1℃时,甲、丙两种物质的溶解度相等不饱和溶液想一想:[讨论] 天气闷热时,鱼儿为什么总爱在水面上进行呼吸?气体的溶解度随温度的增加而减小.随压强的减小而减小
4、溶液质量分数的概念计算溶质的质量分数 = 溶质质量(克) ×100%
溶液质量(克)
例1、配制150Kg质量分数为16%食盐溶液,
需要食盐和水多少Kg?解:食盐质量=150 Kg×16% = 24 Kg
水的质量=150 Kg – 24 Kg = 126 Kg
答:需要食盐24 Kg,水126 Kg.
** 例2:20℃时,食盐的溶解度为36克,
(1)计算此温度下饱和食盐水的食盐的质量分数?(2)能否配制出20℃溶质质量分数为30%的食盐水?不能答:食盐水中食盐的质量分数是26.5%。**例3、把100克63%的HNO3溶液稀释成10%
硝酸溶液, 需要加水多少克?解:设需要加水的质量为X
100g×63% = (100g+X)×10%X = 530g
答:需要加水530克.例4:配制50克5%的氯化钠溶液。(1)计算:需要称取食盐 克,
量取水 毫升。2.547.5(2)称量(3)溶解5、溶液的配制溶液的配制过程3、根据化学式的计算3.碳酸钙(化学式为CaCO3)是石灰石、大理石的主要成分,它不仅是一种建筑装饰材料,还是一种很好的补钙药品。
(1) CaCO3的相对分子质量为 。
(2)CaCO3中钙、碳、氧元素的质量比为 (最简整数比)
(3)CaCO3中钙元素的质量分数为 。
10010:3:1240%(1)求相对分子质量(2)求各元素的质量比(3)求各元素的质量分数
