浙教版九年级上第一章第二节探索酸的性质(第三课时)(浙江省嘉兴市秀城区)
文档属性
| 名称 | 浙教版九年级上第一章第二节探索酸的性质(第三课时)(浙江省嘉兴市秀城区) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2007-09-09 00:00:00 | ||
图片预览






文档简介
课件18张PPT。 第二节 探索酸的性质
第三课时复习:盐酸的化学性质跟指示剂的反应
跟金属的反应
跟金属氧化物的反应
跟碱的反应
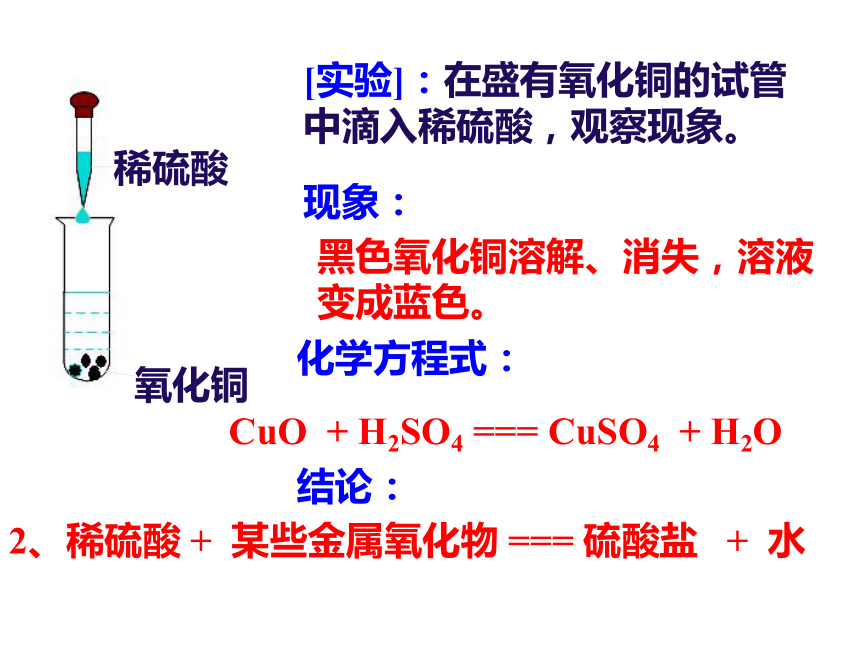
跟硝酸银的反应思考:我们已经研究了盐酸的化学性质,其他酸是否有相似的性质呢?那么我们以硫酸为代表来研究这一问题。稀硫酸酸性实验锌粒稀硫酸[实验]:在盛锌的试管中滴入稀硫酸,观察现象。现象:化学方程式:结论:锌粒表面产生大量气泡。Zn + H2SO4 === ZnSO4 + H2↑1、稀硫酸 + 某些金属 === 硫酸盐 + 氢气氧化铁稀硫酸[实验]在盛氧化铁的试管中滴入稀硫酸,观察现象。现象:化学方程式:结论:红色氧化铁溶解,溶液变黄色。Fe2O3 + 3 H2SO4 === Fe2(SO4)3 +3 H2O 2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水现象:化学方程式:结论:[实验]:在盛有氧化铜的试管中滴入稀硫酸,观察现象。稀硫酸氧化铜黑色氧化铜溶解、消失,溶液变成蓝色。CuO + H2SO4 === CuSO4 + H2O2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水现象:化学方程式:结论:稀硫酸氢氧化铜[实验]在盛有氢氧化铜的试管中滴入稀硫酸,观察现象。蓝色氢氧化铜溶解,溶液变成蓝色。Cu(OH)2 + H2SO4 === CuSO4 +2 H2O稀硫酸 + 碱 === 硫酸盐 + 水稀硫酸氯化钡[实验]:在盛有稀硫酸中滴入无色氯化钡溶液,观察现象。现象:化学方程式:结论:产生白色沉淀。BaCl2 + H2SO4 === BaSO4 ↓ + 2HCl硫酸 + 某些盐 === 硫酸盐 + 另一种酸SO42—的检验方法:滴加氯化钡溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。总结:硫酸有哪些性质?1.稀硫酸 + 某些金属 === 硫酸盐 + 氢气Zn + H2SO4 = ZnSO4 + H2 ↑ 2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水 CuO + H2SO4 =CuSO4+ H2 O Fe2O3 + H2SO4= Fe2(SO4)3+ H2 O
4、稀硫酸 + 某些盐 === 硫酸盐 + 另一种酸 BaCI2 + H2SO4 = BaSO4 ↓+ 2HCISO42—的检验方法:滴加氯化钡溶液出现白色沉淀.3、稀硫酸 + 碱 === 硫酸盐 + 水 Cu(OH)2 + H2SO4 = CuSO4 + H2 O小结:硫酸的化学性质 跟指示剂的反应
跟金属的反应
跟金属氧化物的反应
跟碱的反应
跟氯化钡的反应使紫色石蕊变红,无色酚酞不变色 请你通过盐酸、硫酸的化学性质归纳出酸有哪些共性(通性).1、酸能使紫色的石蕊变红,无色
酚酞不变色。4、酸 + 碱 = 盐 + 水 5、酸 + 盐 =新盐 + 新酸3、酸 +金属氧化物= 盐 + 水2、酸+金属 = 盐 + 氢气利用酸的性质做些什么思考证据性质用途1、除锈:在用稀盐酸除铁锈时,酸不能太多,且放置时间也不能太长,不然稀盐酸会继续跟铁反应。2、制取氢气:实验室中可用稀盐酸或稀硫酸 来制取氢气。用途是一种非常重要的化工原料
用于金属表面的除锈
用于生产化肥、农药、火药、染料[练习]1.铝、镁、与锌、铁一样都能与稀盐酸、稀硫酸反应产生氢气,分别写出铝、镁与稀盐酸、稀硫酸反应的化学方程式。2·下列物质中不能跟稀硫酸反应的是( )A· 铁 B· 氧化镁 C·二氧化碳 D·碳酸钠。C3·下列物质不属于稀盐酸的用途的是( )A·实验室制取氢气, B·实验室制取二氧化碳C·工业除锈 D·制食盐(氯化钠)D5、下列物质中,能除去铁制品表面铁锈的是( ) A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液 6、写出下列方程式
(1)Fe+H2SO4 == ;________
(2)CuO+H2SO4== ;________
(3)2NaOH+H2SO4== ;_______
(4)H2SO4+BaCl2== ; _______
(5)HCl+AgNO3== ;________ 小结:酸有哪些共同的化学性质?酸
①能使紫色石蕊试液变_______
②能与碱反应,生成_____和_______
③能与某些金属氧化物反应,生成____和___
④能与某些金属反应,生成_____和_____
⑤能与某些盐反应,生成______和______
跟金属的反应
跟金属氧化物的反应
跟碱的反应
跟硝酸银的反应思考:我们已经研究了盐酸的化学性质,其他酸是否有相似的性质呢?那么我们以硫酸为代表来研究这一问题。稀硫酸酸性实验锌粒稀硫酸[实验]:在盛锌的试管中滴入稀硫酸,观察现象。现象:化学方程式:结论:锌粒表面产生大量气泡。Zn + H2SO4 === ZnSO4 + H2↑1、稀硫酸 + 某些金属 === 硫酸盐 + 氢气氧化铁稀硫酸[实验]在盛氧化铁的试管中滴入稀硫酸,观察现象。现象:化学方程式:结论:红色氧化铁溶解,溶液变黄色。Fe2O3 + 3 H2SO4 === Fe2(SO4)3 +3 H2O 2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水现象:化学方程式:结论:[实验]:在盛有氧化铜的试管中滴入稀硫酸,观察现象。稀硫酸氧化铜黑色氧化铜溶解、消失,溶液变成蓝色。CuO + H2SO4 === CuSO4 + H2O2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水现象:化学方程式:结论:稀硫酸氢氧化铜[实验]在盛有氢氧化铜的试管中滴入稀硫酸,观察现象。蓝色氢氧化铜溶解,溶液变成蓝色。Cu(OH)2 + H2SO4 === CuSO4 +2 H2O稀硫酸 + 碱 === 硫酸盐 + 水稀硫酸氯化钡[实验]:在盛有稀硫酸中滴入无色氯化钡溶液,观察现象。现象:化学方程式:结论:产生白色沉淀。BaCl2 + H2SO4 === BaSO4 ↓ + 2HCl硫酸 + 某些盐 === 硫酸盐 + 另一种酸SO42—的检验方法:滴加氯化钡溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。总结:硫酸有哪些性质?1.稀硫酸 + 某些金属 === 硫酸盐 + 氢气Zn + H2SO4 = ZnSO4 + H2 ↑ 2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水 CuO + H2SO4 =CuSO4+ H2 O Fe2O3 + H2SO4= Fe2(SO4)3+ H2 O
4、稀硫酸 + 某些盐 === 硫酸盐 + 另一种酸 BaCI2 + H2SO4 = BaSO4 ↓+ 2HCISO42—的检验方法:滴加氯化钡溶液出现白色沉淀.3、稀硫酸 + 碱 === 硫酸盐 + 水 Cu(OH)2 + H2SO4 = CuSO4 + H2 O小结:硫酸的化学性质 跟指示剂的反应
跟金属的反应
跟金属氧化物的反应
跟碱的反应
跟氯化钡的反应使紫色石蕊变红,无色酚酞不变色 请你通过盐酸、硫酸的化学性质归纳出酸有哪些共性(通性).1、酸能使紫色的石蕊变红,无色
酚酞不变色。4、酸 + 碱 = 盐 + 水 5、酸 + 盐 =新盐 + 新酸3、酸 +金属氧化物= 盐 + 水2、酸+金属 = 盐 + 氢气利用酸的性质做些什么思考证据性质用途1、除锈:在用稀盐酸除铁锈时,酸不能太多,且放置时间也不能太长,不然稀盐酸会继续跟铁反应。2、制取氢气:实验室中可用稀盐酸或稀硫酸 来制取氢气。用途是一种非常重要的化工原料
用于金属表面的除锈
用于生产化肥、农药、火药、染料[练习]1.铝、镁、与锌、铁一样都能与稀盐酸、稀硫酸反应产生氢气,分别写出铝、镁与稀盐酸、稀硫酸反应的化学方程式。2·下列物质中不能跟稀硫酸反应的是( )A· 铁 B· 氧化镁 C·二氧化碳 D·碳酸钠。C3·下列物质不属于稀盐酸的用途的是( )A·实验室制取氢气, B·实验室制取二氧化碳C·工业除锈 D·制食盐(氯化钠)D5、下列物质中,能除去铁制品表面铁锈的是( ) A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液 6、写出下列方程式
(1)Fe+H2SO4 == ;________
(2)CuO+H2SO4== ;________
(3)2NaOH+H2SO4== ;_______
(4)H2SO4+BaCl2== ; _______
(5)HCl+AgNO3== ;________ 小结:酸有哪些共同的化学性质?酸
①能使紫色石蕊试液变_______
②能与碱反应,生成_____和_______
③能与某些金属氧化物反应,生成____和___
④能与某些金属反应,生成_____和_____
⑤能与某些盐反应,生成______和______
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
