浙教版 九年级上 第一章第4节 几种重要的盐(第三、四课时)(浙江省嘉兴市秀城区)
文档属性
| 名称 | 浙教版 九年级上 第一章第4节 几种重要的盐(第三、四课时)(浙江省嘉兴市秀城区) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2007-09-21 00:00:00 | ||
图片预览







文档简介
课件28张PPT。几种重要的盐(第四课时)常见的盐2一、盐的制取1.盐的溶解性(1).根据盐的溶解性的不同可将盐分为
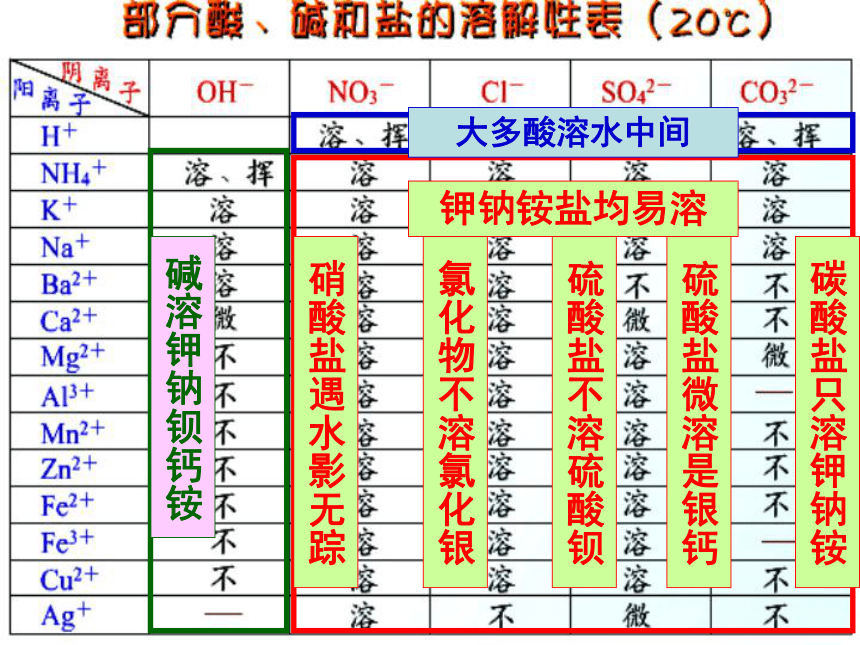
_________盐和_______盐。(2).常见盐的溶解性表:可溶性不溶性碱溶钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙记忆规律: 可溶性盐:钾盐(含K+)、钠盐(含Na+)大部分碳酸盐如CaCO3、BaCO3、MgCO3等铵盐(含NH4+)、硝酸盐(含NO3-)硫酸钡BaSO4、 氯化银AgCI不可溶性盐:不溶性碱:如Fe(OH)3、Cu(OH)2、Mg(OH)2等可溶性碱:KOH 、NaOH 、Ba(OH)2
Ca(OH)2 、NH3.H2O钾钠铵硝溶,硫酸不溶钡,BaSO4( CaSO4 、Ag2SO4微溶)盐酸不溶银,AgCl其它盐类都不溶 (碳酸盐、磷酸盐中除钾盐、钠盐、铵盐外,其余都不溶)溶碱有四种:铵钾钠和钡.
NH3.H20 、 K0H、Na0H、 Ba(0H) 2溶解性口诀
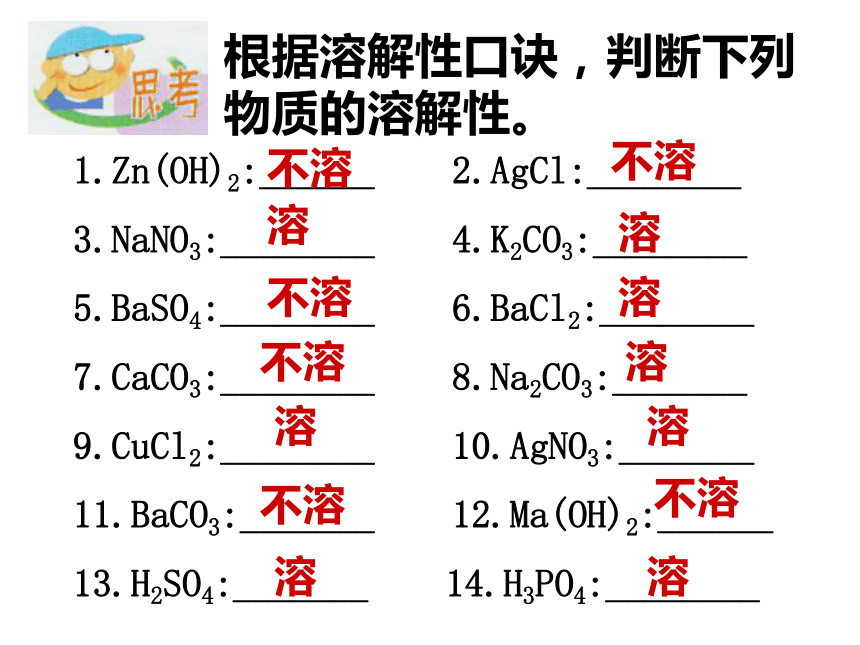
根据溶解性口诀,判断下列物质的溶解性。1.Zn(OH)2:______ 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ma(OH)2:______
13.H2SO4:_______ 14.H3PO4:________不溶不溶不溶不溶不溶不溶溶溶溶溶溶溶溶溶 根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?2.盐的制取(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。侯氏联合制碱法 向浓氨水中通入足量的二氧化碳生成碳铵,再加入食盐粉未充分搅拌,由于碳酸氢钠在该状态下的溶解度较其他物质要少得多,便呈晶体析出;最后将析出的碳酸氢钠加热便制得了纯碱;请写出该过程的化学方程式并注明反应类型;指出该过程中反应的起始原料和最终产物.侯德榜 1、酸+金属=盐+氢气 (2)制取盐的化学途经:7、盐+盐=新盐+新盐8、金属+盐=新金属+新盐(下节学习) 6、碱+非金属氧化物=盐+水 5、碱+盐=新碱+新盐 4、酸+盐=新酸+新盐3、酸+碱=盐+水2、酸+金属氧化物=盐+水制硝酸钡:1、酸+碱2、酸+盐4、盐+盐3、碱+盐HNO3 +Ba(OH)2HNO3 +Ba CO3Ba(OH)2 + Cu(NO3 )2Ba Cl 2 + Ag NO3 碳酸钠与氯化钙反应原理分析:Na2CO3溶液中含有离子2Na+CO32-CaCl2溶液中含有离子Ca2+2Cl—Na2CO3+CaCl2 = CaCO3↓+ 2NaCl2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-为什么KNO3和NaCl不发生复分解反应?KNO3溶液中含有离子K+NO3- NaCl溶液中含有离子Na+Cl-K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl- 复分解反应及发生条件 AB + CD = AD + CB(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间(2)反应进行的环境:大多数在水溶液中进行生成沉
淀或气
体或水盐可以不溶
酸应是强酸碱可以不溶金氧可以不溶 两者均可溶 两者均可溶复分解反应口诀:
复分解,两头顾;
先顾头,后顾尾;
顾头要看溶解性,
盐碱盐盐均可溶;
可以反应再顾尾,
产生气体沉淀水;
交换离子写反应,
气体沉淀标符号。 思考1:农作物正常生长发育和开花结果需要哪些外界条件? 充足的光照.水分.空气.适宜的温度.无机盐等(营养元素)做养料.思考2:主要是需要哪几种营养元素作养料?N、P、KN.P.K养料的来源:
1.有些来自于自然界的一些物质:土壤中的矿物质.动物的粪便.草木灰等.
2.有些来自于人工合成:如化学肥料(化肥).化肥:用矿物.空气.水等做原料,经过化学加工精制而成,能为农作物的生长提供养料的一些盐,称为化学肥料,简称为“化肥”.“庄稼一枝花,全靠肥当家”2.化肥的类型:写一写:写出只含有N或P或K元素的盐;
写出既含有N元素又含有K元素的盐;
写出既含有P元素又含有K元素的盐;
写出既含有N元素又含有P元素的盐。氮肥磷肥钾肥复合肥料(NH4)2SO4NH4HCO3NaNO3NH4ClCa(H2PO4)2k3PO4K2SO4KCl
K2CO3
kNO3
(NH4)3PO4
NH4NO3
请把对应的化肥类型的线条连起来:植株矮小,叶色发黄植株暗绿带红,只开花不结果茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯NH4+.NO3-
尿素CO(NH2)2过磷酸钙[CaSO4和Ca(H2PO4)2混合物]含K+的盐如:草木灰K2CO3能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素植株矮小,叶色发黄能促使农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多.籽粒饱满植株暗绿带红,只开花不结果能促使农作物生长旺盛,茎秆粗壮,增强抗病虫害能力,促进糖和淀粉生成茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯三种化肥的比较:尿素:是一种含氮有机物,人的尿液中就含有,它在微生物的作用下会转变为铵盐或氨气.施肥原则:
以农家肥为主,化肥为辅. 使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥),有利于该良土壤结构,提高土壤肥力。思考:经常使用化肥有哪些利弊?(1)向硫酸铵浓溶液中滴加氢氧化钠溶液,观察到什么现象?(2)把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化 ,变化的原因是什么? 产生大量的气泡,产生的气体具有刺激性气味的气体变蓝NH3溶于水后形成的氨水溶液呈碱性(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3↑5.铵盐的性质:(3)铵盐的性质:铵盐能与碱反应,生成氨气如:NH4Cl + KOH==KCl + H2O + NH3↑NH4HCO3+Ca(OH)2=CaCO3↓+2H2O+NH3↑ 思考: 在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?注意:使用铵盐作肥料时,不能跟熟石灰等碱混合施用,因为反应放出氨气而失效.铵盐与氢氧化钙混合加热后,有氨气放出 (4)检验NH4+的方法:加NaOH等碱溶液,如果产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,则含有NH4+.(5)工业制法:酸与氨气反应制得2NH3+H2SO4=(NH4)2SO4(硫铵)NH3+H2O+CO2=NH4HCO3(碳铵)盐的组成中:
阳离子不一定
是金属阳离子
(可能NH4+)课堂练习1.下列属于复合肥的是( )
A.KH2PO4 B.K2CO3 C.NH4NO3 D.KNO32.草木灰是农家肥料,其主要成分是碳酸钾,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥3.尿素CO(NH2)2是一种高效化肥,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料ADCA4.PH>7的土壤中能否施加NH4HCO3?为什么?1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )
A.反应物的溶解性
B.生成物中有无气体.沉淀和水
C.反应物中有无酸碱盐
D.金属活动性强弱2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?3.下列各组在溶液中能大量共存的是( )
A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2
C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaClD难以形成沉淀.气体或水D4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( )
A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠5.下列各组物质的溶液,不能发生复分解反应是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4? C.AgNO3和BaCl2 D.KCl和CuSO46.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。CDK2CO3MgCl2.CuSO4.
AgCl.BaSO4再见
_________盐和_______盐。(2).常见盐的溶解性表:可溶性不溶性碱溶钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙记忆规律: 可溶性盐:钾盐(含K+)、钠盐(含Na+)大部分碳酸盐如CaCO3、BaCO3、MgCO3等铵盐(含NH4+)、硝酸盐(含NO3-)硫酸钡BaSO4、 氯化银AgCI不可溶性盐:不溶性碱:如Fe(OH)3、Cu(OH)2、Mg(OH)2等可溶性碱:KOH 、NaOH 、Ba(OH)2
Ca(OH)2 、NH3.H2O钾钠铵硝溶,硫酸不溶钡,BaSO4( CaSO4 、Ag2SO4微溶)盐酸不溶银,AgCl其它盐类都不溶 (碳酸盐、磷酸盐中除钾盐、钠盐、铵盐外,其余都不溶)溶碱有四种:铵钾钠和钡.
NH3.H20 、 K0H、Na0H、 Ba(0H) 2溶解性口诀
根据溶解性口诀,判断下列物质的溶解性。1.Zn(OH)2:______ 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ma(OH)2:______
13.H2SO4:_______ 14.H3PO4:________不溶不溶不溶不溶不溶不溶溶溶溶溶溶溶溶溶 根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?2.盐的制取(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。侯氏联合制碱法 向浓氨水中通入足量的二氧化碳生成碳铵,再加入食盐粉未充分搅拌,由于碳酸氢钠在该状态下的溶解度较其他物质要少得多,便呈晶体析出;最后将析出的碳酸氢钠加热便制得了纯碱;请写出该过程的化学方程式并注明反应类型;指出该过程中反应的起始原料和最终产物.侯德榜 1、酸+金属=盐+氢气 (2)制取盐的化学途经:7、盐+盐=新盐+新盐8、金属+盐=新金属+新盐(下节学习) 6、碱+非金属氧化物=盐+水 5、碱+盐=新碱+新盐 4、酸+盐=新酸+新盐3、酸+碱=盐+水2、酸+金属氧化物=盐+水制硝酸钡:1、酸+碱2、酸+盐4、盐+盐3、碱+盐HNO3 +Ba(OH)2HNO3 +Ba CO3Ba(OH)2 + Cu(NO3 )2Ba Cl 2 + Ag NO3 碳酸钠与氯化钙反应原理分析:Na2CO3溶液中含有离子2Na+CO32-CaCl2溶液中含有离子Ca2+2Cl—Na2CO3+CaCl2 = CaCO3↓+ 2NaCl2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-为什么KNO3和NaCl不发生复分解反应?KNO3溶液中含有离子K+NO3- NaCl溶液中含有离子Na+Cl-K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl- 复分解反应及发生条件 AB + CD = AD + CB(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间(2)反应进行的环境:大多数在水溶液中进行生成沉
淀或气
体或水盐可以不溶
酸应是强酸碱可以不溶金氧可以不溶 两者均可溶 两者均可溶复分解反应口诀:
复分解,两头顾;
先顾头,后顾尾;
顾头要看溶解性,
盐碱盐盐均可溶;
可以反应再顾尾,
产生气体沉淀水;
交换离子写反应,
气体沉淀标符号。 思考1:农作物正常生长发育和开花结果需要哪些外界条件? 充足的光照.水分.空气.适宜的温度.无机盐等(营养元素)做养料.思考2:主要是需要哪几种营养元素作养料?N、P、KN.P.K养料的来源:
1.有些来自于自然界的一些物质:土壤中的矿物质.动物的粪便.草木灰等.
2.有些来自于人工合成:如化学肥料(化肥).化肥:用矿物.空气.水等做原料,经过化学加工精制而成,能为农作物的生长提供养料的一些盐,称为化学肥料,简称为“化肥”.“庄稼一枝花,全靠肥当家”2.化肥的类型:写一写:写出只含有N或P或K元素的盐;
写出既含有N元素又含有K元素的盐;
写出既含有P元素又含有K元素的盐;
写出既含有N元素又含有P元素的盐。氮肥磷肥钾肥复合肥料(NH4)2SO4NH4HCO3NaNO3NH4ClCa(H2PO4)2k3PO4K2SO4KCl
K2CO3
kNO3
(NH4)3PO4
NH4NO3
请把对应的化肥类型的线条连起来:植株矮小,叶色发黄植株暗绿带红,只开花不结果茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯NH4+.NO3-
尿素CO(NH2)2过磷酸钙[CaSO4和Ca(H2PO4)2混合物]含K+的盐如:草木灰K2CO3能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素植株矮小,叶色发黄能促使农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多.籽粒饱满植株暗绿带红,只开花不结果能促使农作物生长旺盛,茎秆粗壮,增强抗病虫害能力,促进糖和淀粉生成茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯三种化肥的比较:尿素:是一种含氮有机物,人的尿液中就含有,它在微生物的作用下会转变为铵盐或氨气.施肥原则:
以农家肥为主,化肥为辅. 使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥),有利于该良土壤结构,提高土壤肥力。思考:经常使用化肥有哪些利弊?(1)向硫酸铵浓溶液中滴加氢氧化钠溶液,观察到什么现象?(2)把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化 ,变化的原因是什么? 产生大量的气泡,产生的气体具有刺激性气味的气体变蓝NH3溶于水后形成的氨水溶液呈碱性(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3↑5.铵盐的性质:(3)铵盐的性质:铵盐能与碱反应,生成氨气如:NH4Cl + KOH==KCl + H2O + NH3↑NH4HCO3+Ca(OH)2=CaCO3↓+2H2O+NH3↑ 思考: 在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?注意:使用铵盐作肥料时,不能跟熟石灰等碱混合施用,因为反应放出氨气而失效.铵盐与氢氧化钙混合加热后,有氨气放出 (4)检验NH4+的方法:加NaOH等碱溶液,如果产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,则含有NH4+.(5)工业制法:酸与氨气反应制得2NH3+H2SO4=(NH4)2SO4(硫铵)NH3+H2O+CO2=NH4HCO3(碳铵)盐的组成中:
阳离子不一定
是金属阳离子
(可能NH4+)课堂练习1.下列属于复合肥的是( )
A.KH2PO4 B.K2CO3 C.NH4NO3 D.KNO32.草木灰是农家肥料,其主要成分是碳酸钾,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥3.尿素CO(NH2)2是一种高效化肥,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料ADCA4.PH>7的土壤中能否施加NH4HCO3?为什么?1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )
A.反应物的溶解性
B.生成物中有无气体.沉淀和水
C.反应物中有无酸碱盐
D.金属活动性强弱2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?3.下列各组在溶液中能大量共存的是( )
A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2
C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaClD难以形成沉淀.气体或水D4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( )
A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠5.下列各组物质的溶液,不能发生复分解反应是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4? C.AgNO3和BaCl2 D.KCl和CuSO46.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。CDK2CO3MgCl2.CuSO4.
AgCl.BaSO4再见
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
