氧化还原离子方程式的书写训练
文档属性
| 名称 | 氧化还原离子方程式的书写训练 |  | |
| 格式 | zip | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-02-04 13:40:25 | ||
图片预览








文档简介
课件20张PPT。离子反应
—氧化还原离子方程式的书写训练下列各组中的离子,能在溶液中大量共存的是( )
A.Fe2+、H+、C1- 、 MnO4 -
B.Na+、Ba2+、CO32 - 、NO3 -
C.Na+、H+、Cl-、CO32-
D.K+、Cu2+、 NO3 - 、SO42 - D一、分类:
(1)复分解反应类型离子反应
(2)氧化还原类型离子反应 三、离子共存四、离子方程式的书写:拆分原则一样离子反应二、离子反应发生条件
(1)复分解反应型:生成沉淀,气体,(弱酸、弱碱、水等)弱电解质(2)氧化还原型:发生氧化还原反应可拆物质:强酸、强碱、可溶盐
不拆物质:沉淀、气体、弱电解质、氧化物、
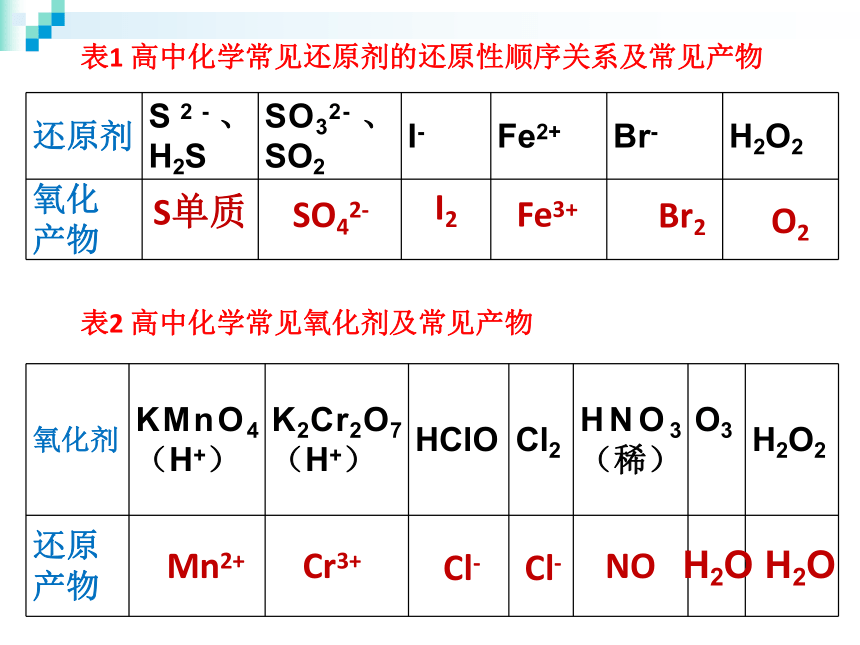
单质、非电解质表1 高中化学常见还原剂的还原性顺序关系及常见产物表2 高中化学常见氧化剂及常见产物S单质SO42-I2Fe3+Br2O2Mn2+Cr3+Cl-Cl-NOH2OH2O例题1:向酸性高锰酸钾溶液中,加入一定量的H2O2,生成Mn2+,写出该反应的离子方程式。一、善用升降观/得失观判断产物MnO4-+H2O2 →Mn2++O2↑MnO4- + H2O2 → Mn2+ + ?-1+7+2例题1:向酸性高锰酸钾溶液中,加入一定量的H2O2,生成Mn2+,写出该反应的离子方程式。二、善用守恒观来配平离子方程式
得失电子守恒,电荷守恒,原子守恒
电荷不够,酸、碱来凑,还不平就补水。
MnO4-+H2O2 →Mn2++O2↑-1+7+202 MnO4- + 5 H2O2 +6H+ = 2Mn2++5O2↑+ 8H2O一、善用升降观/得失观判断产物例题2:在碱性溶液中,用氯气可将NH4+氧化,生成一种可直接排放到大气中的气体,写出离子方程式。Cl2 + NH4+ → N2 + Cl-二、善用守恒观来配平离子方程式3Cl2 + 2NH4+ + 8OH- = N2 + 6Cl- + 8H2O 得失电子守恒,电荷守恒,原子守恒
电荷不够,酸、碱来凑,还不平就补水。
找产物看升降/得失平电荷配系数基本原则及步骤判断好反应物和产物用电子得失守恒确定已知离子的系数根据电荷守恒补充缺少的离子(补H+ 或OH-)根据原子守恒配平(补水?)氧化还原离子方程式的书写练习1:向酸性高锰酸钾溶液中,通入一定量的SO2气体,生成Mn2+,写出该反应的离子方程式。一、善用升降观/得失观判断产物2MnO4- +5SO2 +2H2O = 2Mn2++ 5SO42-+4H+ 二、善用守恒观来配平离子方程式3、向二氧化铈(CeO2)固体中加稀硫酸和 H2O2,所得溶液中含有Ce3+,写出反应的离子方程式。2、ClO-碱性条件下与SO2反应2CeO2+H2O2+6H+= 2Ce3++O2↑+4H2OClO-+SO2+2OH-= SO42-+Cl-+H2O4【2016全国(Ⅰ)27】(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72?还原成Cr3+,反应的离子方程式为 Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O练习练习5:二氧化氯(ClO2黄绿色易溶于水的气体)是一种高效低毒的消毒剂。测定混合气中ClO2的含量的过程中,往溶有该气体的锥形瓶中加入足量的碘化钾,再加入足量稀硫酸,滴入几滴淀粉溶液,溶液变蓝色。写出锥形瓶内ClO2与碘化钾反应的离子方程式。
为什么产物不是Cl2?抑或是HClO?Cl2+2I-=2Cl-+I2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O
找产物看升降/得失平电荷配系数基本原则及步骤判断好反应物和产物用电子得失守恒确定已知离子的系数根据电荷守恒补充缺少的离子(补H+ 或OH-)根据原子守恒配平(补水?)氧化还原离子方程式的书写总结:1、写出Cl2与以下物质或离子的反应:Br-、Fe2+、 I-、SO2、SO32-、S2-
2、写出H2O2(H+)与以下物质或离子的反应:Br-、Fe2+、I-、SO2、SO32-、S2-
3、写出Fe3+与以下物质或离子的反应:I-、SO2、SO32-、S2-、Cu、Fe
4、写出ClO-酸性条件下与Fe2+反应;ClO-碱性条件下与I-反应;ClO-酸性条件下与SO2反应
5、KMnO4(H+)与以下溶液反应:浓盐酸、草酸(H2C2O4)、双氧水、Na2SO3
写出以下反应离子方程式:提高篇 H2O2+2Br-+2H+= Br2+2H2O
H2O2+ 2Fe2+ +2H+ = 2Fe3+ +2H2O
H2O2+ 2I- +2H+ = I2+2H2O
H2O2+ SO2 =SO42- + H2O+2H+
H2O2+SO32﹣= SO42﹣+H2O
H2O2+S2-+2H+ = S↓ + 2H2O Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
Cl2 + 2I- = I2 + 2Cl-
Cl2 + SO2+2H2O = SO42﹣ + 2Cl- +4H+
Cl2 + SO32- + H2O = SO42﹣ + 2Cl- +2H+
Cl2 + S2- = S↓ + 2Cl- 1、写出Cl2与以下物质或离子的反应:Br-、Fe2+、 I-、SO2、SO32-、S2-2、写出H2O2(H+)与以下物质或离子的反应:Br-、
Fe2+、I-、SO2、SO32-、S2-3、写出Fe3+与以下物质或离子的反应:I-、SO2、
SO32-、S2-、Cu、Fe2 Fe3+ +2I- = 2Fe2+ + I2
2 Fe3+ +SO2 + 2H2O = 2Fe2+ + SO42- + 4H+
2Fe3+ + SO32- +H2O = 2Fe2+ + SO42- + 2H+
2Fe3+ + S2- = 2Fe2+ + S↓
2Fe3+ + Cu = 2Fe2+ + Cu2+
2Fe3+ + Fe= 3Fe2+ 4、写出ClO-酸性条件下与Fe2+反应;ClO-碱性条件下
与I-反应;ClO-酸性条件下与SO2反应ClO- + 2Fe2++ 2H+= Cl- +2Fe3+ +H2O
ClO- + 2I- + H2O = Cl- +I2 + 2OH-
ClO- + SO2+ H2O = Cl- +SO42- +2H+5、KMnO4(H+)与以下溶液反应:浓盐酸、
草酸(H2C2O4)、双氧水、Na2SO3
2MnO4- + 10Cl- +16H+ = 2Mn2++ 5Cl2↑+ 8H2O
2MnO4-+5H2C2O4 +6H+ = 2Mn2++10CO2↑+ 8H2O
2MnO4-+ 5H2O2+6H+= 2Mn2+ +5O2↑+ 8H2O
2MnO4-+ 5SO32- +6H+ = 2Mn2++ 5SO42- + 3H2O 找产物看升降/得失平电荷配系数氧化还原反应分类观守恒观Cr2O72-+S2O32-+H+→Cr3++SO42-+H2OI-+ IO3- +H+→ I2 + H2OCl2 + OH-→ Cl- + ClO- + H2OCl- + ClO- +H+→ Cl2 + H2OCu + HNO3→ Cu (NO3) 2+ NO ↑ + H2O配平练习S+OH-→ SO32- + S2- + H2O4Cr2O72-+3S2O32-+26H+ = 8Cr3++6SO42-+13H2O5I-+ IO3- +6H+= 3I2 +3 H2OCl2 + 2OH- = Cl- + ClO- + H2OCl- + ClO- +2H+ = Cl2 + H2O3Cu + 8HNO3 = 3 Cu (NO3) 2+ 2NO ↑ +4 H2O配平练习3S+6OH- = SO32- + 2S2- + 3H2O谢谢大家
—氧化还原离子方程式的书写训练下列各组中的离子,能在溶液中大量共存的是( )
A.Fe2+、H+、C1- 、 MnO4 -
B.Na+、Ba2+、CO32 - 、NO3 -
C.Na+、H+、Cl-、CO32-
D.K+、Cu2+、 NO3 - 、SO42 - D一、分类:
(1)复分解反应类型离子反应
(2)氧化还原类型离子反应 三、离子共存四、离子方程式的书写:拆分原则一样离子反应二、离子反应发生条件
(1)复分解反应型:生成沉淀,气体,(弱酸、弱碱、水等)弱电解质(2)氧化还原型:发生氧化还原反应可拆物质:强酸、强碱、可溶盐
不拆物质:沉淀、气体、弱电解质、氧化物、
单质、非电解质表1 高中化学常见还原剂的还原性顺序关系及常见产物表2 高中化学常见氧化剂及常见产物S单质SO42-I2Fe3+Br2O2Mn2+Cr3+Cl-Cl-NOH2OH2O例题1:向酸性高锰酸钾溶液中,加入一定量的H2O2,生成Mn2+,写出该反应的离子方程式。一、善用升降观/得失观判断产物MnO4-+H2O2 →Mn2++O2↑MnO4- + H2O2 → Mn2+ + ?-1+7+2例题1:向酸性高锰酸钾溶液中,加入一定量的H2O2,生成Mn2+,写出该反应的离子方程式。二、善用守恒观来配平离子方程式
得失电子守恒,电荷守恒,原子守恒
电荷不够,酸、碱来凑,还不平就补水。
MnO4-+H2O2 →Mn2++O2↑-1+7+202 MnO4- + 5 H2O2 +6H+ = 2Mn2++5O2↑+ 8H2O一、善用升降观/得失观判断产物例题2:在碱性溶液中,用氯气可将NH4+氧化,生成一种可直接排放到大气中的气体,写出离子方程式。Cl2 + NH4+ → N2 + Cl-二、善用守恒观来配平离子方程式3Cl2 + 2NH4+ + 8OH- = N2 + 6Cl- + 8H2O 得失电子守恒,电荷守恒,原子守恒
电荷不够,酸、碱来凑,还不平就补水。
找产物看升降/得失平电荷配系数基本原则及步骤判断好反应物和产物用电子得失守恒确定已知离子的系数根据电荷守恒补充缺少的离子(补H+ 或OH-)根据原子守恒配平(补水?)氧化还原离子方程式的书写练习1:向酸性高锰酸钾溶液中,通入一定量的SO2气体,生成Mn2+,写出该反应的离子方程式。一、善用升降观/得失观判断产物2MnO4- +5SO2 +2H2O = 2Mn2++ 5SO42-+4H+ 二、善用守恒观来配平离子方程式3、向二氧化铈(CeO2)固体中加稀硫酸和 H2O2,所得溶液中含有Ce3+,写出反应的离子方程式。2、ClO-碱性条件下与SO2反应2CeO2+H2O2+6H+= 2Ce3++O2↑+4H2OClO-+SO2+2OH-= SO42-+Cl-+H2O4【2016全国(Ⅰ)27】(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72?还原成Cr3+,反应的离子方程式为 Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O练习练习5:二氧化氯(ClO2黄绿色易溶于水的气体)是一种高效低毒的消毒剂。测定混合气中ClO2的含量的过程中,往溶有该气体的锥形瓶中加入足量的碘化钾,再加入足量稀硫酸,滴入几滴淀粉溶液,溶液变蓝色。写出锥形瓶内ClO2与碘化钾反应的离子方程式。
为什么产物不是Cl2?抑或是HClO?Cl2+2I-=2Cl-+I2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O
找产物看升降/得失平电荷配系数基本原则及步骤判断好反应物和产物用电子得失守恒确定已知离子的系数根据电荷守恒补充缺少的离子(补H+ 或OH-)根据原子守恒配平(补水?)氧化还原离子方程式的书写总结:1、写出Cl2与以下物质或离子的反应:Br-、Fe2+、 I-、SO2、SO32-、S2-
2、写出H2O2(H+)与以下物质或离子的反应:Br-、Fe2+、I-、SO2、SO32-、S2-
3、写出Fe3+与以下物质或离子的反应:I-、SO2、SO32-、S2-、Cu、Fe
4、写出ClO-酸性条件下与Fe2+反应;ClO-碱性条件下与I-反应;ClO-酸性条件下与SO2反应
5、KMnO4(H+)与以下溶液反应:浓盐酸、草酸(H2C2O4)、双氧水、Na2SO3
写出以下反应离子方程式:提高篇 H2O2+2Br-+2H+= Br2+2H2O
H2O2+ 2Fe2+ +2H+ = 2Fe3+ +2H2O
H2O2+ 2I- +2H+ = I2+2H2O
H2O2+ SO2 =SO42- + H2O+2H+
H2O2+SO32﹣= SO42﹣+H2O
H2O2+S2-+2H+ = S↓ + 2H2O Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
Cl2 + 2I- = I2 + 2Cl-
Cl2 + SO2+2H2O = SO42﹣ + 2Cl- +4H+
Cl2 + SO32- + H2O = SO42﹣ + 2Cl- +2H+
Cl2 + S2- = S↓ + 2Cl- 1、写出Cl2与以下物质或离子的反应:Br-、Fe2+、 I-、SO2、SO32-、S2-2、写出H2O2(H+)与以下物质或离子的反应:Br-、
Fe2+、I-、SO2、SO32-、S2-3、写出Fe3+与以下物质或离子的反应:I-、SO2、
SO32-、S2-、Cu、Fe2 Fe3+ +2I- = 2Fe2+ + I2
2 Fe3+ +SO2 + 2H2O = 2Fe2+ + SO42- + 4H+
2Fe3+ + SO32- +H2O = 2Fe2+ + SO42- + 2H+
2Fe3+ + S2- = 2Fe2+ + S↓
2Fe3+ + Cu = 2Fe2+ + Cu2+
2Fe3+ + Fe= 3Fe2+ 4、写出ClO-酸性条件下与Fe2+反应;ClO-碱性条件下
与I-反应;ClO-酸性条件下与SO2反应ClO- + 2Fe2++ 2H+= Cl- +2Fe3+ +H2O
ClO- + 2I- + H2O = Cl- +I2 + 2OH-
ClO- + SO2+ H2O = Cl- +SO42- +2H+5、KMnO4(H+)与以下溶液反应:浓盐酸、
草酸(H2C2O4)、双氧水、Na2SO3
2MnO4- + 10Cl- +16H+ = 2Mn2++ 5Cl2↑+ 8H2O
2MnO4-+5H2C2O4 +6H+ = 2Mn2++10CO2↑+ 8H2O
2MnO4-+ 5H2O2+6H+= 2Mn2+ +5O2↑+ 8H2O
2MnO4-+ 5SO32- +6H+ = 2Mn2++ 5SO42- + 3H2O 找产物看升降/得失平电荷配系数氧化还原反应分类观守恒观Cr2O72-+S2O32-+H+→Cr3++SO42-+H2OI-+ IO3- +H+→ I2 + H2OCl2 + OH-→ Cl- + ClO- + H2OCl- + ClO- +H+→ Cl2 + H2OCu + HNO3→ Cu (NO3) 2+ NO ↑ + H2O配平练习S+OH-→ SO32- + S2- + H2O4Cr2O72-+3S2O32-+26H+ = 8Cr3++6SO42-+13H2O5I-+ IO3- +6H+= 3I2 +3 H2OCl2 + 2OH- = Cl- + ClO- + H2OCl- + ClO- +2H+ = Cl2 + H2O3Cu + 8HNO3 = 3 Cu (NO3) 2+ 2NO ↑ +4 H2O配平练习3S+6OH- = SO32- + 2S2- + 3H2O谢谢大家
