物质的转化规律
图片预览







文档简介
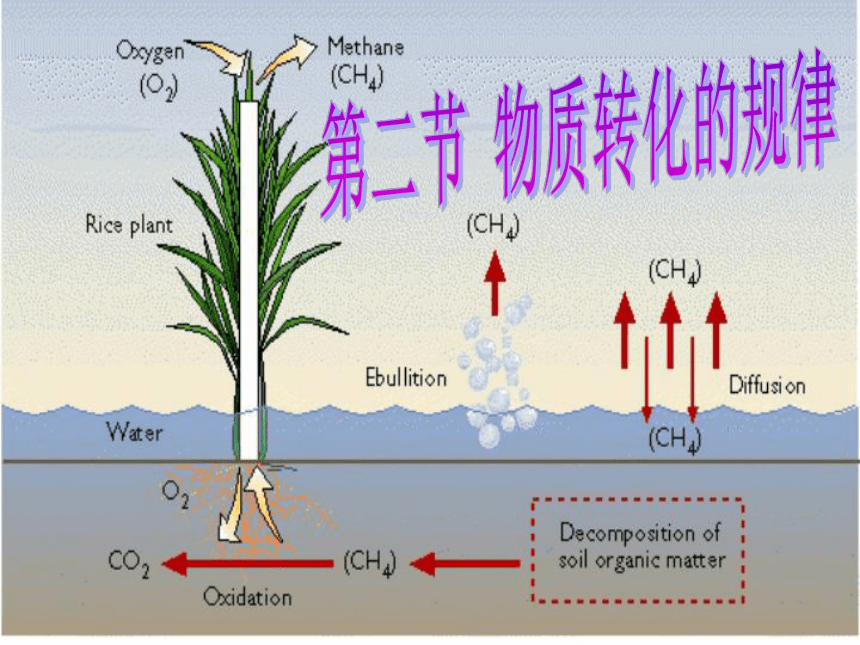
课件65张PPT。第二节 常见的动物第二节 物质转化的规律情景导入1.回忆:化学反应的基本特征是什么? 2.科学家就利用物质与物质之间的化学反应,制造出许许多多的新物质,如合成材料PVC,塑料聚氯乙烯,化肥硫铵、碳铵等.
3.哪些物质之间可以反应,哪些物质之间不可反应,它们又有什么规律?一、非金属单质与其化合物的转化硫磺火山喷射的产物-硫磺实验一:硫磺的燃烧1、实验操作一、非金属单质与其化合物的转化 实验:(一)硫燃烧的实验硫磺,观察其外观:在空气点燃硫磺现象:淡黄色的粉末淡蓝色火焰,刺激性气味燃烧着的硫磺放进盛有氧气的集气瓶,观察现象 明亮的蓝紫色火焰,刺激性气味 思考:
(1)实验1发生变化的方程式是什么?
(2)你知道还有哪些非金属可以跟氧气反应吗?化学方程式?
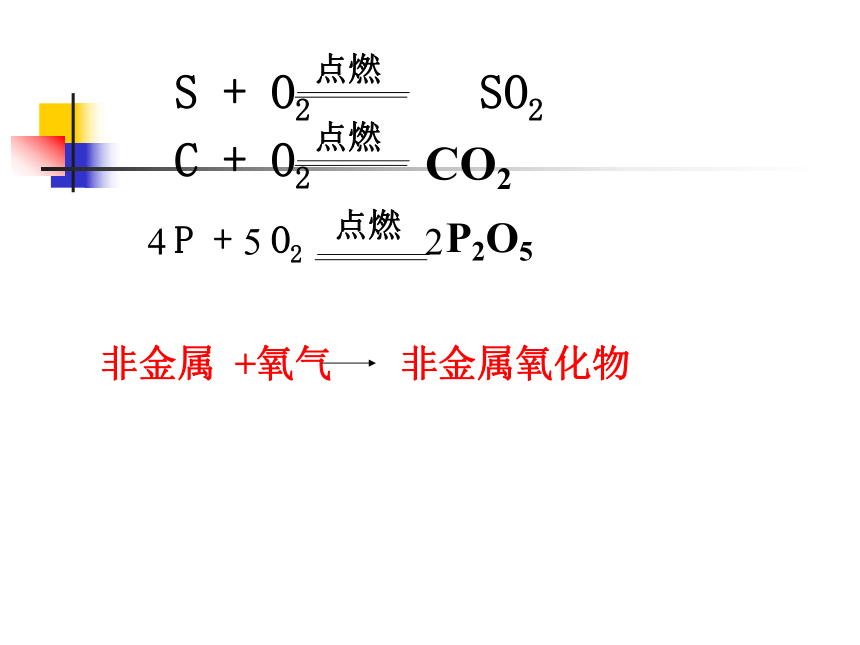
(3)由此你可以归纳出怎样的规律?CO2P2O54 5 2实验2:
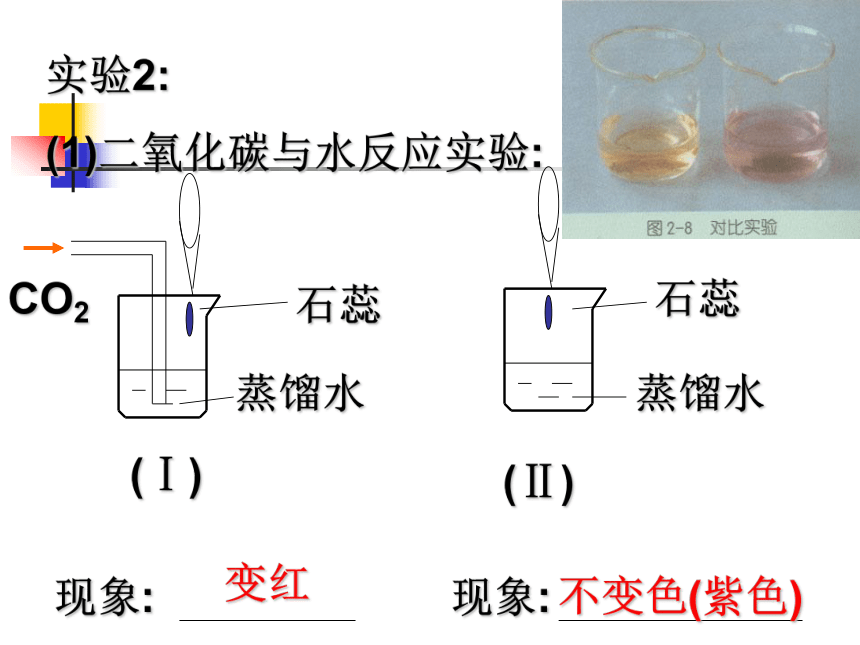
(1)二氧化碳与水反应实验:蒸馏水CO2蒸馏水变红不变色(紫色)(Ⅰ)(Ⅱ)(2)碳酸分解实验:
分别搅拌两只烧杯中的液体,3分钟后,静置片刻,现象是:
.
将盛有液体的两只烧杯分别放到热水中,3分钟后,现象是:
. 没有明显现象红色又变紫色思考:
(1)如何解释上述实验现象?
;
.
(2)将上述变化用化学方程式表示出来.
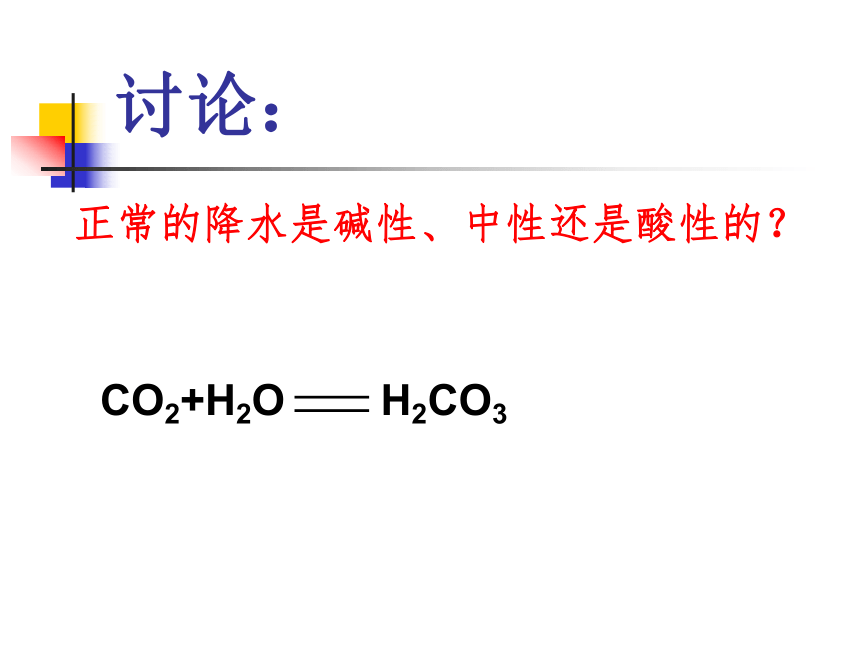
(3)还有哪些非金属氧化物能与水反应?由此你得到什么规律?二氧化碳与水反应生成碳酸,石蕊遇酸变红 碳酸不稳定,受热易分解注意:二氧化硅不能与水化合生成硅酸。现在我国的常用能源煤和石油中都含有硫,在燃烧时生成SO2,导致大气污染而降酸雨。讨论:正常的降水是碱性、中性还是酸性的?讨论:怎样用化学方程式表示下列物质间的转化?规律:非金属氧化物 + H2O 酸
(除二氧化硅外)
CO2 + H2O ====H2CO3
SO2 + H2O ====
N2O5 + H2O ====H2SO32HNO3P2O5 + H2O ====H3PO43 2 思考:如何实现非金属到酸的转变?
二、金属单质与其化合物的转化实验三:铁粉与硫磺的实验1、实验操作科学探究实验一、
1、取少量铁粉放在白纸上,再取少量硫与铁粉混合。现象:铁粉呈 色,硫呈 色。2、用磁铁接近混合物,你看到了什么现象?现象: 被磁铁吸引,附在磁铁的表面。
结论:说明铁有 性,能被磁铁吸引。金属单质与其化合物的转化黑淡黄铁粉铁磁3、把混合物放在石棉网上,用酒精灯加热。现象:生成 色固体 ,同时放出大量的热量。结论:(用化学方程式表示)
Fe + S ==FeS (硫化亚铁)4、完全反应后冷却,将石棉网上的生成物倒在白纸上,用磁铁靠近生成物。现象:生成物FeS 被磁铁吸引。结论:铁和硫化亚铁是两种不同的物质。黑不能??还有哪些金属单质可以转化为相应的化合物?金属单质与非金属单质在一定条件下生成相应的盐。讨论金属单质与非金属单质相互反应可以生成哪类化合物?试一试:
1、钠在氯气中燃烧生成氯化钠的方程式
2、铁在氯气中燃烧生成氯化铁的方程式金属单质+非金属单质→盐(无氧酸盐)2Na+Cl2==2NaCl2Fe + 3Cl2 == 2FeCl3 (氯化铁)点燃△实验二、在烧杯中放一小块生石灰,加水搅拌。现象:1、生石灰溶于水变成 粉末;
2、同时放出大量的热。结论:如果金属与氧气反应生成什么?完成下列化学方程式:
1、 Mg + O2===
2、 Ca + O2===
3、 Cu + O2===CaO +H2O ===Ca(OH)22 2MgO 点燃2 2CaO 2 2CuO 点燃白色金属氧化物做一做试一试根据上述实验结论,写出 Na2O、K2O、BaO溶于水后发生反应的化学方程式。Na2O + H2O ===K2O + H2O ===BaO + H2O ===某些金属氧化物 + 水→碱(可溶)碱通过哪些方法变成盐?与非金属氧化物、酸、可溶盐反应可变成盐2NaOH2KOHBa(OH)2总结金属单质与其化合物的转化关系金属金 属氧化物 碱 盐→→→非金属单质与其化合物的转化关系非金属→非金属氧化物 酸→→ 盐给生石灰加水-建筑用给生石灰加水-实验讨论:怎样用化学方程式表示下列物质间的转化?方铅矿(主要成分PbS) 赤铁矿石
(主要成分Fe2O3)三、金属的冶炼孔雀石[主要成分Cu2(OH)2CO3 ] 自然界中少数金属是以游离态(即单质)的形式存在,大多数金属是以化合态(化合物)的形式存在。金属的冶炼就是把金属从化合态变成游离态。冶炼的方法:
碳等还原剂与金属氧化物在高温下反应,还原剂夺取金属氧化物中的氧,得到游离的金属单质。实验五:碳与氧化铜的实验1、实验操作2、化学方程式 炽热的炭在高温条件下能与二氧化碳反应,生成一氧化碳。一氧化碳也可以夺取金属氧化物中的氧,产生游离的金属单质。除了C、CO可以还原金属氧化物外,氢气也可以还原金属氧化物。实验六:孔雀石受热分解、氢气还原氧化铜的实验1、实验操作2、化学方程式讨论:1、由氧化铜制取铜,还可用其他什么方法?2、为什么在氢气还原氧化铜实验开始时,要先通氢气后给氧化铜加热?3、实验停止后,为什么还要继续通氢气,直到试管冷却为止?排尽试管内的空气,防止氢气与空气混合加热时试管防止灼热的铜被空气中的氧气氧化变成氧化铜可用C、H2、CO等还原剂在一定条件下还原氧化铜
还可以将氧化铜转化为盐,用活泼金属置换出铜(1)这种含氧化合物里的氧被夺取的反应,叫做还原反应
(2)碳.氢气和一氧化碳等能从氧化铜.氧化铁中夺取氧的能力叫做还原性
(3)具有还原性的物质可做还原剂C+2CuO===2Cu+CO2↑ △ 2C+CO2=====2CO 高温 CO+CuO====Cu+CO2 高温 H2+CuO====Cu+H2O △ 发现:结论:氢气(H2)碳(C)一氧化碳(CO)夺氧还原剂氧化铜(CuO)氧化铁(Fe2O3)失氧氧化剂氧
化
还
原
反
应氧化锌(ZnO)用得失氧分析:△
H2 + CuO ====== H2O + Cu
得到氧 被氧化 氧化反应失去氧 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性) 像这种既有氧化反应又有还原反应的反应叫做氧化还原反应分析下面氧化还原反应:氧化剂:
还原剂:Fe2O3C还原反应氧化反应被氧化的是:
被还原的是:Fe2O3C具有氧化性的是:
具有还原性的是:Fe2O3C氧化产物:
还原产物:CO2Fe思考: 我国从商周时期就能炼铜,西汉掌握了湿法炼铜技术,春秋战国就能炼铁,是最早冶炼出这两种金属的国家;我国又是生产钢铁的大国,则工业是如何把赤铁矿冶炼成金属铁的呢?钢铁是怎样炼成?实验七:一氧化碳还原氧化铁的实验1、实验操作2、化学方程式 思考:要将赤铁矿(主要成分为Fe2O3)冶炼成生铁(主要成分为铁),你有哪些方法?哪种方法制得的铁最纯?请写出化学方程式:特别提醒:有多种物质可以把铁矿石转变成铁,但在炼铁时必须考虑许多实际问题;并且把铁矿石冶炼成铁是一个很复杂的过程但是它的主要反应原理是在高温下,用一氧化碳从铁矿石里把铁还原出来:CO+Fe2O3— CO+Fe3O4— 1.铁的存在及分布赤铁矿(Fe2O3) 磁铁矿(Fe3O4)炼铁3.炼铁原料:铁矿石.焦炭.石灰石.空气.4.原理:高温下用还原
剂(主要是CO)从铁矿石
中把铁还原出来.2.主要设备:高炉高炉中是如何反应的,各原料的作用是什么?在硬质玻璃管里加入少量红棕色的氧化铁粉未,通入一氧化碳,然后加热,观察发生的现象: .
化学方程式: 红棕色变黑色,石灰水变浑浊一氧化碳还原氧化铁(炼铁反应原理)①通CO③燃烧法处理CO尾气或气球收集利用②尾气验纯④点燃喷灯⑤熄灭喷灯⑥继续通CO至冷却,再停通⑦熄灭酒精灯检验并吸收CO2金属冶炼的原理:置换法比还原法优越,因为置换法操作简便,安全,节约原料。还原反应:含氧化合物里的氧被夺取的反应。
还原剂:具有从含氧化合物里夺取氧的能力,还原性是化学性质。 铁矿石的冶炼是一个复杂的过程,但它的主要反应原理是在高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。四、有关纯度的计算方法一:
计算分步设计:
(1)根据混合物质量及其纯度,如何计算纯净物质量
纯净物质量=混合物质量×纯度 例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨?解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
组成元素的质量=纯净物的质量×
纯净物中某组成元素的质量分数
(2)根据纯净物的质量,求出其中组成元素的质量
=59.5吨 例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨?解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
(3)求工业产品中的含杂质的物质的质量(即混合物质量)
=59.5吨 例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨?解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
炼出的生铁的质量为:59.5吨÷96%=62吨答:炼出的生铁质量为62吨。方法二
解:设可炼出含铁96%的生铁的质量为 x 。 160 112
100吨×85% x×96%160:112=100吨×85% : x×96%答:炼出的生铁质量为62吨。一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱CaO+H2O==2Ca(OH)2Ca(OH)2+2HCl==CaCl2+2H2OO2H2O HCl 常见无机物间相互关系一、单质、氧化物、酸、碱、盐各类物质的相互关系两条纵线一、单质、氧化物、酸、碱、盐各类物质的相互关系非金属盐CO2+H2O==H2CO3O2H2OCa(OH)2一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐两条纵线四条横线一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐 无氧酸盐
NaOH+HCl==盐+水含氧酸盐新盐+新盐NaCl+AgNO3==2NaCl
CaSiO3
NaCl+H2O
一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐两条纵线四条横线四条交叉斜线一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐盐 + 水CuO + H2SO4==盐 + 水CO2 + Ca(OH)2 ==2NaOH+CuSO4==H2SO4 + BaCl2==CuSO4 + H2O新碱 + 新盐
新酸 + 新盐
一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐两条纵线四条横线四条交叉斜线两条弯线一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐盐 + 氢气金属+新盐
Zn +2 HCl==Fe + CuSO4=Cu + FeSO4一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐二三作业练1练2讨论:设计制备ZnSO4 的4种方法。ZnO + H2SO4 ===== ZnSO4 + H2O
Zn + H2SO4 ===== ZnSO4 + H2↑Zn(OH)2 + H2SO4 ===== ZnSO4 + 2H2OZnCO3 + H2SO4 ==== ZnSO4 + CO2↑ + H2O例题:100吨含Fe2O3的质量分数为85%的铁矿石中,能炼出含铁的质量分数为96%的生铁多少吨?
你会做吗?1、 Fe2O3的质量为多少? 2、铁元素的质量是多少?3、含铁的质量分数为96%的生铁多少吨?石灰岩地区溶洞的形成过程 溶洞的形成原因:石灰岩地区地下水长期溶蚀的结果。石灰岩的主要成分是碳酸钙(CaCO3),在有水和二氧化碳时发生化学反应生成碳酸氢钙[Ca(HCO3)2],后者可溶于水,于是有空洞形成并逐步扩大。 实验:蛋壳的变化
1、将一只生鸡蛋放到盛有稀盐酸的容器中,观察到的现象:
2、2分钟后,将生鸡蛋从酸中取出,用水冲洗干净,蛋壳发生了什么变化
3、将鸡蛋继续放在稀盐酸中,10分钟后取出,用水冲洗干净,蛋壳发生了什么变化
现象:蛋壳表面附着气泡 表面变得更粗糙蛋壳几乎消失CaCO3 + 2HCl ====CaCl2 +CO2 ↑+ H2O
3.哪些物质之间可以反应,哪些物质之间不可反应,它们又有什么规律?一、非金属单质与其化合物的转化硫磺火山喷射的产物-硫磺实验一:硫磺的燃烧1、实验操作一、非金属单质与其化合物的转化 实验:(一)硫燃烧的实验硫磺,观察其外观:在空气点燃硫磺现象:淡黄色的粉末淡蓝色火焰,刺激性气味燃烧着的硫磺放进盛有氧气的集气瓶,观察现象 明亮的蓝紫色火焰,刺激性气味 思考:
(1)实验1发生变化的方程式是什么?
(2)你知道还有哪些非金属可以跟氧气反应吗?化学方程式?
(3)由此你可以归纳出怎样的规律?CO2P2O54 5 2实验2:
(1)二氧化碳与水反应实验:蒸馏水CO2蒸馏水变红不变色(紫色)(Ⅰ)(Ⅱ)(2)碳酸分解实验:
分别搅拌两只烧杯中的液体,3分钟后,静置片刻,现象是:
.
将盛有液体的两只烧杯分别放到热水中,3分钟后,现象是:
. 没有明显现象红色又变紫色思考:
(1)如何解释上述实验现象?
;
.
(2)将上述变化用化学方程式表示出来.
(3)还有哪些非金属氧化物能与水反应?由此你得到什么规律?二氧化碳与水反应生成碳酸,石蕊遇酸变红 碳酸不稳定,受热易分解注意:二氧化硅不能与水化合生成硅酸。现在我国的常用能源煤和石油中都含有硫,在燃烧时生成SO2,导致大气污染而降酸雨。讨论:正常的降水是碱性、中性还是酸性的?讨论:怎样用化学方程式表示下列物质间的转化?规律:非金属氧化物 + H2O 酸
(除二氧化硅外)
CO2 + H2O ====H2CO3
SO2 + H2O ====
N2O5 + H2O ====H2SO32HNO3P2O5 + H2O ====H3PO43 2 思考:如何实现非金属到酸的转变?
二、金属单质与其化合物的转化实验三:铁粉与硫磺的实验1、实验操作科学探究实验一、
1、取少量铁粉放在白纸上,再取少量硫与铁粉混合。现象:铁粉呈 色,硫呈 色。2、用磁铁接近混合物,你看到了什么现象?现象: 被磁铁吸引,附在磁铁的表面。
结论:说明铁有 性,能被磁铁吸引。金属单质与其化合物的转化黑淡黄铁粉铁磁3、把混合物放在石棉网上,用酒精灯加热。现象:生成 色固体 ,同时放出大量的热量。结论:(用化学方程式表示)
Fe + S ==FeS (硫化亚铁)4、完全反应后冷却,将石棉网上的生成物倒在白纸上,用磁铁靠近生成物。现象:生成物FeS 被磁铁吸引。结论:铁和硫化亚铁是两种不同的物质。黑不能??还有哪些金属单质可以转化为相应的化合物?金属单质与非金属单质在一定条件下生成相应的盐。讨论金属单质与非金属单质相互反应可以生成哪类化合物?试一试:
1、钠在氯气中燃烧生成氯化钠的方程式
2、铁在氯气中燃烧生成氯化铁的方程式金属单质+非金属单质→盐(无氧酸盐)2Na+Cl2==2NaCl2Fe + 3Cl2 == 2FeCl3 (氯化铁)点燃△实验二、在烧杯中放一小块生石灰,加水搅拌。现象:1、生石灰溶于水变成 粉末;
2、同时放出大量的热。结论:如果金属与氧气反应生成什么?完成下列化学方程式:
1、 Mg + O2===
2、 Ca + O2===
3、 Cu + O2===CaO +H2O ===Ca(OH)22 2MgO 点燃2 2CaO 2 2CuO 点燃白色金属氧化物做一做试一试根据上述实验结论,写出 Na2O、K2O、BaO溶于水后发生反应的化学方程式。Na2O + H2O ===K2O + H2O ===BaO + H2O ===某些金属氧化物 + 水→碱(可溶)碱通过哪些方法变成盐?与非金属氧化物、酸、可溶盐反应可变成盐2NaOH2KOHBa(OH)2总结金属单质与其化合物的转化关系金属金 属氧化物 碱 盐→→→非金属单质与其化合物的转化关系非金属→非金属氧化物 酸→→ 盐给生石灰加水-建筑用给生石灰加水-实验讨论:怎样用化学方程式表示下列物质间的转化?方铅矿(主要成分PbS) 赤铁矿石
(主要成分Fe2O3)三、金属的冶炼孔雀石[主要成分Cu2(OH)2CO3 ] 自然界中少数金属是以游离态(即单质)的形式存在,大多数金属是以化合态(化合物)的形式存在。金属的冶炼就是把金属从化合态变成游离态。冶炼的方法:
碳等还原剂与金属氧化物在高温下反应,还原剂夺取金属氧化物中的氧,得到游离的金属单质。实验五:碳与氧化铜的实验1、实验操作2、化学方程式 炽热的炭在高温条件下能与二氧化碳反应,生成一氧化碳。一氧化碳也可以夺取金属氧化物中的氧,产生游离的金属单质。除了C、CO可以还原金属氧化物外,氢气也可以还原金属氧化物。实验六:孔雀石受热分解、氢气还原氧化铜的实验1、实验操作2、化学方程式讨论:1、由氧化铜制取铜,还可用其他什么方法?2、为什么在氢气还原氧化铜实验开始时,要先通氢气后给氧化铜加热?3、实验停止后,为什么还要继续通氢气,直到试管冷却为止?排尽试管内的空气,防止氢气与空气混合加热时试管防止灼热的铜被空气中的氧气氧化变成氧化铜可用C、H2、CO等还原剂在一定条件下还原氧化铜
还可以将氧化铜转化为盐,用活泼金属置换出铜(1)这种含氧化合物里的氧被夺取的反应,叫做还原反应
(2)碳.氢气和一氧化碳等能从氧化铜.氧化铁中夺取氧的能力叫做还原性
(3)具有还原性的物质可做还原剂C+2CuO===2Cu+CO2↑ △ 2C+CO2=====2CO 高温 CO+CuO====Cu+CO2 高温 H2+CuO====Cu+H2O △ 发现:结论:氢气(H2)碳(C)一氧化碳(CO)夺氧还原剂氧化铜(CuO)氧化铁(Fe2O3)失氧氧化剂氧
化
还
原
反
应氧化锌(ZnO)用得失氧分析:△
H2 + CuO ====== H2O + Cu
得到氧 被氧化 氧化反应失去氧 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性) 像这种既有氧化反应又有还原反应的反应叫做氧化还原反应分析下面氧化还原反应:氧化剂:
还原剂:Fe2O3C还原反应氧化反应被氧化的是:
被还原的是:Fe2O3C具有氧化性的是:
具有还原性的是:Fe2O3C氧化产物:
还原产物:CO2Fe思考: 我国从商周时期就能炼铜,西汉掌握了湿法炼铜技术,春秋战国就能炼铁,是最早冶炼出这两种金属的国家;我国又是生产钢铁的大国,则工业是如何把赤铁矿冶炼成金属铁的呢?钢铁是怎样炼成?实验七:一氧化碳还原氧化铁的实验1、实验操作2、化学方程式 思考:要将赤铁矿(主要成分为Fe2O3)冶炼成生铁(主要成分为铁),你有哪些方法?哪种方法制得的铁最纯?请写出化学方程式:特别提醒:有多种物质可以把铁矿石转变成铁,但在炼铁时必须考虑许多实际问题;并且把铁矿石冶炼成铁是一个很复杂的过程但是它的主要反应原理是在高温下,用一氧化碳从铁矿石里把铁还原出来:CO+Fe2O3— CO+Fe3O4— 1.铁的存在及分布赤铁矿(Fe2O3) 磁铁矿(Fe3O4)炼铁3.炼铁原料:铁矿石.焦炭.石灰石.空气.4.原理:高温下用还原
剂(主要是CO)从铁矿石
中把铁还原出来.2.主要设备:高炉高炉中是如何反应的,各原料的作用是什么?在硬质玻璃管里加入少量红棕色的氧化铁粉未,通入一氧化碳,然后加热,观察发生的现象: .
化学方程式: 红棕色变黑色,石灰水变浑浊一氧化碳还原氧化铁(炼铁反应原理)①通CO③燃烧法处理CO尾气或气球收集利用②尾气验纯④点燃喷灯⑤熄灭喷灯⑥继续通CO至冷却,再停通⑦熄灭酒精灯检验并吸收CO2金属冶炼的原理:置换法比还原法优越,因为置换法操作简便,安全,节约原料。还原反应:含氧化合物里的氧被夺取的反应。
还原剂:具有从含氧化合物里夺取氧的能力,还原性是化学性质。 铁矿石的冶炼是一个复杂的过程,但它的主要反应原理是在高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。四、有关纯度的计算方法一:
计算分步设计:
(1)根据混合物质量及其纯度,如何计算纯净物质量
纯净物质量=混合物质量×纯度 例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨?解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
组成元素的质量=纯净物的质量×
纯净物中某组成元素的质量分数
(2)根据纯净物的质量,求出其中组成元素的质量
=59.5吨 例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨?解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
(3)求工业产品中的含杂质的物质的质量(即混合物质量)
=59.5吨 例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨?解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
炼出的生铁的质量为:59.5吨÷96%=62吨答:炼出的生铁质量为62吨。方法二
解:设可炼出含铁96%的生铁的质量为 x 。 160 112
100吨×85% x×96%160:112=100吨×85% : x×96%答:炼出的生铁质量为62吨。一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱CaO+H2O==2Ca(OH)2Ca(OH)2+2HCl==CaCl2+2H2OO2H2O HCl 常见无机物间相互关系一、单质、氧化物、酸、碱、盐各类物质的相互关系两条纵线一、单质、氧化物、酸、碱、盐各类物质的相互关系非金属盐CO2+H2O==H2CO3O2H2OCa(OH)2一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐两条纵线四条横线一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐 无氧酸盐
NaOH+HCl==盐+水含氧酸盐新盐+新盐NaCl+AgNO3==2NaCl
CaSiO3
NaCl+H2O
一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐两条纵线四条横线四条交叉斜线一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐盐 + 水CuO + H2SO4==盐 + 水CO2 + Ca(OH)2 ==2NaOH+CuSO4==H2SO4 + BaCl2==CuSO4 + H2O新碱 + 新盐
新酸 + 新盐
一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐两条纵线四条横线四条交叉斜线两条弯线一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐盐 + 氢气金属+新盐
Zn +2 HCl==Fe + CuSO4=Cu + FeSO4一、单质、氧化物、酸、碱、盐各类物质的相互关系金属碱非金属盐二三作业练1练2讨论:设计制备ZnSO4 的4种方法。ZnO + H2SO4 ===== ZnSO4 + H2O
Zn + H2SO4 ===== ZnSO4 + H2↑Zn(OH)2 + H2SO4 ===== ZnSO4 + 2H2OZnCO3 + H2SO4 ==== ZnSO4 + CO2↑ + H2O例题:100吨含Fe2O3的质量分数为85%的铁矿石中,能炼出含铁的质量分数为96%的生铁多少吨?
你会做吗?1、 Fe2O3的质量为多少? 2、铁元素的质量是多少?3、含铁的质量分数为96%的生铁多少吨?石灰岩地区溶洞的形成过程 溶洞的形成原因:石灰岩地区地下水长期溶蚀的结果。石灰岩的主要成分是碳酸钙(CaCO3),在有水和二氧化碳时发生化学反应生成碳酸氢钙[Ca(HCO3)2],后者可溶于水,于是有空洞形成并逐步扩大。 实验:蛋壳的变化
1、将一只生鸡蛋放到盛有稀盐酸的容器中,观察到的现象:
2、2分钟后,将生鸡蛋从酸中取出,用水冲洗干净,蛋壳发生了什么变化
3、将鸡蛋继续放在稀盐酸中,10分钟后取出,用水冲洗干净,蛋壳发生了什么变化
现象:蛋壳表面附着气泡 表面变得更粗糙蛋壳几乎消失CaCO3 + 2HCl ====CaCl2 +CO2 ↑+ H2O
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
