鲁教版九年级下册化学8.2 海水“晒盐”课件(24张ppt)
文档属性
| 名称 | 鲁教版九年级下册化学8.2 海水“晒盐”课件(24张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 557.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-02-07 15:31:48 | ||
图片预览








文档简介
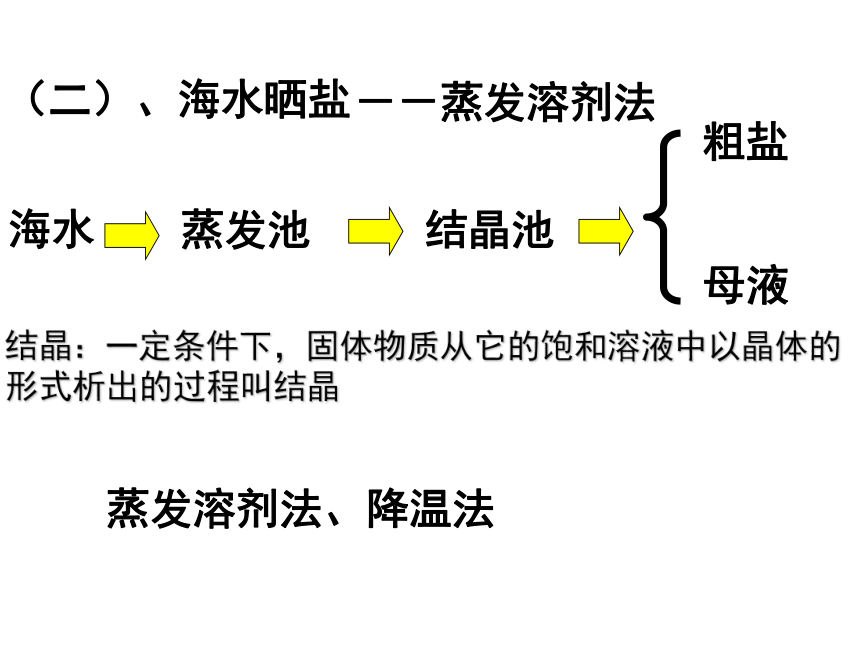
课件23张PPT。第二节海水“晒盐”(一)、饱和溶液、不饱和溶液1.定义:一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液; 还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。一、海水“晒盐”的过程3.饱和溶液与不饱和溶液的相互转化饱和溶液不饱和溶液加溶剂改变温度蒸发溶剂 改变温度2.判断溶液是否饱和 增加溶质(二)、海水晒盐海水蒸发池结晶池粗盐母液结晶:一定条件下,固体物质从它的饱和溶液中以晶体的形式析出的过程叫结晶--蒸发溶剂法蒸发溶剂法、降温法关于海水“晒盐”的叙述正确的是 ( )
A.利用海水降温析出晶体
B.海水晒盐后的母液因食盐减少而变成不
饱和溶液
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下分解得到食盐晶体C二、固体物质在水中的溶解度(一)影响固体物质在水中的溶解限量的因素1.溶质种类的影响2.温度的影响(二) 溶解度的定义 在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的溶质质量,叫做这种物质的在这种溶剂里的溶解度。一定温度下饱和状态 溶质质量100g溶剂20℃时,100g水中最多溶解31.6g硝酸钾。
20℃时硝酸钾的溶解度为31.6g20℃时,100g水中溶解硝酸钾达到饱和状态时,质量为31.6g。练习判断下列说法中正确的是( )A、20℃时,100g水里最多能溶解36g氯化钠,所以20℃时氯化钠的溶解度为36g B、20℃时,硝酸钾的溶解度为31.6C、20℃时,在100g水中加入35g氯化钠完全溶解,则20℃时,氯化钠的溶解度为35gD、20℃时,100g氯化钠的饱和溶液中有27g氯化钠,则20℃时,氯化钠的溶解度为27g AE、硝酸钾的溶解度为31.6g(三)溶解度曲线: 表示物质溶解度随温度变化的曲线叫溶解度曲线1、定义:Ca(OH)22、三种典型物质的溶解度曲线③可以比较同一温度下不同物质的溶解度大小①可读出任意温度下物质的溶解度3.溶解度曲线的应用②溶解度曲线交点意义 A、B、C三种物质的溶解度曲线如图所示:
40℃时B物质的溶解度是多少?
m点表示什么意义?
40℃时,三种物质的溶解度由小到大的顺序是( ) C、B、A
A、B、C
B、A、C
B、C、A70B30室温(20℃)时:S <0.01g易溶物可溶物微溶物 难溶物
(不溶物)S>10g1g<S<10g0.01g< S <1g降温结晶(冷却热饱和溶液):使溶解度随温度升高显著增大的物质从溶液中结晶析出,例如:KNO3(四)结晶蒸发结晶法(蒸发溶剂法):使溶解度随温度升高而变化不明显的物质从溶液中结晶析出,例如:NaCl补充:影响气体溶解度的因素温度越高气体的溶解度越小
压强越大气体的溶解度越大三、粗盐提纯1.杂质:可溶、不可溶2.实验室提纯1)溶解烧杯、玻璃棒仪器:2)过滤操作要点:仪器:烧杯、铁架台、漏斗、玻璃棒一贴、二低、三靠3)蒸发当有大量固体出现时,停止加热,利用余热蒸干剩余的水份(不能完全蒸干)仪器:铁架台、蒸发皿、玻璃棒、酒精灯操作要点:3.工业净化--化学方法Na2CO3 盐酸
BaCl2 NaOH Na+ Cl-SO42- Ca2+ Mg2+Na+ Cl-SO42- Ca2+ Mg2+盐酸Na+ Cl- Ca2+ Mg2+Ba2+③ ②①Na+ Cl- Mg2+CO32-Na+ Cl- CO32-OH- 过量BaCl2Na+ Cl- 过量Na2CO3过滤过量NaOH
A.利用海水降温析出晶体
B.海水晒盐后的母液因食盐减少而变成不
饱和溶液
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下分解得到食盐晶体C二、固体物质在水中的溶解度(一)影响固体物质在水中的溶解限量的因素1.溶质种类的影响2.温度的影响(二) 溶解度的定义 在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的溶质质量,叫做这种物质的在这种溶剂里的溶解度。一定温度下饱和状态 溶质质量100g溶剂20℃时,100g水中最多溶解31.6g硝酸钾。
20℃时硝酸钾的溶解度为31.6g20℃时,100g水中溶解硝酸钾达到饱和状态时,质量为31.6g。练习判断下列说法中正确的是( )A、20℃时,100g水里最多能溶解36g氯化钠,所以20℃时氯化钠的溶解度为36g B、20℃时,硝酸钾的溶解度为31.6C、20℃时,在100g水中加入35g氯化钠完全溶解,则20℃时,氯化钠的溶解度为35gD、20℃时,100g氯化钠的饱和溶液中有27g氯化钠,则20℃时,氯化钠的溶解度为27g AE、硝酸钾的溶解度为31.6g(三)溶解度曲线: 表示物质溶解度随温度变化的曲线叫溶解度曲线1、定义:Ca(OH)22、三种典型物质的溶解度曲线③可以比较同一温度下不同物质的溶解度大小①可读出任意温度下物质的溶解度3.溶解度曲线的应用②溶解度曲线交点意义 A、B、C三种物质的溶解度曲线如图所示:
40℃时B物质的溶解度是多少?
m点表示什么意义?
40℃时,三种物质的溶解度由小到大的顺序是( ) C、B、A
A、B、C
B、A、C
B、C、A70B30室温(20℃)时:S <0.01g易溶物可溶物微溶物 难溶物
(不溶物)S>10g1g<S<10g0.01g< S <1g降温结晶(冷却热饱和溶液):使溶解度随温度升高显著增大的物质从溶液中结晶析出,例如:KNO3(四)结晶蒸发结晶法(蒸发溶剂法):使溶解度随温度升高而变化不明显的物质从溶液中结晶析出,例如:NaCl补充:影响气体溶解度的因素温度越高气体的溶解度越小
压强越大气体的溶解度越大三、粗盐提纯1.杂质:可溶、不可溶2.实验室提纯1)溶解烧杯、玻璃棒仪器:2)过滤操作要点:仪器:烧杯、铁架台、漏斗、玻璃棒一贴、二低、三靠3)蒸发当有大量固体出现时,停止加热,利用余热蒸干剩余的水份(不能完全蒸干)仪器:铁架台、蒸发皿、玻璃棒、酒精灯操作要点:3.工业净化--化学方法Na2CO3 盐酸
BaCl2 NaOH Na+ Cl-SO42- Ca2+ Mg2+Na+ Cl-SO42- Ca2+ Mg2+盐酸Na+ Cl- Ca2+ Mg2+Ba2+③ ②①Na+ Cl- Mg2+CO32-Na+ Cl- CO32-OH- 过量BaCl2Na+ Cl- 过量Na2CO3过滤过量NaOH
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
