2.2.3 离子反应(42张)
图片预览






文档简介
课件42张PPT。离子反应专题2:从海水中获得的化学物质
第二单元:钠、镁及其化合物风霜雨雪,大江大泽,云卷云舒。望蓝色星球,
万千生灵,应水而生,新陈代谢,凭电离物——
酸碱盐水,
更有金属氧化物。
溶或熔,
电解质导电,
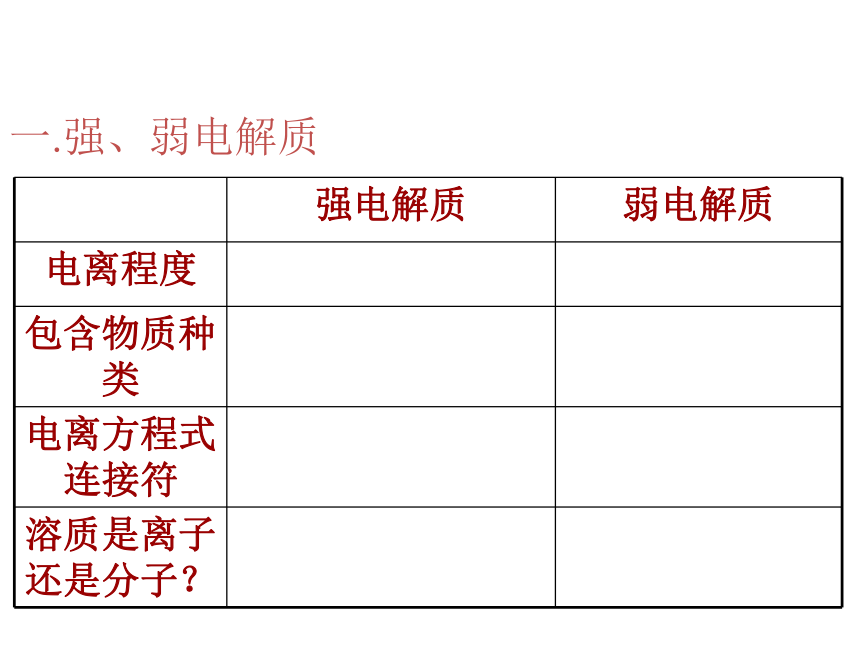
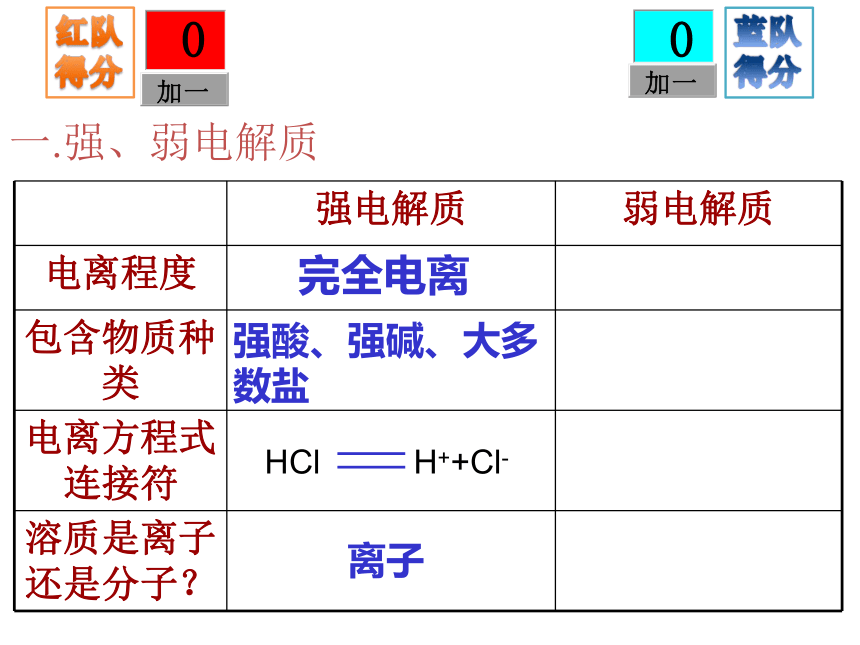
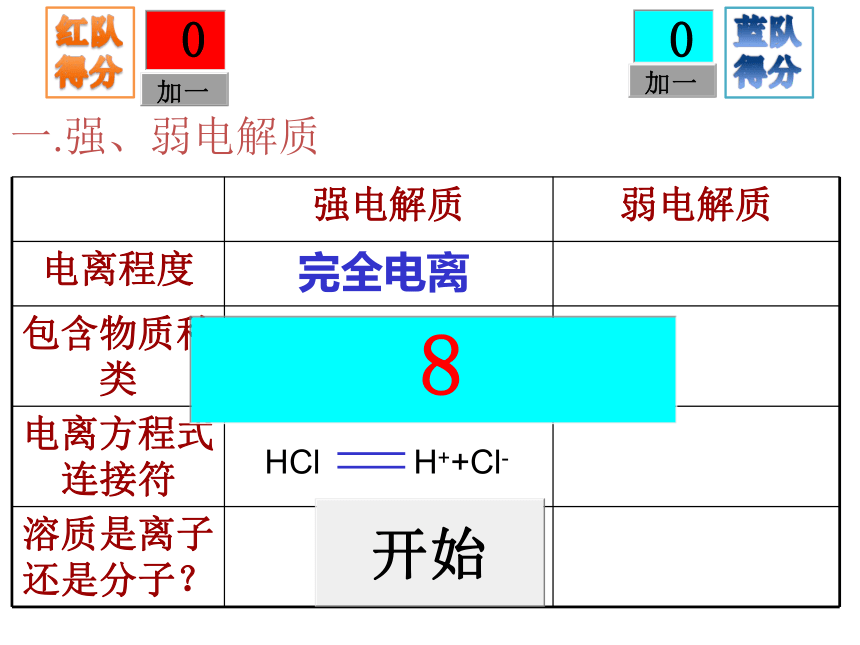
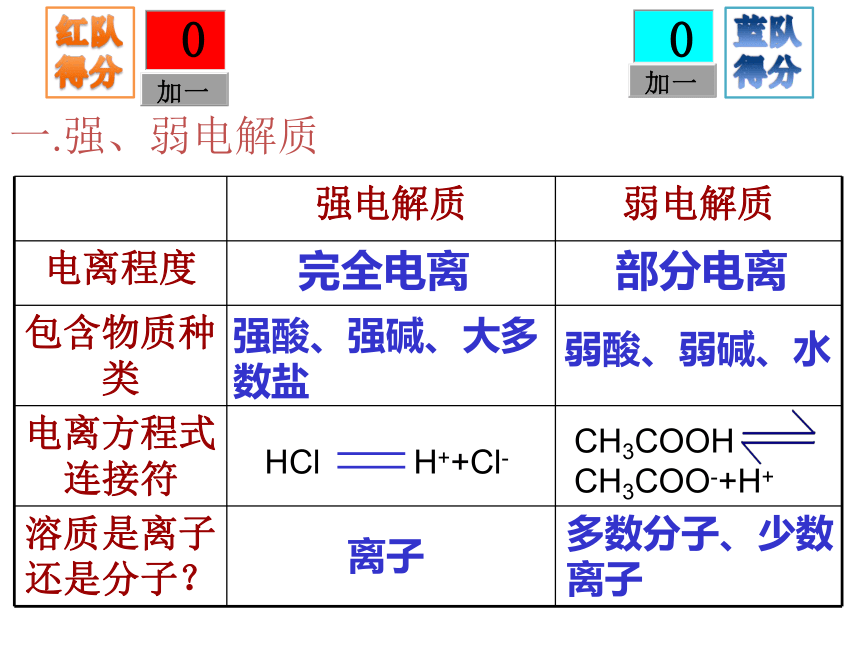
属化合物。 沁园春Cl-Cl-Cl-H+H+Cl-H+H+H+Cl-HCl电离CH3COOH电离CH3COOHCH3COOHH+CH3COOHCH3COOHCH3COO-CH3COOHCH3COOHCH3COOH一.强、弱电解质一.强、弱电解质一.强、弱电解质完全电离离子强酸、强碱、大多数盐一.强、弱电解质一.强、弱电解质完全电离离子强酸、强碱、大多数盐完全电离部分电离离子多数分子、少数离子强酸、强碱、大多数盐弱酸、弱碱、水一.强、弱电解质常见酸碱的强弱强酸:HNO3、H2SO4、 HCl等
强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等弱酸:CH3COOH(醋酸)、H2CO3、H2SO3、HClO等
弱碱:NH3·H2O(一水合氨)、Mg(OH)2、Fe(OH)3、 ggggggCu(OH)2 等二.离子反应有离子参加的化学反应。本质:离子浓度发生改变,一般为下降。发生条件:NaOH+NH4Cl=NaCl+NH3·H2ONO3-Na+Na+ NO3-Ag+Cl-→AgCl↓生成沉淀、气体、难电离物质
(复分解反应) 。二.离子反应有离子参加的化学反应。发生条件:NaOH+NH4Cl=NaCl+NH3·H2O二.离子反应发生条件:NaOH+NH4Cl=NaCl+NH3·H2O生成难溶物、易挥发物、难电离物质,或发生氧化还原反应。二.离子反应发生条件:NaOH+NH4Cl=NaCl+NH3·H2O生成难溶物、易挥发物、难电离物质,或发生氧化还原反应。探究实验各取一滴管至一试管中分组讨论:① 生成了什么新物质?由哪些离子转化而来?②反应方程式怎么写最简单明了?抢答分组讨论:①生成了什么新物质?由哪些离子转化而来?②反应方程式怎么写最简单明了?← Ca2++CO32-CaCO3↓Ca2++CO32-=CaCO3↓探究实验三.离子方程式用四个字总结离子方程式的书写步骤;
并以Na2CO3与HCl的反应为例,解释
每一个步骤。用实际参加反应的离子符号表示离子反应的式子叫离子方程式。1.书写三.离子方程式用实际参加反应的离子符号表示离子反应的式子叫离子方程式。1.书写:写、拆、删、查三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;④检查原子和电荷是否相等三.离子方程式1.书写① CaCO3
②HClO
③Na2SO4①BaSO4
②Ba(OH)2
③ Cu(OH)2①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;④检查原子和电荷是否相等三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。思考:离子方程式是否只能表示一个具体的反应?三.离子方程式1.书写H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式三.离子方程式1.书写H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式三.离子方程式三.离子方程式1.书写H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式三.离子方程式1.书写三.离子方程式分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。H+ + OH- == H2O表示可溶性的强酸、强碱生成可溶性盐的反应。小 结小结强弱电解质
电离特点
包含的物质
离子反应的发生条件
离子方程式
书写步骤
表达意义 常见离子反应多在水溶液中进行。除常见的复分解反应外,还有氧化还原、盐类水解、络合等类型。
极浓的电解质跟固态物质反应时,有时并不属于离子反应,例如浓硫酸跟铜反应时,表现的是硫酸分子的氧化性,故不属于离子反应。
此外,很多电解质在熔融状态也能发生离子反应。课后巩固作业分步写出下列反应的离子方程式:
1、Na2SO4与BaCl2反应;
2、CaCO3与稀盐酸反应;
3、Na2CO3与稀硫酸反应;
4、CuO与硝酸反应;
5、Zn与稀硫酸反应。课堂延伸再见
第二单元:钠、镁及其化合物风霜雨雪,大江大泽,云卷云舒。望蓝色星球,
万千生灵,应水而生,新陈代谢,凭电离物——
酸碱盐水,
更有金属氧化物。
溶或熔,
电解质导电,
属化合物。 沁园春Cl-Cl-Cl-H+H+Cl-H+H+H+Cl-HCl电离CH3COOH电离CH3COOHCH3COOHH+CH3COOHCH3COOHCH3COO-CH3COOHCH3COOHCH3COOH一.强、弱电解质一.强、弱电解质一.强、弱电解质完全电离离子强酸、强碱、大多数盐一.强、弱电解质一.强、弱电解质完全电离离子强酸、强碱、大多数盐完全电离部分电离离子多数分子、少数离子强酸、强碱、大多数盐弱酸、弱碱、水一.强、弱电解质常见酸碱的强弱强酸:HNO3、H2SO4、 HCl等
强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等弱酸:CH3COOH(醋酸)、H2CO3、H2SO3、HClO等
弱碱:NH3·H2O(一水合氨)、Mg(OH)2、Fe(OH)3、 ggggggCu(OH)2 等二.离子反应有离子参加的化学反应。本质:离子浓度发生改变,一般为下降。发生条件:NaOH+NH4Cl=NaCl+NH3·H2ONO3-Na+Na+ NO3-Ag+Cl-→AgCl↓生成沉淀、气体、难电离物质
(复分解反应) 。二.离子反应有离子参加的化学反应。发生条件:NaOH+NH4Cl=NaCl+NH3·H2O二.离子反应发生条件:NaOH+NH4Cl=NaCl+NH3·H2O生成难溶物、易挥发物、难电离物质,或发生氧化还原反应。二.离子反应发生条件:NaOH+NH4Cl=NaCl+NH3·H2O生成难溶物、易挥发物、难电离物质,或发生氧化还原反应。探究实验各取一滴管至一试管中分组讨论:① 生成了什么新物质?由哪些离子转化而来?②反应方程式怎么写最简单明了?抢答分组讨论:①生成了什么新物质?由哪些离子转化而来?②反应方程式怎么写最简单明了?← Ca2++CO32-CaCO3↓Ca2++CO32-=CaCO3↓探究实验三.离子方程式用四个字总结离子方程式的书写步骤;
并以Na2CO3与HCl的反应为例,解释
每一个步骤。用实际参加反应的离子符号表示离子反应的式子叫离子方程式。1.书写三.离子方程式用实际参加反应的离子符号表示离子反应的式子叫离子方程式。1.书写:写、拆、删、查三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;三.离子方程式1.书写①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;④检查原子和电荷是否相等三.离子方程式1.书写① CaCO3
②HClO
③Na2SO4①BaSO4
②Ba(OH)2
③ Cu(OH)2①写化学方程式;②将强酸、强碱、可溶盐拆成离子;③删去等号两边重复的离子;④检查原子和电荷是否相等三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式三.离子方程式1.书写分步完成HCl与NaOH,H2SO4与KOH反应的离子方程式H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。思考:离子方程式是否只能表示一个具体的反应?三.离子方程式1.书写H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式三.离子方程式1.书写H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式三.离子方程式三.离子方程式1.书写H+ + OH- == H2O2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式三.离子方程式1.书写三.离子方程式分步写出Cu(OH)2与HCl,H2SO4与Ba(OH)2反应的离子方程式2.意义:离子方程式不仅可表示某个离子反应,而且可表示所有同一类型的离子反应。H+ + OH- == H2O表示可溶性的强酸、强碱生成可溶性盐的反应。小 结小结强弱电解质
电离特点
包含的物质
离子反应的发生条件
离子方程式
书写步骤
表达意义 常见离子反应多在水溶液中进行。除常见的复分解反应外,还有氧化还原、盐类水解、络合等类型。
极浓的电解质跟固态物质反应时,有时并不属于离子反应,例如浓硫酸跟铜反应时,表现的是硫酸分子的氧化性,故不属于离子反应。
此外,很多电解质在熔融状态也能发生离子反应。课后巩固作业分步写出下列反应的离子方程式:
1、Na2SO4与BaCl2反应;
2、CaCO3与稀盐酸反应;
3、Na2CO3与稀硫酸反应;
4、CuO与硝酸反应;
5、Zn与稀硫酸反应。课堂延伸再见
