人教版初中化学九年级下册 第八单元课题3 金属资源的利用和保护(第2课时) 同步测试
文档属性
| 名称 | 人教版初中化学九年级下册 第八单元课题3 金属资源的利用和保护(第2课时) 同步测试 |  | |
| 格式 | zip | ||
| 文件大小 | 302.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-02-21 22:42:51 | ||
图片预览

文档简介
课题3 金属资源的利用和保护(第2课时) 同步测试
1.世界每年因锈蚀而损失的金属数量巨大,防止金属锈蚀已成为科学研究中的重大问题。下列有关金属锈蚀与保护措施中不正确的是( )
A.铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学反应
B.同样的铁制品在海南比在兰州更容易锈蚀
C.在铁表面刷油漆可以防止铁生锈
D.铝的抗锈蚀性能比铁强,生活中可用钢丝球洗刷铝锅
2.下列防锈措施合理的是( )
A.经常用水冲洗自行车链条
B.在铁制暖气片上刷“银粉”
C.用“钢丝球”打磨铝锅表面
D.用过的菜刀及时用盐水清洗
3.小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭。他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe。其中猜想合理的是( )
A.①③⑤ B.②④⑤
C.②⑤ D.④⑤
4.下列有关金属的说法错误的是( )
A.金属具有金属光泽,常温下金属都是固体
B.生铁和钢是含碳量不同的铁合金,其中生铁的含碳量大于钢的含碳量
C.炒完菜后,应及时除掉锅底的水,这样可以防止铁锅生锈
D.金属的回收利用是保护金属资源的有效途径之一
5.铁制品在通常情况下很易生锈,制造时往往在铁制品表面电镀一层铜起防锈作用。下列说法正确的是( )
A.镀铜铁制品不可以在弱酸性条件下使用
B.镀铜铁制容器可盛硝酸银溶液
C.镀铜铁制品不易生锈的原因之一是使铁隔绝了空气
D.镀铜铁制品是一种合金
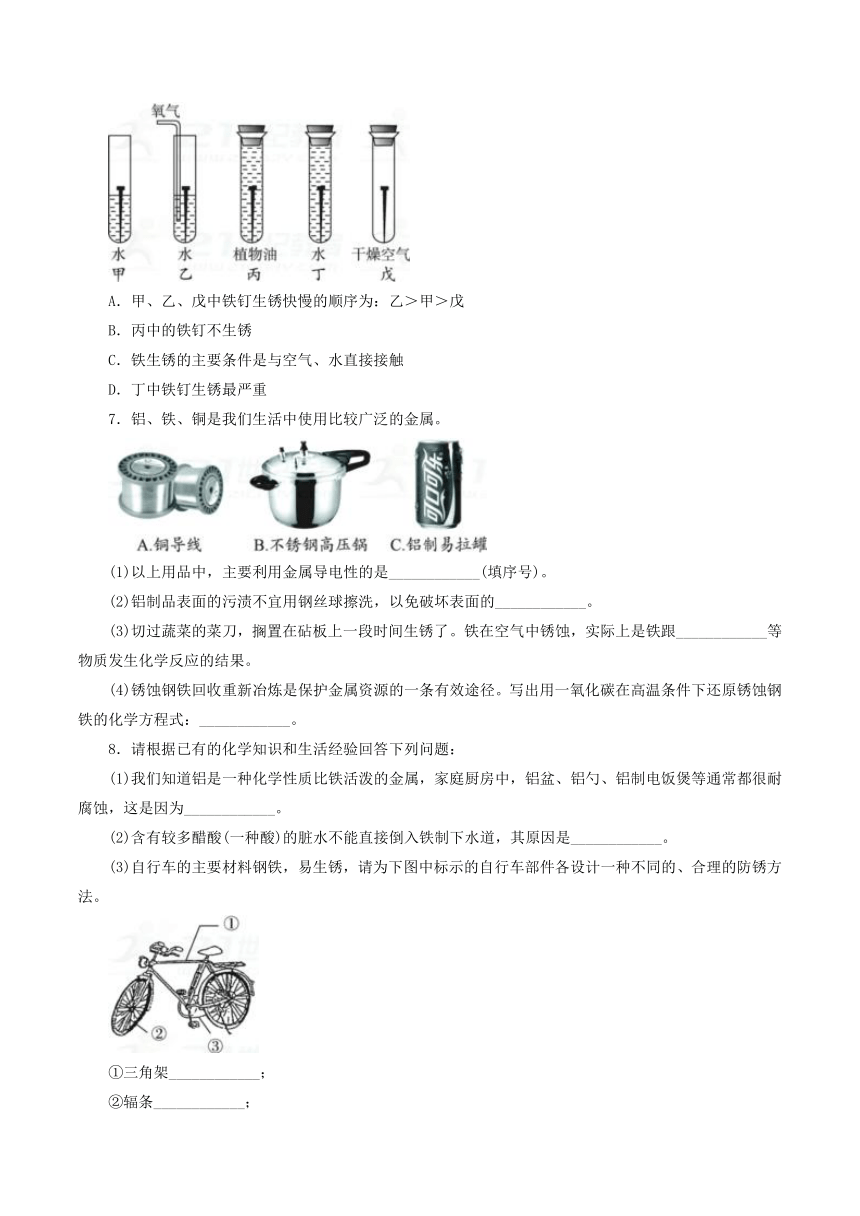
6.下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是( )
A.甲、乙、戊中铁钉生锈快慢的顺序为:乙>甲>戊
B.丙中的铁钉不生锈
C.铁生锈的主要条件是与空气、水直接接触
D.丁中铁钉生锈最严重
7.铝、铁、铜是我们生活中使用比较广泛的金属。
(1)以上用品中,主要利用金属导电性的是____________(填序号)。
(2)铝制品表面的污渍不宜用钢丝球擦洗,以免破坏表面的____________。
(3)切过蔬菜的菜刀,搁置在砧板上一段时间生锈了。铁在空气中锈蚀,实际上是铁跟____________等物质发生化学反应的结果。
(4)锈蚀钢铁回收重新冶炼是保护金属资源的一条有效途径。写出用一氧化碳在高温条件下还原锈蚀钢铁的化学方程式:____________。
8.请根据已有的化学知识和生活经验回答下列问题:
(1)我们知道铝是一种化学性质比铁活泼的金属,家庭厨房中,铝盆、铝勺、铝制电饭煲等通常都很耐腐蚀,这是因为____________。
(2)含有较多醋酸(一种酸)的脏水不能直接倒入铁制下水道,其原因是____________。
(3)自行车的主要材料钢铁,易生锈,请为下图中标示的自行车部件各设计一种不同的、合理的防锈方法。
①三角架____________;
②辐条____________;
③链条____________。
9.要节约和合理利用资源,提倡建设资源节约型社会。矿物储量有限,而且不可再生。根据已探明的一些矿物的储藏量,并根据目前这些金属的消耗速度,科学家初步估计一些矿物可开采年限如下图所示:
(1)观察上图,请你推测21世纪金属资源的情况:
________________________________________________。
(2)请你联系实际,作为时代的主人,看了上图后,你有哪些感悟:
________________________________________________________________________。
(3)请你提出一条节约金属资源的建议:____________________________________。
10.铁锅、铝锅是生活中常用的炊具,下图是铁锅的示意图。
(1)铁锅含有的金属单质___________(写化学式)。
(2)炒菜时铁锅中的油着火可用锅盖盖灭,其原理是________________________。
(3)铝锅轻便、耐用,其原因是________________________。
(4)废旧铁锅、铝锅不要随意丢弃,应回收利用,这样做的意义是____________________。
探究创新
11.某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
(1)用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管___________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
②试管D和E实验的目的是进一步探究铁在___________________的环境中是否更容易锈蚀。
③为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。这是因为合金与纯金属相比,其组成和内部组织结构发生变化,从而引起___________的变化。
(2)某同学向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱。有的同学认为这种方案不够合理,理由是____________________________________________。
(3)将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是___________,且反应后溶液质量比反应前___________(选填“增大”“减小”或“不变”)。
【参考答案】
1.D
2.B 经常用水冲洗自行车链条会加快链条的生锈速度,A错;在铁制暖气片上刷“银粉”(其实是铝粉)会隔绝氧气和水,防止暖气片生锈,B对;铝的表面有一层致密的氧化膜,保护内部的铝不被氧化,用“钢丝球”打磨铝锅表面会将这层氧化膜破坏,B错;铁在接触了酸和盐的条件下生锈速度会加快,故用过的菜刀不能用盐水清洗,要用清水洗干净,并擦干挂在通风处,D错。
3.C 铁生锈时消耗氧气、水,故铁粉可以作为食品包装中的干燥剂和脱氧剂。铁生锈时生成红色物质Fe2O3。因为脱氧剂中含有铁粉和活性炭,活性炭是疏松剂,不参与化学反应,故小明发现的月饼盒里的物质一定含Fe2O3和C,还可能含有Fe。
4.A 常温下,金属不都是固体,如汞在常温下就是液体;一般来说,生铁是含碳量在2%~4.3%的铁碳合金,钢是含碳量在0.03%~2%的铁碳合金;铁生锈是铁与氧气、水发生反应的结果,及时除掉锅底的水,可以防止铁锅生锈;保护金属资源的途径有:防止金属腐蚀,金属的回收和再利用,有计划、合理地开采矿物等。
5.C 铜的金属活动性排在氢后面,一般不与酸反应,故镀铜铁制品可以在弱酸性环境中使用,A错误;铜的金属活动性排在银的前面,能与硝酸银溶液反应,故镀铜铁制容器不可盛硝酸银溶液,B错误;铜覆盖在铁的表面可阻止铁与水、氧气接触,以避免铁生锈,C正确;铜只是覆盖在铁的表面,并没有与铁熔合,故镀铜铁制容器不属于合金,D错误。
6.D 乙中的铁钉与水和氧气充分接触,生锈最快;甲中的铁钉与水接触,且在液面以上的部分与空气接触,也可生锈;戊中的铁钉没有与水接触,生锈最慢,A正确。丙中的铁钉浸泡在植物油中,隔绝了水和氧气,不生锈,B正确。铁生锈是铁与氧气和水发生的复杂化学变化,C正确。丁与氧气隔绝,基本不生锈,D错误。
7.答案:(1)A
(2)氧化膜
(3)空气中的水蒸气和氧气
(4)Fe2O3+3CO2Fe+3CO2
解析:(1)用铜制成导线利用了金属的导电性;不锈钢高压锅主要利用了金属的导热性;铝制易拉罐主要利用了金属的延展性。(2)铝制品表面有一层氧化膜,具有保护作用。用钢丝球擦洗,会破坏这层氧化膜。(3)铁生锈是铁与空气中的水蒸气和氧气等物质发生化学反应的结果。(4)一氧化碳在高温条件下还原锈蚀钢铁(主要成分Fe2O3)的化学方程式:Fe2O3+3CO2Fe+3CO2。
8.答案:(1)铝在常温下与氧气反应生成致密的氧化铝薄膜,阻止了铝和氧气进一步接触,所以铝制品比较耐腐蚀
(2)酸能与铁发生化学反应,会腐蚀下水道
(3)①涂漆 ②镀一层耐腐蚀的金属 ③涂油
解析:(1)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此,铝制品具有很好的抗腐蚀性能。(2)酸能与铁反应而腐蚀铁制下水道。(3)要注意自行车的部位不同,防锈的方法也不同。
9.答案:(1)21世纪有些金属资源将面临枯竭
(2)金属资源并非取之不尽,用之不竭,我们应合理开采和利用金属资源
(3)回收再利用废旧金属;设法防止金属腐蚀;寻找金属的替代品等
解析:本题是一道开放性题目,答案合理即可。试题以图表的形式给我们展示了常见金属的使用年限,在解答问题的同时,也增强了我们保护金属资源的意识。
10.答案:(1)Fe
(2)使油与氧气隔绝
(3)铝的密度小 常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化
(4)减少环境污染,节约金属资源
11.答案:(1)①ABC ②盐、酸存在 ③性质
(2)没控制相同条件,金属的表面积不同
(3)铜 减小
解析:(1)②D中是食盐的水溶液,E是食醋的水溶液,故目的是进一步探究铁在盐和酸的环境中的锈蚀情况。③通常情况下,合金比纯金属有较强的抗腐蚀性,原因是添加了抗腐蚀元素而改变了金属的内部结构,从而改变了金属的性质。(2)酸的质量和质量分数相等,金属与酸反应,接触面积越大反应速率越快,但是没有控制金属的表面积相同。(3)铁比铜活泼,锌比铁活泼,故一定能置换出铜,固体中一定含有铜。溶液质量的变化要通过化学方程式进行计算。每56份质量的铁能置换出64份质量的铜,故溶液总质量减小。
1.世界每年因锈蚀而损失的金属数量巨大,防止金属锈蚀已成为科学研究中的重大问题。下列有关金属锈蚀与保护措施中不正确的是( )
A.铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学反应
B.同样的铁制品在海南比在兰州更容易锈蚀
C.在铁表面刷油漆可以防止铁生锈
D.铝的抗锈蚀性能比铁强,生活中可用钢丝球洗刷铝锅
2.下列防锈措施合理的是( )
A.经常用水冲洗自行车链条
B.在铁制暖气片上刷“银粉”
C.用“钢丝球”打磨铝锅表面
D.用过的菜刀及时用盐水清洗
3.小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭。他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe。其中猜想合理的是( )
A.①③⑤ B.②④⑤
C.②⑤ D.④⑤
4.下列有关金属的说法错误的是( )
A.金属具有金属光泽,常温下金属都是固体
B.生铁和钢是含碳量不同的铁合金,其中生铁的含碳量大于钢的含碳量
C.炒完菜后,应及时除掉锅底的水,这样可以防止铁锅生锈
D.金属的回收利用是保护金属资源的有效途径之一
5.铁制品在通常情况下很易生锈,制造时往往在铁制品表面电镀一层铜起防锈作用。下列说法正确的是( )
A.镀铜铁制品不可以在弱酸性条件下使用
B.镀铜铁制容器可盛硝酸银溶液
C.镀铜铁制品不易生锈的原因之一是使铁隔绝了空气
D.镀铜铁制品是一种合金
6.下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是( )
A.甲、乙、戊中铁钉生锈快慢的顺序为:乙>甲>戊
B.丙中的铁钉不生锈
C.铁生锈的主要条件是与空气、水直接接触
D.丁中铁钉生锈最严重
7.铝、铁、铜是我们生活中使用比较广泛的金属。
(1)以上用品中,主要利用金属导电性的是____________(填序号)。
(2)铝制品表面的污渍不宜用钢丝球擦洗,以免破坏表面的____________。
(3)切过蔬菜的菜刀,搁置在砧板上一段时间生锈了。铁在空气中锈蚀,实际上是铁跟____________等物质发生化学反应的结果。
(4)锈蚀钢铁回收重新冶炼是保护金属资源的一条有效途径。写出用一氧化碳在高温条件下还原锈蚀钢铁的化学方程式:____________。
8.请根据已有的化学知识和生活经验回答下列问题:
(1)我们知道铝是一种化学性质比铁活泼的金属,家庭厨房中,铝盆、铝勺、铝制电饭煲等通常都很耐腐蚀,这是因为____________。
(2)含有较多醋酸(一种酸)的脏水不能直接倒入铁制下水道,其原因是____________。
(3)自行车的主要材料钢铁,易生锈,请为下图中标示的自行车部件各设计一种不同的、合理的防锈方法。
①三角架____________;
②辐条____________;
③链条____________。
9.要节约和合理利用资源,提倡建设资源节约型社会。矿物储量有限,而且不可再生。根据已探明的一些矿物的储藏量,并根据目前这些金属的消耗速度,科学家初步估计一些矿物可开采年限如下图所示:
(1)观察上图,请你推测21世纪金属资源的情况:
________________________________________________。
(2)请你联系实际,作为时代的主人,看了上图后,你有哪些感悟:
________________________________________________________________________。
(3)请你提出一条节约金属资源的建议:____________________________________。
10.铁锅、铝锅是生活中常用的炊具,下图是铁锅的示意图。
(1)铁锅含有的金属单质___________(写化学式)。
(2)炒菜时铁锅中的油着火可用锅盖盖灭,其原理是________________________。
(3)铝锅轻便、耐用,其原因是________________________。
(4)废旧铁锅、铝锅不要随意丢弃,应回收利用,这样做的意义是____________________。
探究创新
11.某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
(1)用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管___________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
②试管D和E实验的目的是进一步探究铁在___________________的环境中是否更容易锈蚀。
③为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。这是因为合金与纯金属相比,其组成和内部组织结构发生变化,从而引起___________的变化。
(2)某同学向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱。有的同学认为这种方案不够合理,理由是____________________________________________。
(3)将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是___________,且反应后溶液质量比反应前___________(选填“增大”“减小”或“不变”)。
【参考答案】
1.D
2.B 经常用水冲洗自行车链条会加快链条的生锈速度,A错;在铁制暖气片上刷“银粉”(其实是铝粉)会隔绝氧气和水,防止暖气片生锈,B对;铝的表面有一层致密的氧化膜,保护内部的铝不被氧化,用“钢丝球”打磨铝锅表面会将这层氧化膜破坏,B错;铁在接触了酸和盐的条件下生锈速度会加快,故用过的菜刀不能用盐水清洗,要用清水洗干净,并擦干挂在通风处,D错。
3.C 铁生锈时消耗氧气、水,故铁粉可以作为食品包装中的干燥剂和脱氧剂。铁生锈时生成红色物质Fe2O3。因为脱氧剂中含有铁粉和活性炭,活性炭是疏松剂,不参与化学反应,故小明发现的月饼盒里的物质一定含Fe2O3和C,还可能含有Fe。
4.A 常温下,金属不都是固体,如汞在常温下就是液体;一般来说,生铁是含碳量在2%~4.3%的铁碳合金,钢是含碳量在0.03%~2%的铁碳合金;铁生锈是铁与氧气、水发生反应的结果,及时除掉锅底的水,可以防止铁锅生锈;保护金属资源的途径有:防止金属腐蚀,金属的回收和再利用,有计划、合理地开采矿物等。
5.C 铜的金属活动性排在氢后面,一般不与酸反应,故镀铜铁制品可以在弱酸性环境中使用,A错误;铜的金属活动性排在银的前面,能与硝酸银溶液反应,故镀铜铁制容器不可盛硝酸银溶液,B错误;铜覆盖在铁的表面可阻止铁与水、氧气接触,以避免铁生锈,C正确;铜只是覆盖在铁的表面,并没有与铁熔合,故镀铜铁制容器不属于合金,D错误。
6.D 乙中的铁钉与水和氧气充分接触,生锈最快;甲中的铁钉与水接触,且在液面以上的部分与空气接触,也可生锈;戊中的铁钉没有与水接触,生锈最慢,A正确。丙中的铁钉浸泡在植物油中,隔绝了水和氧气,不生锈,B正确。铁生锈是铁与氧气和水发生的复杂化学变化,C正确。丁与氧气隔绝,基本不生锈,D错误。
7.答案:(1)A
(2)氧化膜
(3)空气中的水蒸气和氧气
(4)Fe2O3+3CO2Fe+3CO2
解析:(1)用铜制成导线利用了金属的导电性;不锈钢高压锅主要利用了金属的导热性;铝制易拉罐主要利用了金属的延展性。(2)铝制品表面有一层氧化膜,具有保护作用。用钢丝球擦洗,会破坏这层氧化膜。(3)铁生锈是铁与空气中的水蒸气和氧气等物质发生化学反应的结果。(4)一氧化碳在高温条件下还原锈蚀钢铁(主要成分Fe2O3)的化学方程式:Fe2O3+3CO2Fe+3CO2。
8.答案:(1)铝在常温下与氧气反应生成致密的氧化铝薄膜,阻止了铝和氧气进一步接触,所以铝制品比较耐腐蚀
(2)酸能与铁发生化学反应,会腐蚀下水道
(3)①涂漆 ②镀一层耐腐蚀的金属 ③涂油
解析:(1)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此,铝制品具有很好的抗腐蚀性能。(2)酸能与铁反应而腐蚀铁制下水道。(3)要注意自行车的部位不同,防锈的方法也不同。
9.答案:(1)21世纪有些金属资源将面临枯竭
(2)金属资源并非取之不尽,用之不竭,我们应合理开采和利用金属资源
(3)回收再利用废旧金属;设法防止金属腐蚀;寻找金属的替代品等
解析:本题是一道开放性题目,答案合理即可。试题以图表的形式给我们展示了常见金属的使用年限,在解答问题的同时,也增强了我们保护金属资源的意识。
10.答案:(1)Fe
(2)使油与氧气隔绝
(3)铝的密度小 常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化
(4)减少环境污染,节约金属资源
11.答案:(1)①ABC ②盐、酸存在 ③性质
(2)没控制相同条件,金属的表面积不同
(3)铜 减小
解析:(1)②D中是食盐的水溶液,E是食醋的水溶液,故目的是进一步探究铁在盐和酸的环境中的锈蚀情况。③通常情况下,合金比纯金属有较强的抗腐蚀性,原因是添加了抗腐蚀元素而改变了金属的内部结构,从而改变了金属的性质。(2)酸的质量和质量分数相等,金属与酸反应,接触面积越大反应速率越快,但是没有控制金属的表面积相同。(3)铁比铜活泼,锌比铁活泼,故一定能置换出铜,固体中一定含有铜。溶液质量的变化要通过化学方程式进行计算。每56份质量的铁能置换出64份质量的铜,故溶液总质量减小。
同课章节目录
