华师大版九年级下化学实验题复习(浙江省宁波市海曙区)
文档属性
| 名称 | 华师大版九年级下化学实验题复习(浙江省宁波市海曙区) | 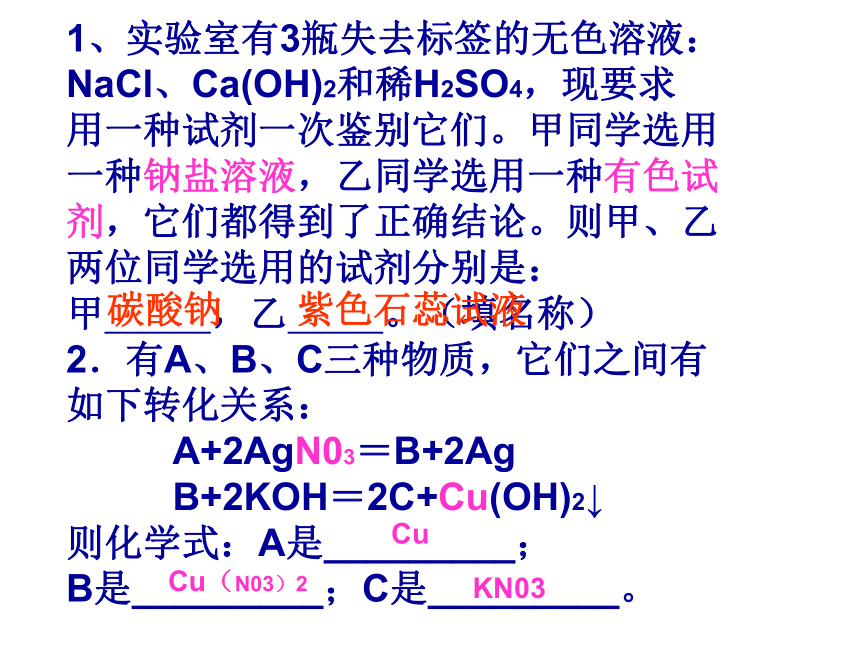 | |
| 格式 | rar | ||
| 文件大小 | 275.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2007-12-29 22:19:00 | ||
图片预览







文档简介
课件21张PPT。1、实验室有3瓶失去标签的无色溶液:
NaCl、Ca(OH)2和稀H2SO4,现要求
用一种试剂一次鉴别它们。甲同学选用
一种钠盐溶液,乙同学选用一种有色试
剂,它们都得到了正确结论。则甲、乙
两位同学选用的试剂分别是:
甲 ,乙 。(填名称)
2.有A、B、C三种物质,它们之间有
如下转化关系:
A+2AgN03=B+2Ag
B+2KOH=2C+Cu(OH)2↓
则化学式:A是_________;
B是_________;C是_________。碳酸钠紫色石蕊试液Cu(N03)2CuKN03无色溶液
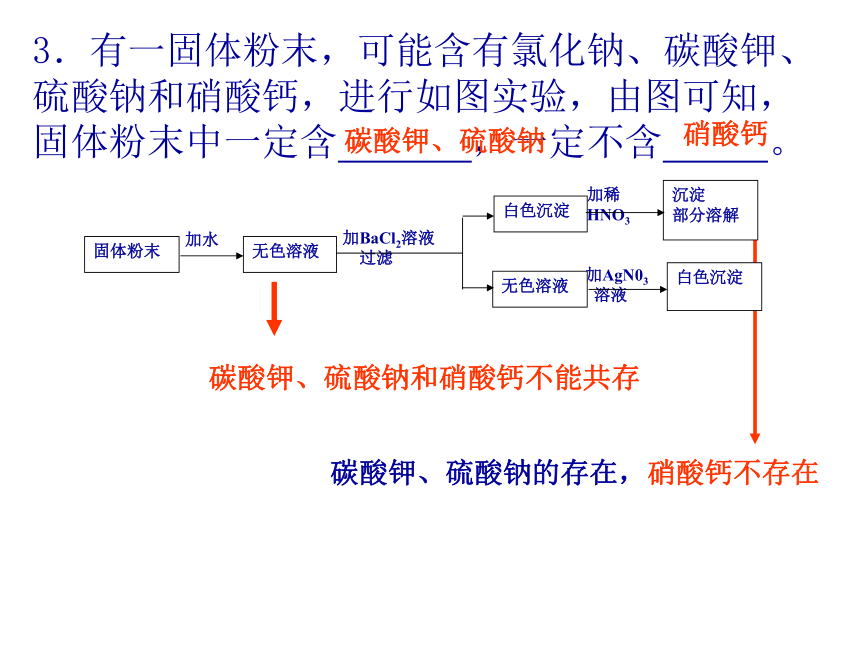
3.有一固体粉末,可能含有氯化钠、碳酸钾、
硫酸钠和硝酸钙,进行如图实验,由图可知,
固体粉末中一定含 ,一定不含 。碳酸钾、硫酸钠和硝酸钙不能共存碳酸钾、硫酸钠的存在,硝酸钙不存在硝酸钙碳酸钾、硫酸钠4.2004年初春,我国某些地区出现了高致病性禽流感,
为防止疫情蔓延,必须迅速进行隔离,并对受禽流感病
毒污染的禽舍、工具等进行消毒。资料显示:
禽流感病毒在高温、碱性环境(如氢氧化钠溶液)、高锰酸钾
或次氯酸钠等消毒剂中生存能力较差。请回答:
(1)次氯酸钠(NaClO)属于__________
(填“氧化物”、“酸”、“碱”或“盐”)
(2)用加热高锰酸钾熏蒸消毒禽舍,
写出所发生反应的化学方程式
_______________________________
(3)以下对受污染工具的消毒方法可行
的是_________ (填序号),
A.用NaOH溶液浸泡 B.用水冲洗即可
C.用NaClO溶液浸泡盐AC5.在托盘天平的左、右两盘上各放1只烧杯,分别注入等质量
且溶质质量分数相同的稀盐酸,调整天平平衡。向左盘烧杯中
投入一定质量的CaCO3粉末,向右盘烧杯中投入与CaCO3等
质量的MgCO3粉末,,充分反应。
(1)若反应后天平失去平衡,那么,天平的指针一定偏向___
(填“左”或“右”)。
(2)若反应后天平仍保持平衡,其理由是_________________
_______左分析:此题有两种可能
(1)稀盐酸不足
(2)稀盐酸足量天平失去平衡因为CaCO3,MgCO3式量不同
相同质量的它们产生CO2质量不同.根据HCL反应后天平仍保持平衡盐酸的量不够或
碳酸盐有剩余CaCO3+2HCl=CaCl2+H2O+CO2↑
MgCO3+2HCl=MgCl2+H2O+CO2↑6.在实验室中,张明、苏红两位同学欲测定碳酸钙样品中碳酸钙
的质量分数,分别设计两个方案。(设杂质不和盐酸反应,受热也
不分解)
张明的方案:①称取一定量的碳酸钙样品;②用酒精灯加热样品,
直到质量不再改变;③在干燥的容器中将固体残渣物冷却后称量;
④计算。
苏红的方案:①称取一定量的碳酸钙样品;②加过量的盐酸使之
完全反应;③向反应后的溶液中加入适量的氢氧化钠溶液,恰好
中和过量的盐酸;④计算。回答下列问题:
(1)张明为什么要加热样品直到质量不再改变为止?
(2)张明的方案中为什么要将固体残留物放在干燥的容器中冷却?
(3)写出碳酸钙和盐酸反应的化学方程式:
(4)苏红的方案中,加入过量盐酸的目的是
(5)苏红的方案中,欲测定样品中碳酸钙的质量分数,
在实验过程中需记录哪些数据?
(6)综合上述,你认为张明和苏红方案中,
切实可行的方案是 的方案,
不采用另一方案的理由是 。使碳酸钙完全分解 防止CaO吸收水分 CaCO3+2HCl=CaCl2+H2O+CO2↑ 使碳酸钙完全反应 反应前样品质量、盐酸质量(带烧杯)、
反应后烧杯的总质量苏红 碳酸钙分解需要高温条件,在实验室中进行较困难7、赵刚为了了解生活中常见的锌锰干电池,做了以下探究。
他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;
②电极周围充满黑色粉末;③里面有少量无色晶体;④金属
外壳明显破损。
赵刚查阅了资料:锌锰电池是以中心的碳棒(石墨)做正极,
外围的锌筒做负极,锌筒与碳棒之间填满氯化铵溶液(做电解质)
拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用。
在电池的使用中,锌逐渐变成了氯化锌。
请你根据初中学习的知识和赵刚的探究活动,填写以下空白。
⑴.用碳棒做电极主要利用了石墨的_ __性。
⑵.以氯化锌为例,写出证明废电池内含有氯离子的
化学方程式:______________。
⑶.通过回收废旧锌锰干电池可得到的物质
有______________(只要填一种)。
⑷.将锌锰电池中的二氧化锰加入双氧水中发现产生气泡
的速度加快,此时二氧化锰所的作用是______________作用导电性 ZnCl2+AgNO3===Zn(NO3)2+2AgCl↓ 石墨等 催化 8.请你参与某学习小组的探究活动,并回答相关问题:
[发现问题]单丽发现盛水的铁锅在与水面接触的部位最易生锈;
李茜发现自己的铜制眼框表面出现了绿色的铜锈;翁玲发现苹果切开不久,
果肉上会产生一层咖啡色物质,好象生了“锈”一般。
[提出问题]这三种物质“生锈”的原因是什么?
[收集证据](1)回忆已有知识:铁生锈的条件等。
(2)查阅有关资料:“铜锈”主要成分是
Cu2(OH)2CO3(俗称铜绿);苹果“生锈”是果肉里的物质
(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质。
(3)实验探究:将四小块铜片分别按下图所示放置一个月,
观察现象如下:[得出结论] 经过实验和交流讨论,三位同学认为这些物质“生锈”除了可能
与水有关外,还可能都与 、 (填物质名称)有关。
[反思与应用]利用所得结论填空:
(1)写出一种防止铁或铜等金属制品生锈的具体方法 ;
(2)请你提出一条延长食品保质期的建议__________________
氧气,二氧化碳 刷油漆 将食品进行真空包装等9、一张洁白干燥的滤纸上,依次喷洒 A、B、C三种无色液体。
当喷洒 A时,滤纸上无明显变化;再喷洒B时,滤纸上出现一
只红色小猫(如右图一);最后喷洒C时,小猫渐渐消失。
回答下列问题:滤纸上的小猫可能是用???___??????? 画的。
无色液体A是? ????????? , B是??????????? , C是???????????????????? 。10、如下图二所示,在试管和小气球中分别先
加入稀硫酸和一种常见的固体物质,然后将气球
中的固体倒入试管中,观察到有气泡产生且气球
胀大。请依据上述实验回答下列问题:
气球中加入的固体物质可能是(至少答出两种不
同类型的物质) 。
(2)请用简单的实验方法,证明制得气体的密度
比空气大还是小。 。水 烧碱 盐酸 无色酚酞 从满后的气球放于空中看浮沉碳酸钙或锌片11、如图所示,弹簧秤下挂着一重物A,烧杯中盛有
溶液B,试根据要求回答下列问题:
(1)若A为铁块,B为稀硫酸,则将A放入B中,
过一会儿,弹簧秤的读数将_____(填“变大”、“变小”
或“不变”,下同)
(2)若A为铁块,B为硫酸铜溶液,则将A放入B中,
过一会儿,弹簧秤的读数将
___________.12、厨房的两个调料瓶中分别盛有精盐(NaCl)、
碱面(Na2CO3)两种固体,请你利用所学的知识列出两种不同
的方法将它们区别开,简要写出操作步骤、现象和结论。
(1)_____________________________________________
(2)________________________________________________ 变大 变小分别加入石灰水有白色沉淀的是碱面
分别加入CH3COOH有气泡的是碱面13、在一次化学探究活动中,晓琴同学无意中发现,
两种无色溶液混合后,能产生一种白色沉淀。⑴从无色溶液着
研究,若有一种是稀硫酸,则白色沉淀是________________,
其化学方程式是_______________________________________。
⑵从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,
则白色沉淀的可能是_____________________,
其化学方程式是 __________________________。14、NO和NO2具有下列不同的性质:
通常情况下,NO是无色气体,微溶于水;NO2是棕色气体,
易溶于水。并能发生下列化学反应:3NO2+H2O=2HNO3+NO
如右图将一支充满NO2棕色气体的试管倒立在烧杯中(水中已预
先加入数滴石蕊试液)。试分别描述实验现象:(至少写二点)
⑴_____________________________________________;
⑵_____________________________________________。BaSO4; BaCl2+H2SO4 = BaSO4↓+2HClBaCO3+2HNO3 = Ba(NO3)2+H2O+CO2↑BaCO3;烧杯中液体由紫色变成红色;⑵试管内液面上升(试管内气体由棕色变为无色)15、在一次实验课上,老师让同学们进行探究实验。
目的:探究氢氧化钠溶液中是哪一种粒子能使无色酚酞试液变色。
猜想:可能是水分子,钠离子或氢氧根离子使无色酚酞试液变色。
实验:
⑴在第一支试管中加入约2毫升蒸馏水,滴入几滴无色酚酞试液。
现象:溶液不变色;
⑵ 在第二支试管中加入2毫升氯化钠溶液,滴入几滴无色酚酞试液。
现象:溶液不变色;
⑶ 在第三支试管中加入2毫升氢氧化钠溶液,
滴入几滴无色酚酞试液。现象: 。
结论:在氢氧化钠溶液中,是 使无色酚酞试液变色。 溶液由无色变成红色 。 氢氧根离子使无色酚酞试液变色。 17、160年前,鸦片——曾使中国面临“亡国灭种”危险,民族
英雄林则徐坚决领导了禁烟斗争……
他们先把鸦片投入到盐卤池中浸泡、溶解,再投入生石灰,
倾刻间池中沸腾,烟土随之湮灭。池中生石灰与水反应
的化学方程式___________________;“倾刻间池中沸腾”
说明此反应过程会(填“吸收”或“放出”)___________大量热。16、有A、B、C三种失去标签的无色溶液,它们是稀硫酸、
稀盐酸和稀硝酸。分别取少量三种溶液各加入几滴氯化钡溶液,
只有C出现白色沉淀。另取A、B两种溶液各加入几滴硝酸银溶液,
只有B产生白色沉淀。
由此可得A是______________;B是______________;
C是______________。稀硝酸稀盐酸稀硫酸。放出CaO +H2O = Ca(OH)218、张强从菜场买了一些鸡蛋,放入水中煮,发现有的鸡蛋
破裂有的不破裂,他感到好奇,做如下的探究实验:
⑴分别将破裂的蛋的壳和不破裂的蛋的壳洗净、烘干、研碎
⑵分别称取等质量的两种蛋壳,分别加入到足量相等的稀盐酸中
⑶将产生的气体分别通入足量的澄清石灰水中
⑷将生成的沉淀分别过滤、洗净、烘干、称量,请回答:
探究实验第⑶步发生的化学反应的
方程式是____________________________,
这个探究实验的目的是比较________________Ca(OH)2+CO2==CaCO3+H2O两种蛋壳中的碳酸钙的含量19、某物质A,属于氧化物、酸、碱、盐中的某一类化合物。
为了确定它,作了如下实验:将A溶于水,得无色透明溶液,
向溶液中滴入酚酞试液,溶液呈红色。向上述红色溶液中加
入适量的物质B的溶液,溶液的红色消失,并生成白色沉淀C。
再加入稀硝酸,C不溶解。
试推断:物质A是___________,B是____________,
C是__________。H2SO4Ba(OH)2BaSO4 20、实验室采取了如下图所示的一种装置来研究种子
发芽所需的条件,并将它置于适宜的温室
(25 ℃~35 ℃)环境中培养。几天后,发现位于水面以上与位于水面以下的种
子都没有发芽,只有位于水面处的种子发芽了,
并且可以观察到小试管中的澄清石灰水变浑浊了。由此说明:
(1)种子发芽所需要的条件是 。
(2)小试管中澄清石灰水变浑浊的原因是:
____________________________________。
(3)U形管中放入的NaOH和CaO固体混合物的作用是:
________________________。 有充足的氧气和水分萌发的种子呼吸作用放出CO2与石灰水反应生成难溶的碳酸钙 防止空气中进入CO2装置干扰实验21、从你最熟悉的酸、碱、盐中,任意选出四种物质,
使其符合下图中的关系,图中连线的物质间均能发生
化学反应,请将物质的化学式填在相应的方框内:22、用化学方程式表示除杂质的反应:
(1)氯化钙中混有碳酸钙: 。
(2)盐酸中混有少量硫酸: 。 23、在稀硫酸、食盐、熟石灰、干冰、甲烷五种物质中,
可用作食品调味剂的是_____;
可用于人工降雨的是_____;
可用于清洗钢铁表面铁锈的是_____;
可用于改良酸性土壤的是_____;
属于最简单的有机物的是_____。24、图A中的两个圆分别代表酸和碱的有关信息,两圆重叠
的区域表示它们的共同特征(相似点),重叠区域以外的部
分表示它们的独有特征(不同点)。请你在图下横线上填写
与图B.图C中的⑴⑵⑶⑷处相适应的内容(每处只要求填一点)。
(1)_______________ (2)_______________
(3)_______________ (4)_______________25、现在有两瓶失去标签的无色溶液,分别是硫酸钠溶液和
氯化铵溶液。请你用两种不同类别的试剂鉴别它们,写出所
用试剂的化学式:_____、_____26、甲酸是一种无色、有刺激性气味的液体,有较强的腐蚀性。
小明想知道甲酸是否具有酸性,做了如下探究:
(1)他作出的猜想是“甲酸具有酸性”。你认为下列哪一项实验
设计能够检验这一猜想?请用图中字母表示____;
(2)若小明的猜想是正确的,则甲酸就会像盐酸那样,能与碳
酸钠反应,产生____气体;
(3)甲酸(HCOOH)是有机物,浓硫酸能将有机物中的氢元素和
氧元素“脱出”结合成水。
利用浓硫酸的脱水性,实验室里将甲酸和浓硫酸混合加热进行反应,
该反应中甲酸脱水后会
转变成____。27、某科学活动小组以“酸碱盐的性质”为主题,进行探究学习,
请你作为该小组成员来解决下列问题:
⑴小刚同学说:“酸溶液呈酸性,碱溶液呈碱性,则盐溶液
一定呈中性”。你认为这种推理___(填“正确”或“不正确”),
你的例证是_________________。
⑵小丽同学从某一欠收农田里取回一份土壤样品,请你用两种
不同的方法帮小丽测出该土壤样品浸出液的酸碱性(只写出
所用试剂的名称即可):①_____________;
②______________。如果检测的结果呈酸性,
那么要改良此土壤,应该向农田里施加___________。
⑶请你设计一个实验,能通过清晰可见的现象,除去氯化钙溶
液中的少量稀盐酸。你的实验方案是(写出实验操作、现象
和结论):_____________________。28、为了除去Na2SO4溶液中的CuSO4杂质,得到纯净的
Na2SO4溶液。小王同学做了如下实验:①加入适量的KOH
溶液,使CuSO4和KOH恰好完全反应。②过滤,使生成的
Cu(OH)2沉淀和液体分离。小王认为得到的滤液就是纯净的
Na2SO4溶液。
⑴请你对小王同学的除杂质实验进行评价:是否正确 ____
(填“正确”或“不正确”),理由是 。
⑵上述实验用到KOH溶液。小王同学用天平和已知质量
为15g的表面皿,准确称取20gKOH固体来配制该溶液。
称量时,他在托盘天平的右盘上放35g砝码,在左盘的
表面皿中加入KOH固体。这是指针偏向右边(如右图所示),
下面他的操作应该是 。29、小亮、小明二位同学对游泳池内水显蓝色产生好奇,
想探知原因。他们用一个洗净的可乐瓶盛满一瓶“蓝色水”,
带到实验室做了3个实验,记录如下。请你将表格中内容填写完整。
NaCl、Ca(OH)2和稀H2SO4,现要求
用一种试剂一次鉴别它们。甲同学选用
一种钠盐溶液,乙同学选用一种有色试
剂,它们都得到了正确结论。则甲、乙
两位同学选用的试剂分别是:
甲 ,乙 。(填名称)
2.有A、B、C三种物质,它们之间有
如下转化关系:
A+2AgN03=B+2Ag
B+2KOH=2C+Cu(OH)2↓
则化学式:A是_________;
B是_________;C是_________。碳酸钠紫色石蕊试液Cu(N03)2CuKN03无色溶液
3.有一固体粉末,可能含有氯化钠、碳酸钾、
硫酸钠和硝酸钙,进行如图实验,由图可知,
固体粉末中一定含 ,一定不含 。碳酸钾、硫酸钠和硝酸钙不能共存碳酸钾、硫酸钠的存在,硝酸钙不存在硝酸钙碳酸钾、硫酸钠4.2004年初春,我国某些地区出现了高致病性禽流感,
为防止疫情蔓延,必须迅速进行隔离,并对受禽流感病
毒污染的禽舍、工具等进行消毒。资料显示:
禽流感病毒在高温、碱性环境(如氢氧化钠溶液)、高锰酸钾
或次氯酸钠等消毒剂中生存能力较差。请回答:
(1)次氯酸钠(NaClO)属于__________
(填“氧化物”、“酸”、“碱”或“盐”)
(2)用加热高锰酸钾熏蒸消毒禽舍,
写出所发生反应的化学方程式
_______________________________
(3)以下对受污染工具的消毒方法可行
的是_________ (填序号),
A.用NaOH溶液浸泡 B.用水冲洗即可
C.用NaClO溶液浸泡盐AC5.在托盘天平的左、右两盘上各放1只烧杯,分别注入等质量
且溶质质量分数相同的稀盐酸,调整天平平衡。向左盘烧杯中
投入一定质量的CaCO3粉末,向右盘烧杯中投入与CaCO3等
质量的MgCO3粉末,,充分反应。
(1)若反应后天平失去平衡,那么,天平的指针一定偏向___
(填“左”或“右”)。
(2)若反应后天平仍保持平衡,其理由是_________________
_______左分析:此题有两种可能
(1)稀盐酸不足
(2)稀盐酸足量天平失去平衡因为CaCO3,MgCO3式量不同
相同质量的它们产生CO2质量不同.根据HCL反应后天平仍保持平衡盐酸的量不够或
碳酸盐有剩余CaCO3+2HCl=CaCl2+H2O+CO2↑
MgCO3+2HCl=MgCl2+H2O+CO2↑6.在实验室中,张明、苏红两位同学欲测定碳酸钙样品中碳酸钙
的质量分数,分别设计两个方案。(设杂质不和盐酸反应,受热也
不分解)
张明的方案:①称取一定量的碳酸钙样品;②用酒精灯加热样品,
直到质量不再改变;③在干燥的容器中将固体残渣物冷却后称量;
④计算。
苏红的方案:①称取一定量的碳酸钙样品;②加过量的盐酸使之
完全反应;③向反应后的溶液中加入适量的氢氧化钠溶液,恰好
中和过量的盐酸;④计算。回答下列问题:
(1)张明为什么要加热样品直到质量不再改变为止?
(2)张明的方案中为什么要将固体残留物放在干燥的容器中冷却?
(3)写出碳酸钙和盐酸反应的化学方程式:
(4)苏红的方案中,加入过量盐酸的目的是
(5)苏红的方案中,欲测定样品中碳酸钙的质量分数,
在实验过程中需记录哪些数据?
(6)综合上述,你认为张明和苏红方案中,
切实可行的方案是 的方案,
不采用另一方案的理由是 。使碳酸钙完全分解 防止CaO吸收水分 CaCO3+2HCl=CaCl2+H2O+CO2↑ 使碳酸钙完全反应 反应前样品质量、盐酸质量(带烧杯)、
反应后烧杯的总质量苏红 碳酸钙分解需要高温条件,在实验室中进行较困难7、赵刚为了了解生活中常见的锌锰干电池,做了以下探究。
他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;
②电极周围充满黑色粉末;③里面有少量无色晶体;④金属
外壳明显破损。
赵刚查阅了资料:锌锰电池是以中心的碳棒(石墨)做正极,
外围的锌筒做负极,锌筒与碳棒之间填满氯化铵溶液(做电解质)
拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用。
在电池的使用中,锌逐渐变成了氯化锌。
请你根据初中学习的知识和赵刚的探究活动,填写以下空白。
⑴.用碳棒做电极主要利用了石墨的_ __性。
⑵.以氯化锌为例,写出证明废电池内含有氯离子的
化学方程式:______________。
⑶.通过回收废旧锌锰干电池可得到的物质
有______________(只要填一种)。
⑷.将锌锰电池中的二氧化锰加入双氧水中发现产生气泡
的速度加快,此时二氧化锰所的作用是______________作用导电性 ZnCl2+AgNO3===Zn(NO3)2+2AgCl↓ 石墨等 催化 8.请你参与某学习小组的探究活动,并回答相关问题:
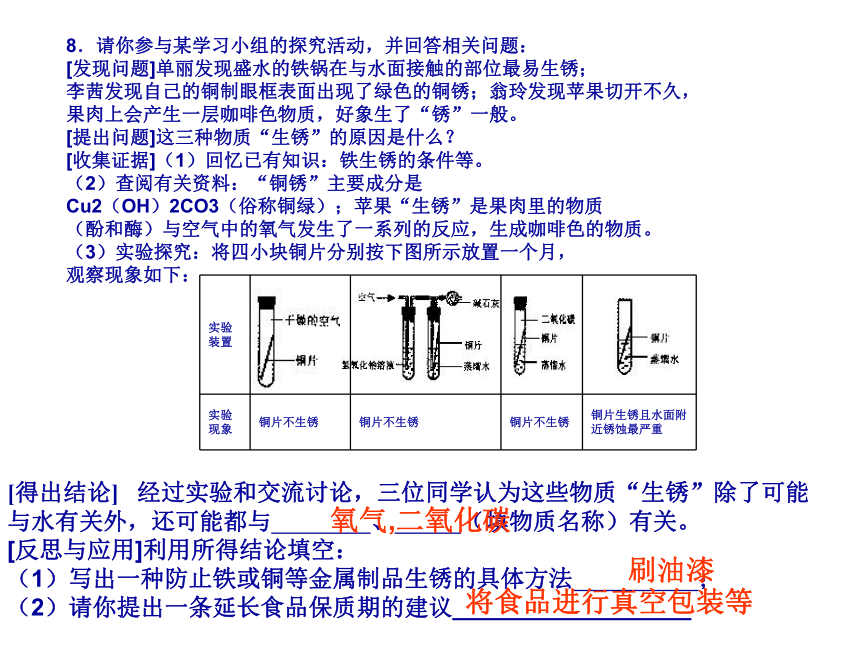
[发现问题]单丽发现盛水的铁锅在与水面接触的部位最易生锈;
李茜发现自己的铜制眼框表面出现了绿色的铜锈;翁玲发现苹果切开不久,
果肉上会产生一层咖啡色物质,好象生了“锈”一般。
[提出问题]这三种物质“生锈”的原因是什么?
[收集证据](1)回忆已有知识:铁生锈的条件等。
(2)查阅有关资料:“铜锈”主要成分是
Cu2(OH)2CO3(俗称铜绿);苹果“生锈”是果肉里的物质
(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质。
(3)实验探究:将四小块铜片分别按下图所示放置一个月,
观察现象如下:[得出结论] 经过实验和交流讨论,三位同学认为这些物质“生锈”除了可能
与水有关外,还可能都与 、 (填物质名称)有关。
[反思与应用]利用所得结论填空:
(1)写出一种防止铁或铜等金属制品生锈的具体方法 ;
(2)请你提出一条延长食品保质期的建议__________________
氧气,二氧化碳 刷油漆 将食品进行真空包装等9、一张洁白干燥的滤纸上,依次喷洒 A、B、C三种无色液体。
当喷洒 A时,滤纸上无明显变化;再喷洒B时,滤纸上出现一
只红色小猫(如右图一);最后喷洒C时,小猫渐渐消失。
回答下列问题:滤纸上的小猫可能是用???___??????? 画的。
无色液体A是? ????????? , B是??????????? , C是???????????????????? 。10、如下图二所示,在试管和小气球中分别先
加入稀硫酸和一种常见的固体物质,然后将气球
中的固体倒入试管中,观察到有气泡产生且气球
胀大。请依据上述实验回答下列问题:
气球中加入的固体物质可能是(至少答出两种不
同类型的物质) 。
(2)请用简单的实验方法,证明制得气体的密度
比空气大还是小。 。水 烧碱 盐酸 无色酚酞 从满后的气球放于空中看浮沉碳酸钙或锌片11、如图所示,弹簧秤下挂着一重物A,烧杯中盛有
溶液B,试根据要求回答下列问题:
(1)若A为铁块,B为稀硫酸,则将A放入B中,
过一会儿,弹簧秤的读数将_____(填“变大”、“变小”
或“不变”,下同)
(2)若A为铁块,B为硫酸铜溶液,则将A放入B中,
过一会儿,弹簧秤的读数将
___________.12、厨房的两个调料瓶中分别盛有精盐(NaCl)、
碱面(Na2CO3)两种固体,请你利用所学的知识列出两种不同
的方法将它们区别开,简要写出操作步骤、现象和结论。
(1)_____________________________________________
(2)________________________________________________ 变大 变小分别加入石灰水有白色沉淀的是碱面
分别加入CH3COOH有气泡的是碱面13、在一次化学探究活动中,晓琴同学无意中发现,
两种无色溶液混合后,能产生一种白色沉淀。⑴从无色溶液着
研究,若有一种是稀硫酸,则白色沉淀是________________,
其化学方程式是_______________________________________。
⑵从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,
则白色沉淀的可能是_____________________,
其化学方程式是 __________________________。14、NO和NO2具有下列不同的性质:
通常情况下,NO是无色气体,微溶于水;NO2是棕色气体,
易溶于水。并能发生下列化学反应:3NO2+H2O=2HNO3+NO
如右图将一支充满NO2棕色气体的试管倒立在烧杯中(水中已预
先加入数滴石蕊试液)。试分别描述实验现象:(至少写二点)
⑴_____________________________________________;
⑵_____________________________________________。BaSO4; BaCl2+H2SO4 = BaSO4↓+2HClBaCO3+2HNO3 = Ba(NO3)2+H2O+CO2↑BaCO3;烧杯中液体由紫色变成红色;⑵试管内液面上升(试管内气体由棕色变为无色)15、在一次实验课上,老师让同学们进行探究实验。
目的:探究氢氧化钠溶液中是哪一种粒子能使无色酚酞试液变色。
猜想:可能是水分子,钠离子或氢氧根离子使无色酚酞试液变色。
实验:
⑴在第一支试管中加入约2毫升蒸馏水,滴入几滴无色酚酞试液。
现象:溶液不变色;
⑵ 在第二支试管中加入2毫升氯化钠溶液,滴入几滴无色酚酞试液。
现象:溶液不变色;
⑶ 在第三支试管中加入2毫升氢氧化钠溶液,
滴入几滴无色酚酞试液。现象: 。
结论:在氢氧化钠溶液中,是 使无色酚酞试液变色。 溶液由无色变成红色 。 氢氧根离子使无色酚酞试液变色。 17、160年前,鸦片——曾使中国面临“亡国灭种”危险,民族
英雄林则徐坚决领导了禁烟斗争……
他们先把鸦片投入到盐卤池中浸泡、溶解,再投入生石灰,
倾刻间池中沸腾,烟土随之湮灭。池中生石灰与水反应
的化学方程式___________________;“倾刻间池中沸腾”
说明此反应过程会(填“吸收”或“放出”)___________大量热。16、有A、B、C三种失去标签的无色溶液,它们是稀硫酸、
稀盐酸和稀硝酸。分别取少量三种溶液各加入几滴氯化钡溶液,
只有C出现白色沉淀。另取A、B两种溶液各加入几滴硝酸银溶液,
只有B产生白色沉淀。
由此可得A是______________;B是______________;
C是______________。稀硝酸稀盐酸稀硫酸。放出CaO +H2O = Ca(OH)218、张强从菜场买了一些鸡蛋,放入水中煮,发现有的鸡蛋
破裂有的不破裂,他感到好奇,做如下的探究实验:
⑴分别将破裂的蛋的壳和不破裂的蛋的壳洗净、烘干、研碎
⑵分别称取等质量的两种蛋壳,分别加入到足量相等的稀盐酸中
⑶将产生的气体分别通入足量的澄清石灰水中
⑷将生成的沉淀分别过滤、洗净、烘干、称量,请回答:
探究实验第⑶步发生的化学反应的
方程式是____________________________,
这个探究实验的目的是比较________________Ca(OH)2+CO2==CaCO3+H2O两种蛋壳中的碳酸钙的含量19、某物质A,属于氧化物、酸、碱、盐中的某一类化合物。
为了确定它,作了如下实验:将A溶于水,得无色透明溶液,
向溶液中滴入酚酞试液,溶液呈红色。向上述红色溶液中加
入适量的物质B的溶液,溶液的红色消失,并生成白色沉淀C。
再加入稀硝酸,C不溶解。
试推断:物质A是___________,B是____________,
C是__________。H2SO4Ba(OH)2BaSO4 20、实验室采取了如下图所示的一种装置来研究种子
发芽所需的条件,并将它置于适宜的温室
(25 ℃~35 ℃)环境中培养。几天后,发现位于水面以上与位于水面以下的种
子都没有发芽,只有位于水面处的种子发芽了,
并且可以观察到小试管中的澄清石灰水变浑浊了。由此说明:
(1)种子发芽所需要的条件是 。
(2)小试管中澄清石灰水变浑浊的原因是:
____________________________________。
(3)U形管中放入的NaOH和CaO固体混合物的作用是:
________________________。 有充足的氧气和水分萌发的种子呼吸作用放出CO2与石灰水反应生成难溶的碳酸钙 防止空气中进入CO2装置干扰实验21、从你最熟悉的酸、碱、盐中,任意选出四种物质,
使其符合下图中的关系,图中连线的物质间均能发生
化学反应,请将物质的化学式填在相应的方框内:22、用化学方程式表示除杂质的反应:
(1)氯化钙中混有碳酸钙: 。
(2)盐酸中混有少量硫酸: 。 23、在稀硫酸、食盐、熟石灰、干冰、甲烷五种物质中,
可用作食品调味剂的是_____;
可用于人工降雨的是_____;
可用于清洗钢铁表面铁锈的是_____;
可用于改良酸性土壤的是_____;
属于最简单的有机物的是_____。24、图A中的两个圆分别代表酸和碱的有关信息,两圆重叠
的区域表示它们的共同特征(相似点),重叠区域以外的部
分表示它们的独有特征(不同点)。请你在图下横线上填写
与图B.图C中的⑴⑵⑶⑷处相适应的内容(每处只要求填一点)。
(1)_______________ (2)_______________
(3)_______________ (4)_______________25、现在有两瓶失去标签的无色溶液,分别是硫酸钠溶液和
氯化铵溶液。请你用两种不同类别的试剂鉴别它们,写出所
用试剂的化学式:_____、_____26、甲酸是一种无色、有刺激性气味的液体,有较强的腐蚀性。
小明想知道甲酸是否具有酸性,做了如下探究:
(1)他作出的猜想是“甲酸具有酸性”。你认为下列哪一项实验
设计能够检验这一猜想?请用图中字母表示____;
(2)若小明的猜想是正确的,则甲酸就会像盐酸那样,能与碳
酸钠反应,产生____气体;
(3)甲酸(HCOOH)是有机物,浓硫酸能将有机物中的氢元素和
氧元素“脱出”结合成水。
利用浓硫酸的脱水性,实验室里将甲酸和浓硫酸混合加热进行反应,
该反应中甲酸脱水后会
转变成____。27、某科学活动小组以“酸碱盐的性质”为主题,进行探究学习,
请你作为该小组成员来解决下列问题:
⑴小刚同学说:“酸溶液呈酸性,碱溶液呈碱性,则盐溶液
一定呈中性”。你认为这种推理___(填“正确”或“不正确”),
你的例证是_________________。
⑵小丽同学从某一欠收农田里取回一份土壤样品,请你用两种
不同的方法帮小丽测出该土壤样品浸出液的酸碱性(只写出
所用试剂的名称即可):①_____________;
②______________。如果检测的结果呈酸性,
那么要改良此土壤,应该向农田里施加___________。
⑶请你设计一个实验,能通过清晰可见的现象,除去氯化钙溶
液中的少量稀盐酸。你的实验方案是(写出实验操作、现象
和结论):_____________________。28、为了除去Na2SO4溶液中的CuSO4杂质,得到纯净的
Na2SO4溶液。小王同学做了如下实验:①加入适量的KOH
溶液,使CuSO4和KOH恰好完全反应。②过滤,使生成的
Cu(OH)2沉淀和液体分离。小王认为得到的滤液就是纯净的
Na2SO4溶液。
⑴请你对小王同学的除杂质实验进行评价:是否正确 ____
(填“正确”或“不正确”),理由是 。
⑵上述实验用到KOH溶液。小王同学用天平和已知质量
为15g的表面皿,准确称取20gKOH固体来配制该溶液。
称量时,他在托盘天平的右盘上放35g砝码,在左盘的
表面皿中加入KOH固体。这是指针偏向右边(如右图所示),
下面他的操作应该是 。29、小亮、小明二位同学对游泳池内水显蓝色产生好奇,
想探知原因。他们用一个洗净的可乐瓶盛满一瓶“蓝色水”,
带到实验室做了3个实验,记录如下。请你将表格中内容填写完整。
同课章节目录
