人教版初中化学第九单元第2节溶解度讲解及习题(无答案)
文档属性
| 名称 | 人教版初中化学第九单元第2节溶解度讲解及习题(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 508.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-02-26 16:47:49 | ||
图片预览



文档简介
组长审核:
学员编号: 年 级:九年级 课时数:3课时
学员姓名: 辅导科目:化学 学科教师:
授课主题
溶解度
教学目的
了解溶解度的涵义,初步学习溶解度曲线;
通过溶解度曲线的理解,对溶液本质的认识拓展;
溶解度曲线结合饱和不饱和的相关题型掌握。
教学重难点
固体物质溶解度的涵义;
利用溶解度曲线获得相关信息。
授课日期及时段
2017年2月21日 10:00-12:00
教学内容
一、例题解析
如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.
甲的溶解度等于乙的溶解度
B.
升高温度可将甲的不饱和溶液变为饱和溶液
C.
20℃时,100g乙的饱和溶液中溶质质量是30g
D.
40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
本节知识点讲解
溶解度
1.溶解度 在一定温度下,某固态物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质溶解在这种溶剂里的溶解度。
理解溶解度概念时应注意哪些问题?
溶解度的概念包括四个要素: ①指明一定温度;
②溶剂为100 g;
③必须达到饱和状态;
④单位为g。
练习:
1、如图是甲、乙两种固体物质的溶解度曲线。
(1)t2℃时,甲物质的溶解度为____________;
(2)从图中你还能获得哪些信息?(任填一条)______________________________________;
(3)分析t1℃时,将10g乙物质放入100g水中,充分溶
解后所得的溶液是________(填“饱和”或“不饱和”)溶液。欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法是______________(任填一种方法)。
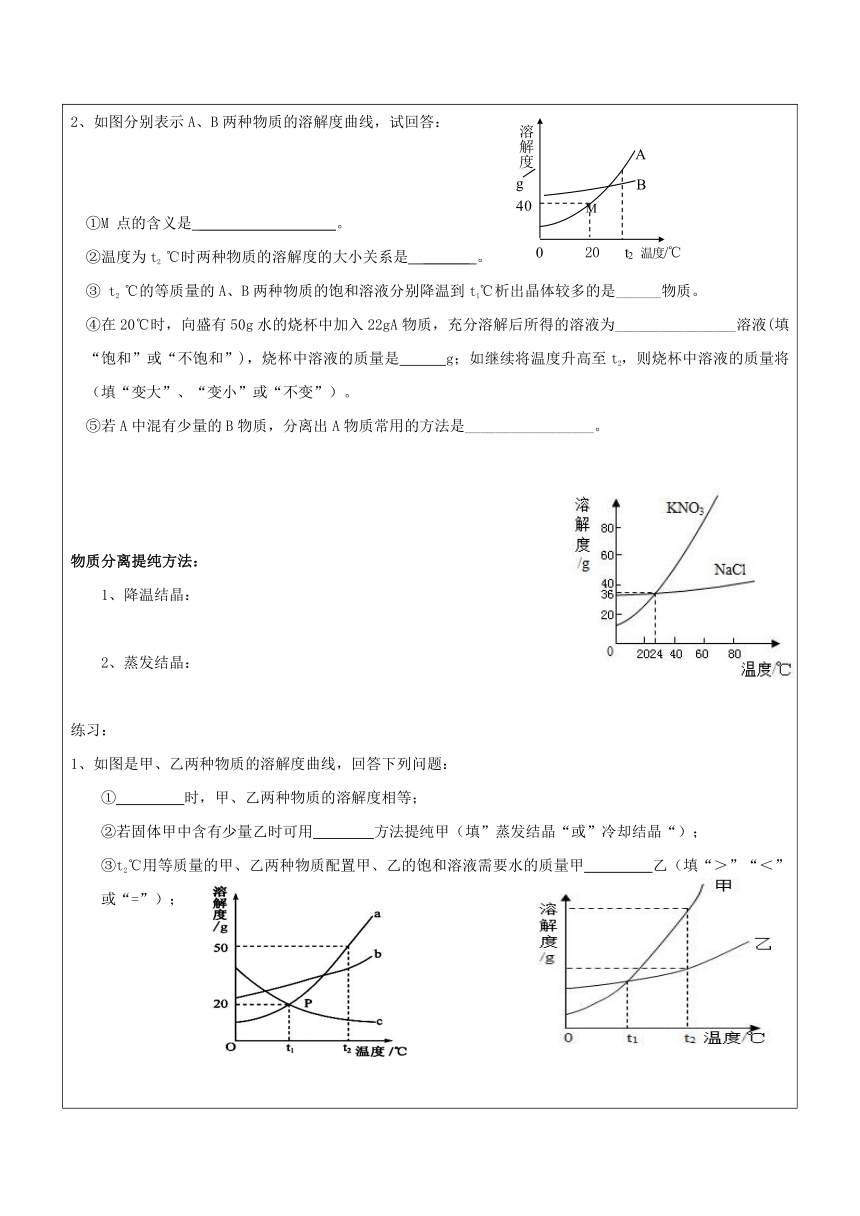
2、如图分别表示A、B两种物质的溶解度曲线,试回答:
①M 点的含义是 __________________。
②温度为t2 ℃时两种物质的溶解度的大小关系是 ______ 。
③ t2 ℃的等质量的A、B两种物质的饱和溶液分别降温到t1℃析出晶体较多的是______物质。
④在20℃时,向盛有50g水的烧杯中加入22gA物质,充分溶解后所得的溶液为________________溶液(填“饱和”或“不饱和”),烧杯中溶液的质量是 g;如继续将温度升高至t2,则烧杯中溶液的质量将 (填“变大”、“变小”或“不变”)。
⑤若A中混有少量的B物质,分离出A物质常用的方法是_________________。
物质分离提纯方法:
降温结晶:
蒸发结晶:
练习:
1、如图是甲、乙两种物质的溶解度曲线,回答下列问题:
①_________时,甲、乙两种物质的溶解度相等;
②若固体甲中含有少量乙时可用________方法提纯甲(填”蒸发结晶“或”冷却结晶“);
③t2℃用等质量的甲、乙两种物质配置甲、乙的饱和溶液需要水的质量甲_________乙(填“>”“<”或“=”);
2、上图是a、b、c三种固体物质的溶解度曲线
(1) t2℃时,a、b、c三种物质中,溶解度最大的是 。
(2)a中混有少量b,用 的方法提纯a。
(3)t2℃时,将c物质的饱和溶液转变成不饱和溶液可采取的方法有 (写出一种即可)。
这里,如果不指名溶剂,通常所说的溶解度是指物质在水里的溶解度。例如,在20℃时,100g水里最多能溶解36g氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水里的溶解度是36g。
⒉ 影响因素 外因——温度,内因——溶质、溶剂性质。
溶解度和溶解性的区别与联系?
⒊ 溶解性与溶解度的关系
那么,温度对固体溶解度有怎样的影响,如何表示温度对固体溶解度的影响呢?
4. 温度对固体溶解度的影响
⑴ 表示方法:列表法,坐标法——溶解度曲线
⑵ 溶解度曲线
【小结】溶解度曲线的意义:
同一物质在不同温度时的溶解度数值;
② 不同物质在相同温度时的溶解度数值;
比较某一温度下不同物质的溶解度大小;
④ 物质的溶解度受温度的影响。
A.大多数物质的溶解度随温度升高而增大,如KNO3、NH4NO3 。
B.少数物质的溶解度随温度升高变化不大,如NaCl
C.极少数物质的溶解度随温度升高而减小,如Ca(OH)2
采用降温的方法,是否可以使接近饱和的Ca(OH)2 变成饱和溶液?
练习
1.下列关于溶解度的说法正确的是 ( )
A.表示某物质在100g溶剂中所能溶解的最多克数
B.表示一定温度时,100g溶剂与某物质制成的饱和溶液中溶解该物质的克数
C.表示某温度时,某物质在100g溶剂中溶解的克数
D.表示一定温度时,100g饱和溶液中溶解溶质的克数
2.右图是a、b、c三种固体物质的溶解度曲线,当它们的溶液接近饱和时,采
用增加溶质、蒸发溶剂或升高温度三种方法,均可以变为饱和溶液的是 ( )
A.a溶液 B.b溶液 C.c溶液 D.a、b溶液
3.下列措施不能使饱和的氯化钠溶液变为不饱和溶液的是 ( )
A.蒸发溶液中的水分,并降温至原来温度 B.升高溶液的温度
C.向溶液中加入同温不饱和氯化钠溶液 D.向溶液中加入水
4.甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法正确的是 ( )
A.杯中固体甲和固体乙都减少 B.杯中固体甲增多、固体乙减少
C.溶液中甲、乙溶质都减少 D.溶液中溶质甲减少、溶质乙增多
5.已知某盐在不同温度下的溶解度.若把溶质的质量分数为32%的该盐溶液,由50℃逐渐冷却,则开始有晶体析出的温度范围是 ( )
温度(℃)
0
10
20
30
40
溶解度(g)
13.3
20.9
31.6
45.8
63.9
A.0~10℃ B.10~20℃ C.20~30℃ D.30~40'C
6.下列说法正确的评价是 ( )
(1)在一定温度下,某物质的饱和溶液一定是含溶剂100g的溶液
(2)20℃时,10g氯化钠可溶解在100g水里,所以20℃时氯化钠的溶解度为10g
(3)20℃时,把10g氯化钠溶解在水里制成饱和溶液,所以20℃时氯化钠的溶解度为10g
(4)把20g某物质溶解在100g水里,恰好制成饱和溶液,这种物质的溶解度就是20g
A.(3)正确 B.(2)(3)正确 C.(1)(4)正确 D.(1)(2)(3)(4)都不正确
气体溶解度
由于称量气体的质量比较困难,所以气体的溶解度常用体积来表示,
1. 定义 压强为101kPa,一定温度时溶解在1体积水里达到饱和状态时的气体体积。
比较固体、气体溶解度概念;影响气体溶解度的因素。
影响因素
两瓶汽水,取其中一瓶不打开,摇晃,然后打开,你能观察到当不打开时,无明显现象,打开后有大量气泡产生。这时为什么呢?
这说明气体的溶解度受压强的影响。压强增大,气体溶解度增大;压强减小,溶解度减小。
我们再来想一下,在日常生活中烧开水时,水未开时就看到水中冒气泡,这些气泡是什么?说明了什么?
这说明气体的溶解度受温度的影响,温度升高,气体的溶解度变小。
总结:气体溶解度的影响因素 外因:温度升高,气体溶解度降低,压强增大,气体溶解度增大。
即:气体的溶解度随温度的升高而减小,随压强的升高而增大
练习
啤酒是日常生活中的饮料,其中含有二氧化碳、水和蛋白质等物质,观察一瓶啤酒,未见气泡;打开啤酒瓶盖,会冒出大量气泡,原因是________________________;使啤酒的气泡快速放出的方法有搅拌、振荡、_________
三、当堂练习
1.右下图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
(1)随着温度的升高其溶解度反而减小的是___ _;在__ ____℃时,甲与丙的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为_________。
(3)t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是_ ____(用
“甲”、“乙”、“丙”及“>”、“<”或“=”表示)。
2. 根据图1和图2回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象如图1所示,要使剩余的甲固体继续溶解可采用的方法是____________。
图2中a、b分别表示上述两种物质的溶解度曲线,在________℃时,这两种物质的溶解度相等;a表示的是_____________物质(填“甲”或“乙”)的溶解度曲线。
3.下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答
(1)60℃时,氯化钠的溶解度为 g。
(2)在30℃时,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为 g。
(3)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范
围是 g。
课堂总结
五、课后作业
1.右图所示曲线是x、y、z分别表示X、Y、Z三种物质的溶解度曲线。下列说法错误的是( )
t1℃时,三种物质溶解度大小的顺序是Y、Z、X
B.t2℃时,X和Y两种物质的饱和溶液质量分数相同
C.t3℃时,在100g水里分别加入三种物质各mg,只X能形成饱和溶液
D.从混有少量Z的X物质中提取较纯净的X,最适宜采用冷却热饱和溶液结晶法
2.在20℃时,将250g氯化钠饱和溶液加热蒸发掉30g水,再冷却到20℃时,有10.8氯化钠晶体析出,则20℃时氯化钠的溶解度为( )
A.10.8g B.36g C.26.5g D.21.6g
3. 如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.甲物质的溶解度大于乙物质的溶解度
B.在t1℃时,甲、乙两物质溶液溶质质量分数相等
C.在t2℃时,H点表示乙物质的不饱和溶液
D.由t1℃升温到t2℃时,甲物质溶液溶质质量分数不变
4. 下表是氯化钠、硝酸钾在不同温度时的溶解度:据此数据,判断下列说法不正确的是 ( )
温度/℃
10
20
30
40
50
60
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
37.0
37.3
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
A.氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B.在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C.分别将20℃时的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
D.从含有少量硝酸钾的饱和氯化钠溶液中得到较多的氯化钠晶体,通常可采用蒸发溶剂使其结晶的方法
5.如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是( )
A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法
6. 夏天把一盆冷水放在太阳底下晒一段时间,盆边会出现一些小气泡,这是因为_ ,当汽水瓶打开瓶盖时,有大量气泡从瓶中逸出,这是因为 , 喝下汽水后常会打嗝,说明气体的溶解度随温度的升高而 。
7. 40℃时,取等质量的a、b、c三种物质的饱和溶液于三个烧杯中,再分别蒸发同质量的水,将温度降到30℃,固体溶解情况如图1所示;图2为a、b、c三种物质的溶解度曲线,仔细读图1和图2,回答下列问题。
①三种物质溶解度关系:b>a>c时的温度为t,则t的取值范围是: ,②烧杯甲里是__ __物质的溶液,烧杯乙里是________物质的溶液,③40℃时,烧杯____里溶液中水量最少。
学员编号: 年 级:九年级 课时数:3课时
学员姓名: 辅导科目:化学 学科教师:
授课主题
溶解度
教学目的
了解溶解度的涵义,初步学习溶解度曲线;
通过溶解度曲线的理解,对溶液本质的认识拓展;
溶解度曲线结合饱和不饱和的相关题型掌握。
教学重难点
固体物质溶解度的涵义;
利用溶解度曲线获得相关信息。
授课日期及时段
2017年2月21日 10:00-12:00
教学内容
一、例题解析
如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.
甲的溶解度等于乙的溶解度
B.
升高温度可将甲的不饱和溶液变为饱和溶液
C.
20℃时,100g乙的饱和溶液中溶质质量是30g
D.
40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
本节知识点讲解
溶解度
1.溶解度 在一定温度下,某固态物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质溶解在这种溶剂里的溶解度。
理解溶解度概念时应注意哪些问题?
溶解度的概念包括四个要素: ①指明一定温度;
②溶剂为100 g;
③必须达到饱和状态;
④单位为g。
练习:
1、如图是甲、乙两种固体物质的溶解度曲线。
(1)t2℃时,甲物质的溶解度为____________;
(2)从图中你还能获得哪些信息?(任填一条)______________________________________;
(3)分析t1℃时,将10g乙物质放入100g水中,充分溶
解后所得的溶液是________(填“饱和”或“不饱和”)溶液。欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法是______________(任填一种方法)。
2、如图分别表示A、B两种物质的溶解度曲线,试回答:
①M 点的含义是 __________________。
②温度为t2 ℃时两种物质的溶解度的大小关系是 ______ 。
③ t2 ℃的等质量的A、B两种物质的饱和溶液分别降温到t1℃析出晶体较多的是______物质。
④在20℃时,向盛有50g水的烧杯中加入22gA物质,充分溶解后所得的溶液为________________溶液(填“饱和”或“不饱和”),烧杯中溶液的质量是 g;如继续将温度升高至t2,则烧杯中溶液的质量将 (填“变大”、“变小”或“不变”)。
⑤若A中混有少量的B物质,分离出A物质常用的方法是_________________。
物质分离提纯方法:
降温结晶:
蒸发结晶:
练习:
1、如图是甲、乙两种物质的溶解度曲线,回答下列问题:
①_________时,甲、乙两种物质的溶解度相等;
②若固体甲中含有少量乙时可用________方法提纯甲(填”蒸发结晶“或”冷却结晶“);
③t2℃用等质量的甲、乙两种物质配置甲、乙的饱和溶液需要水的质量甲_________乙(填“>”“<”或“=”);
2、上图是a、b、c三种固体物质的溶解度曲线
(1) t2℃时,a、b、c三种物质中,溶解度最大的是 。
(2)a中混有少量b,用 的方法提纯a。
(3)t2℃时,将c物质的饱和溶液转变成不饱和溶液可采取的方法有 (写出一种即可)。
这里,如果不指名溶剂,通常所说的溶解度是指物质在水里的溶解度。例如,在20℃时,100g水里最多能溶解36g氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水里的溶解度是36g。
⒉ 影响因素 外因——温度,内因——溶质、溶剂性质。
溶解度和溶解性的区别与联系?
⒊ 溶解性与溶解度的关系
那么,温度对固体溶解度有怎样的影响,如何表示温度对固体溶解度的影响呢?
4. 温度对固体溶解度的影响
⑴ 表示方法:列表法,坐标法——溶解度曲线
⑵ 溶解度曲线
【小结】溶解度曲线的意义:
同一物质在不同温度时的溶解度数值;
② 不同物质在相同温度时的溶解度数值;
比较某一温度下不同物质的溶解度大小;
④ 物质的溶解度受温度的影响。
A.大多数物质的溶解度随温度升高而增大,如KNO3、NH4NO3 。
B.少数物质的溶解度随温度升高变化不大,如NaCl
C.极少数物质的溶解度随温度升高而减小,如Ca(OH)2
采用降温的方法,是否可以使接近饱和的Ca(OH)2 变成饱和溶液?
练习
1.下列关于溶解度的说法正确的是 ( )
A.表示某物质在100g溶剂中所能溶解的最多克数
B.表示一定温度时,100g溶剂与某物质制成的饱和溶液中溶解该物质的克数
C.表示某温度时,某物质在100g溶剂中溶解的克数
D.表示一定温度时,100g饱和溶液中溶解溶质的克数
2.右图是a、b、c三种固体物质的溶解度曲线,当它们的溶液接近饱和时,采
用增加溶质、蒸发溶剂或升高温度三种方法,均可以变为饱和溶液的是 ( )
A.a溶液 B.b溶液 C.c溶液 D.a、b溶液
3.下列措施不能使饱和的氯化钠溶液变为不饱和溶液的是 ( )
A.蒸发溶液中的水分,并降温至原来温度 B.升高溶液的温度
C.向溶液中加入同温不饱和氯化钠溶液 D.向溶液中加入水
4.甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法正确的是 ( )
A.杯中固体甲和固体乙都减少 B.杯中固体甲增多、固体乙减少
C.溶液中甲、乙溶质都减少 D.溶液中溶质甲减少、溶质乙增多
5.已知某盐在不同温度下的溶解度.若把溶质的质量分数为32%的该盐溶液,由50℃逐渐冷却,则开始有晶体析出的温度范围是 ( )
温度(℃)
0
10
20
30
40
溶解度(g)
13.3
20.9
31.6
45.8
63.9
A.0~10℃ B.10~20℃ C.20~30℃ D.30~40'C
6.下列说法正确的评价是 ( )
(1)在一定温度下,某物质的饱和溶液一定是含溶剂100g的溶液
(2)20℃时,10g氯化钠可溶解在100g水里,所以20℃时氯化钠的溶解度为10g
(3)20℃时,把10g氯化钠溶解在水里制成饱和溶液,所以20℃时氯化钠的溶解度为10g
(4)把20g某物质溶解在100g水里,恰好制成饱和溶液,这种物质的溶解度就是20g
A.(3)正确 B.(2)(3)正确 C.(1)(4)正确 D.(1)(2)(3)(4)都不正确
气体溶解度
由于称量气体的质量比较困难,所以气体的溶解度常用体积来表示,
1. 定义 压强为101kPa,一定温度时溶解在1体积水里达到饱和状态时的气体体积。
比较固体、气体溶解度概念;影响气体溶解度的因素。
影响因素
两瓶汽水,取其中一瓶不打开,摇晃,然后打开,你能观察到当不打开时,无明显现象,打开后有大量气泡产生。这时为什么呢?
这说明气体的溶解度受压强的影响。压强增大,气体溶解度增大;压强减小,溶解度减小。
我们再来想一下,在日常生活中烧开水时,水未开时就看到水中冒气泡,这些气泡是什么?说明了什么?
这说明气体的溶解度受温度的影响,温度升高,气体的溶解度变小。
总结:气体溶解度的影响因素 外因:温度升高,气体溶解度降低,压强增大,气体溶解度增大。
即:气体的溶解度随温度的升高而减小,随压强的升高而增大
练习
啤酒是日常生活中的饮料,其中含有二氧化碳、水和蛋白质等物质,观察一瓶啤酒,未见气泡;打开啤酒瓶盖,会冒出大量气泡,原因是________________________;使啤酒的气泡快速放出的方法有搅拌、振荡、_________
三、当堂练习
1.右下图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
(1)随着温度的升高其溶解度反而减小的是___ _;在__ ____℃时,甲与丙的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为_________。
(3)t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是_ ____(用
“甲”、“乙”、“丙”及“>”、“<”或“=”表示)。
2. 根据图1和图2回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象如图1所示,要使剩余的甲固体继续溶解可采用的方法是____________。
图2中a、b分别表示上述两种物质的溶解度曲线,在________℃时,这两种物质的溶解度相等;a表示的是_____________物质(填“甲”或“乙”)的溶解度曲线。
3.下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答
(1)60℃时,氯化钠的溶解度为 g。
(2)在30℃时,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为 g。
(3)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范
围是 g。
课堂总结
五、课后作业
1.右图所示曲线是x、y、z分别表示X、Y、Z三种物质的溶解度曲线。下列说法错误的是( )
t1℃时,三种物质溶解度大小的顺序是Y、Z、X
B.t2℃时,X和Y两种物质的饱和溶液质量分数相同
C.t3℃时,在100g水里分别加入三种物质各mg,只X能形成饱和溶液
D.从混有少量Z的X物质中提取较纯净的X,最适宜采用冷却热饱和溶液结晶法
2.在20℃时,将250g氯化钠饱和溶液加热蒸发掉30g水,再冷却到20℃时,有10.8氯化钠晶体析出,则20℃时氯化钠的溶解度为( )
A.10.8g B.36g C.26.5g D.21.6g
3. 如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.甲物质的溶解度大于乙物质的溶解度
B.在t1℃时,甲、乙两物质溶液溶质质量分数相等
C.在t2℃时,H点表示乙物质的不饱和溶液
D.由t1℃升温到t2℃时,甲物质溶液溶质质量分数不变
4. 下表是氯化钠、硝酸钾在不同温度时的溶解度:据此数据,判断下列说法不正确的是 ( )
温度/℃
10
20
30
40
50
60
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
37.0
37.3
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
A.氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B.在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C.分别将20℃时的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
D.从含有少量硝酸钾的饱和氯化钠溶液中得到较多的氯化钠晶体,通常可采用蒸发溶剂使其结晶的方法
5.如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是( )
A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法
6. 夏天把一盆冷水放在太阳底下晒一段时间,盆边会出现一些小气泡,这是因为_ ,当汽水瓶打开瓶盖时,有大量气泡从瓶中逸出,这是因为 , 喝下汽水后常会打嗝,说明气体的溶解度随温度的升高而 。
7. 40℃时,取等质量的a、b、c三种物质的饱和溶液于三个烧杯中,再分别蒸发同质量的水,将温度降到30℃,固体溶解情况如图1所示;图2为a、b、c三种物质的溶解度曲线,仔细读图1和图2,回答下列问题。
①三种物质溶解度关系:b>a>c时的温度为t,则t的取值范围是: ,②烧杯甲里是__ __物质的溶液,烧杯乙里是________物质的溶液,③40℃时,烧杯____里溶液中水量最少。
同课章节目录
