水是常用溶剂(3)(浙江省宁波市慈溪市)
文档属性
| 名称 | 水是常用溶剂(3)(浙江省宁波市慈溪市) |

|
|
| 格式 | rar | ||
| 文件大小 | 403.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2008-04-02 00:00:00 | ||
图片预览




文档简介
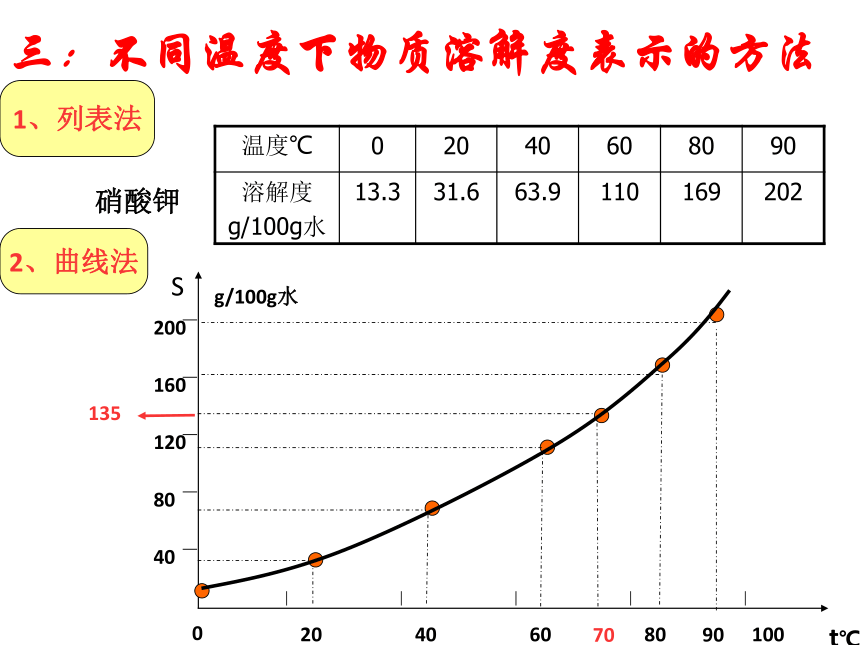
课件19张PPT。水是常用的溶剂(三)实验:比较温度对不同物质溶解能力的影响
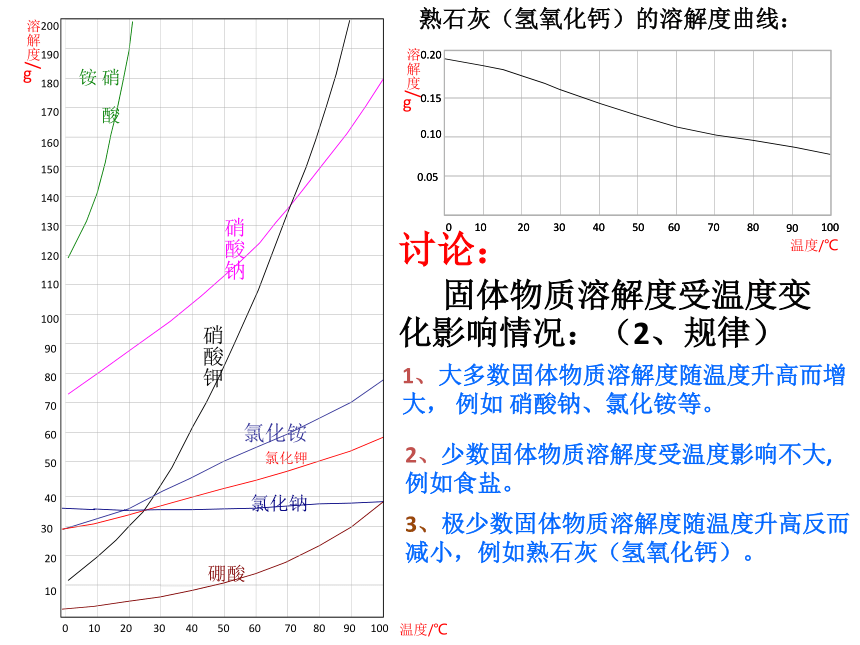
------温度对不同物质的溶解能力(溶解度)的影响不同。思考:不同温度下物质溶解度怎么表示?三:不同温度下物质溶解度表示的方法硝酸钾701、列表法2、曲线法(1)每个点------表示某温度下某溶质的溶解度(2)曲线-----表示某物质的溶解度受温度影响大小的情况(3)交点------表示在该温度下两种物质的溶解度相等(4)曲线上每个点是该温度下该溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。1、溶解度曲线的意义(5)可确定从饱和溶液中析出晶体或进行混合物分离的方法。0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃熟石灰(氢氧化钙)的溶解度曲线:讨论:
固体物质溶解度受温度变化影响情况:(2、规律) 1、大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。 2、少数固体物质溶解度受温度影响不大, 例如食盐。3、极少数固体物质溶解度随温度升高反而减小,例如熟石灰(氢氧化钙)。3、饱和溶液和不饱和溶液的相互转化饱和溶液不饱和溶液思考:
给你一杯饱和溶液,怎样可以变成不饱和溶液?加溶剂、一般升温加溶质、恒温蒸发、一般降温思考:
给你一杯饱和溶液,怎样得到溶质晶体?1、溶解度随温度升高而增大的,降温结晶
2、溶解度随温度升高而减小的,升温结晶思考:
给你一杯溶解了两种溶质的溶液,怎样把两种溶质分离?(例如:硝酸钾和硝酸钠)3、分离法(一般随温度变化大的)降温(冷却)结晶思考:
溶解度的大小与哪些因素有关?与 温度、溶质种类、
溶剂种类有关练习: 1、什么叫溶解度?理解这个概念时要把握哪四个要素(关键)? 2、20℃时,氯化钠的溶解度是36g。则20℃时,氯化钠饱和溶液中溶质、溶剂、饱和溶液的质量比是_________________。 3、在20℃时,50g水最多能溶解7.4g某物质,则这种物质属于( )
A、易溶物质 B、可溶物质
C、微溶物质 D、难溶物质36:100:136A50
10
20
30
40
0
60
70
808
90
100
50
10
20
30
40
80
60
70
8 0
90
100
110
180
170
160
150
140
130
120
190
200
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钾
氯化钠
硼酸
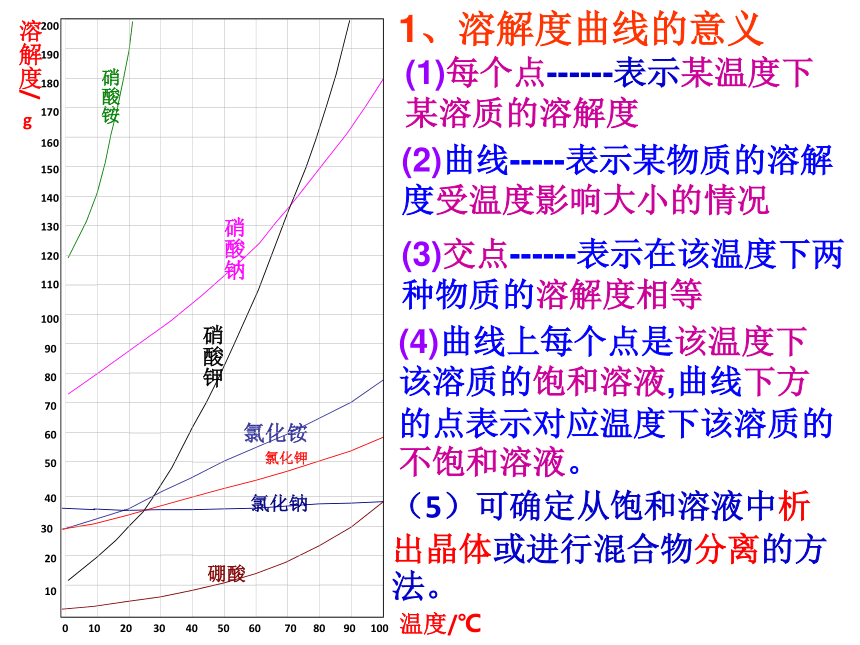
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的A点表示什么意义? 练习:2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。47g44g60gA.B.3、B点表示什么意思?表示在该点所示的温度(68 ℃ )时,硝酸钠和硝酸钾两种物质的溶解度相等(134克)。 60
70
808
50
10
20
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:68134g小于B.氯化铵、氯化钾、氯化钠、硼酸一、根据溶解度曲线回答 ;
1、 ℃时硝酸钠的溶解度为80克;
2、10 ℃时硝酸铵的溶解度为 ;
3、 ℃时硝酸钠与硝酸钾的溶解度相等,为 克。
4、20 ℃时硝酸钠 、氯化铵、氯化钠 硝酸钾四种物质的溶解度由高到低的顺序排列为 。
5、10 ℃时150克硝酸铵投入100克水中充分搅拌所得溶液
为 溶液(填“饱和或不饱和”);温度升高到20 ℃,所得溶液为 溶液。10140克70135硝酸钠 氯化铵 氯化钠 硝酸钾 饱和不饱和读图:
1、大多数固体的溶解度与温度的关是 ;
2、温度对溶解度影响最大的物质是 ,影响最小的物质是 ;
3、极少数固体的溶解度(如 )随温度的升高而 。随温度的升高而增大硝酸钾熟石灰减少氯化钠氢氧化钙的溶解度曲线甲乙丙B温度(℃)溶解度
(g/100g水)T1 T2(1)T2时,溶解度最大的是________;(2)B点代表的含义是
_______________________
_______________;(3)T1时的甲溶液升温到T2,甲溶液变成
_______________. 甲T1℃时,甲、丙两种物质
的溶解度相等不饱和溶液4.某物质的溶解度如图所示。在一个大烧杯中装着该物质的饱和溶液,而且杯中还有少量该物质固体存在,现将温度由60℃降到20℃,下列说法正确的是( )
A.杯中固体减少
B.杯中固体增多
C.杯中固体不变B60℃20℃活动比较不同物质在溶解过程中的能量变化 实验表明,在溶质溶解于水的过程中都伴随着能量的变化,有些有明显的放热或吸热现象,有些则温度变化不明显。特例:
1、 氢氧化钠、生石灰(氧化钙)溶解于水中放热,溶液温度升高。
2、 硝酸铵溶解于水中吸热,溶液温度降低。 人们利用某些物质在溶于水的过程中会放出大量的热的性质,为野外工作者设计了方便、安全的自热罐头;反之,人们用硝酸铵制作冰袋。应用——自热罐头和冰袋
------温度对不同物质的溶解能力(溶解度)的影响不同。思考:不同温度下物质溶解度怎么表示?三:不同温度下物质溶解度表示的方法硝酸钾701、列表法2、曲线法(1)每个点------表示某温度下某溶质的溶解度(2)曲线-----表示某物质的溶解度受温度影响大小的情况(3)交点------表示在该温度下两种物质的溶解度相等(4)曲线上每个点是该温度下该溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。1、溶解度曲线的意义(5)可确定从饱和溶液中析出晶体或进行混合物分离的方法。0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃熟石灰(氢氧化钙)的溶解度曲线:讨论:
固体物质溶解度受温度变化影响情况:(2、规律) 1、大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。 2、少数固体物质溶解度受温度影响不大, 例如食盐。3、极少数固体物质溶解度随温度升高反而减小,例如熟石灰(氢氧化钙)。3、饱和溶液和不饱和溶液的相互转化饱和溶液不饱和溶液思考:
给你一杯饱和溶液,怎样可以变成不饱和溶液?加溶剂、一般升温加溶质、恒温蒸发、一般降温思考:
给你一杯饱和溶液,怎样得到溶质晶体?1、溶解度随温度升高而增大的,降温结晶
2、溶解度随温度升高而减小的,升温结晶思考:
给你一杯溶解了两种溶质的溶液,怎样把两种溶质分离?(例如:硝酸钾和硝酸钠)3、分离法(一般随温度变化大的)降温(冷却)结晶思考:
溶解度的大小与哪些因素有关?与 温度、溶质种类、
溶剂种类有关练习: 1、什么叫溶解度?理解这个概念时要把握哪四个要素(关键)? 2、20℃时,氯化钠的溶解度是36g。则20℃时,氯化钠饱和溶液中溶质、溶剂、饱和溶液的质量比是_________________。 3、在20℃时,50g水最多能溶解7.4g某物质,则这种物质属于( )
A、易溶物质 B、可溶物质
C、微溶物质 D、难溶物质36:100:136A50
10
20
30
40
0
60
70
808
90
100
50
10
20
30
40
80
60
70
8 0
90
100
110
180
170
160
150
140
130
120
190
200
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钾
氯化钠
硼酸
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的A点表示什么意义? 练习:2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。47g44g60gA.B.3、B点表示什么意思?表示在该点所示的温度(68 ℃ )时,硝酸钠和硝酸钾两种物质的溶解度相等(134克)。 60
70
808
50
10
20
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:68134g小于B.氯化铵、氯化钾、氯化钠、硼酸一、根据溶解度曲线回答 ;
1、 ℃时硝酸钠的溶解度为80克;
2、10 ℃时硝酸铵的溶解度为 ;
3、 ℃时硝酸钠与硝酸钾的溶解度相等,为 克。
4、20 ℃时硝酸钠 、氯化铵、氯化钠 硝酸钾四种物质的溶解度由高到低的顺序排列为 。
5、10 ℃时150克硝酸铵投入100克水中充分搅拌所得溶液
为 溶液(填“饱和或不饱和”);温度升高到20 ℃,所得溶液为 溶液。10140克70135硝酸钠 氯化铵 氯化钠 硝酸钾 饱和不饱和读图:
1、大多数固体的溶解度与温度的关是 ;
2、温度对溶解度影响最大的物质是 ,影响最小的物质是 ;
3、极少数固体的溶解度(如 )随温度的升高而 。随温度的升高而增大硝酸钾熟石灰减少氯化钠氢氧化钙的溶解度曲线甲乙丙B温度(℃)溶解度
(g/100g水)T1 T2(1)T2时,溶解度最大的是________;(2)B点代表的含义是
_______________________
_______________;(3)T1时的甲溶液升温到T2,甲溶液变成
_______________. 甲T1℃时,甲、丙两种物质
的溶解度相等不饱和溶液4.某物质的溶解度如图所示。在一个大烧杯中装着该物质的饱和溶液,而且杯中还有少量该物质固体存在,现将温度由60℃降到20℃,下列说法正确的是( )
A.杯中固体减少
B.杯中固体增多
C.杯中固体不变B60℃20℃活动比较不同物质在溶解过程中的能量变化 实验表明,在溶质溶解于水的过程中都伴随着能量的变化,有些有明显的放热或吸热现象,有些则温度变化不明显。特例:
1、 氢氧化钠、生石灰(氧化钙)溶解于水中放热,溶液温度升高。
2、 硝酸铵溶解于水中吸热,溶液温度降低。 人们利用某些物质在溶于水的过程中会放出大量的热的性质,为野外工作者设计了方便、安全的自热罐头;反之,人们用硝酸铵制作冰袋。应用——自热罐头和冰袋
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
