专题1.4.1分离、提纯-2017-2018学年高二化学人教版(选修5)Word版含解析
文档属性
| 名称 | 专题1.4.1分离、提纯-2017-2018学年高二化学人教版(选修5)Word版含解析 |

|
|
| 格式 | zip | ||
| 文件大小 | 375.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-03 00:00:00 | ||
图片预览



文档简介
第一章 认识有机化合物
第四节 研究有机化合物的一般步骤和方法
第1课时 分离、提纯
1.蒸馏
(1)蒸馏原理
蒸馏的原理是在一定温度和压强下加热液态混合物,________的物质或组分首先气化,将其蒸气导出后再进行______,从而达到与________的物质或组分相分离的目的。
(2)应用范围:分离、提纯__________有机物。
(3)适用条件
①有机物热稳定性__________。
②有机物与杂质的沸点相差__________(一般约__________)。
(4)装置
①仪器A的名称是________。
②仪器B的名称是________。
③仪器C的名称是________。
④仪器D的名称是________。
(5)实验步骤
在250 mL蒸馏烧瓶中加入100 mL工业乙醇,再在烧瓶中投入少量素烧瓷片,安装好蒸馏装置,向冷凝器中通入冷却水,加热蒸馏。
①加素烧瓷片的目的是______________________________________________________。
②温度计水银球应处于_____________________________________________________。
③冷却水进出水方向是_____________________________________________________。
(6)实验结果
收集77~79 ℃的馏分为95.6%的________和4.4%____的共沸混合物。
2.重结晶
(1)重结晶原理
利用有机物和杂质在同一溶剂中________________相差较大,采用冷却或蒸发将有机物分离出来,是提纯______有机物的常用方法。
(2)应用范围:提纯__________有机物。
(3)适用条件
①杂质在此溶剂中溶解度__________,易除去。
②被提纯的有机物在该溶剂中的溶解度受温度的影响__________。
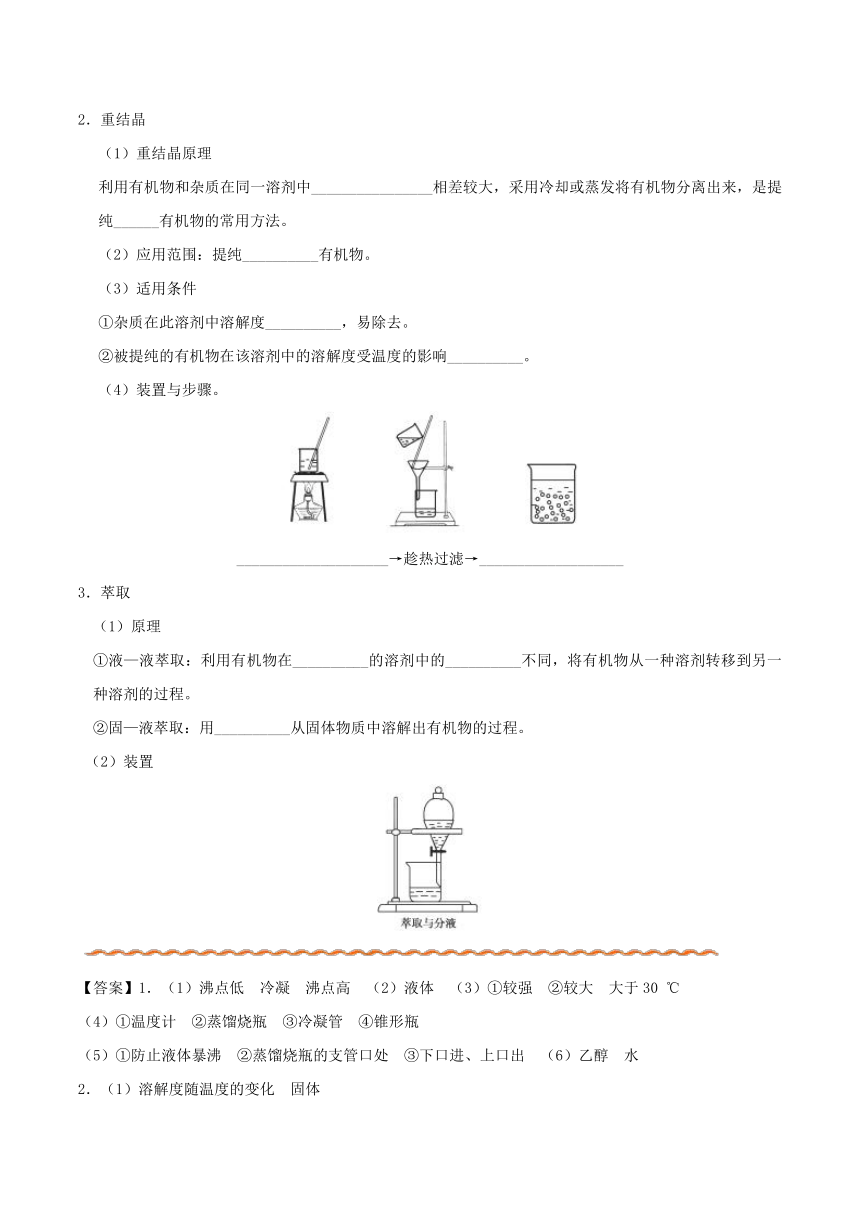
(4)装置与步骤。
____________________→趁热过滤→___________________
3.萃取
(1)原理
①液—液萃取:利用有机物在__________的溶剂中的__________不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用__________从固体物质中溶解出有机物的过程。
(2)装置
【答案】1.(1)沸点低 冷凝 沸点高 (2)液体 (3)①较强 ②较大 大于30 ℃
(4)①温度计 ②蒸馏烧瓶 ③冷凝管 ④锥形瓶
(5)①防止液体暴沸 ②蒸馏烧瓶的支管口处 ③下口进、上口出 (6)乙醇 水
2.(1)溶解度随温度的变化 固体
(2)固体 (3)①很小或溶解度很大 ②较大 (4)加热溶解 冷却结晶
3.(1)①两种互不相溶 溶解性 ②有机溶剂
一、选择有机化合物分离提纯的方法
1.首先要熟记各种分离和提纯方法的适用范围。常见的分离和提纯有机物的方法及适用范围如下表。
方法 适用范围
分液 互不相溶、分层的两种液体
萃取 同温度下溶质在两种互不相溶的溶剂中的溶解度相差很大
蒸馏 液态有机物与杂质的沸点相差较大(一般大于30 ℃)且热稳定性强
重结晶 被提纯有机物的溶解度受温度影响较大而杂质的溶解度受温度影响不大
2.研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
和的一些物理性质如下表所示:
物质 熔点/℃ 沸点/℃ 密度/g· cm-3 水溶性
-10 212 1.162 2 不溶
54 238 1.158 1 不溶
(1)分离这两种物质的混合物可采用的方法是________(填字母)。
a.过滤 b.分液 c.蒸发 d.蒸馏
(2)实验需要用到的主要玻璃仪器是________、________、________、________、________、牛角管。
【解析】由于这两种有机物不溶于水,所以不宜利用溶解度的差异性来分离,而二者的沸点相差较大,所以采用蒸馏方法分离。
【答案】(1)d
(2)酒精灯 蒸馏烧瓶 温度计 冷凝管 锥形瓶
二、物质分离和提纯的物理方法
物质状态 分离方法 适用范围 所需仪器 操作要点 实例
固—固 结晶与重结晶 蒸发溶剂或降温使某溶质达到过饱和而从溶剂中结晶析出,其他溶质因没有达到饱和而留在母液中 蒸发皿、酒精灯、三脚架(铁架台)、坩埚钳、玻璃棒 ①液体不超过容积的2/3;②加热时不断搅拌 分离NaCl和KNO3的混合物
升华 分离固体混合物中受热易升华与不易升华的物质 酒精灯、烧杯、三脚架(铁架台)、烧瓶(盛有冷水) 加热要垫石棉网 分离KI和I2
固—液 过滤 分离固(不溶)、液混合物 普通漏斗(或抽滤漏斗)、烧杯、玻璃棒、滤纸、铁架台 ①一贴、二低、三靠;②沉淀要洗涤;③定量实验要“无损” 除去粗盐中的泥沙
液—液 萃取 从液体中提纯液态有机物 分液漏斗、烧杯、铁架台 ①先查漏;②萃取剂的选择;③要充分振荡;④下层液体从下口放出,上层液体从上口倒出 利用CCl4从溴水中萃取溴
分液 分离互不相溶的液体混合物 分液漏斗、烧杯、铁架台 CCl4和水的分离
蒸馏(分馏) ①难挥发的固体杂质在液体中形成的混合物②沸点不同的液体混合物 蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计、酒精灯、铁架台 ①要加沸石;②温度计水银球位于蒸馏烧瓶支管口处;③冷凝管的冷却水是下口进,上口出 石油的分馏
渗析 分离胶体与混在其中的分子、离子 烧杯、半透膜 更换蒸馏水 除去淀粉胶体中的NaCl溶液
盐析 利用某些物质在加某些无机盐时,其溶解度降低而聚沉的性质来分离物质 烧杯、玻璃棒 无机盐的浓度要尽量大,或用固体盐 从皂化液中分离肥皂、甘油;蛋白质的盐析
气—气 洗气 分离易溶(或与试剂反应)气体与难溶气体 洗气瓶 长进短出 除去CO2气体中的HCl
液化 分离沸点不同的气体 U形管 常用冰水 分离空气中的N2和O2
下列各组液体混合物,可以用分液漏斗分离的是
A.乙醇和水 B.溴乙烷和水 C.溴乙烷和氯仿 D.苯和溴苯
【答案】B
1.关于蒸馏的实验操作说法正确的是
A.蒸馏的原理是利用混合物中各组分的沸点不同实现分离
B.蒸馏烧瓶可以用酒精灯直接加热
C.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
D.苯和水的混合物最好用蒸馏的方法进行分离
2.纯碱和氯化钠的溶解度曲线如下,将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
A.蒸馏法 B.萃取法 C.重结晶法 D.分液法
3.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是
A.在组装蒸馏装置时,温度计的水银球应伸入液面下
B.用96%的工业酒精制取无水乙醇,可采用直接蒸馏的方法
C.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加入少量蒸馏水
D.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤
4.已知乙酸异戊酯是难溶于水且密度比水小的液体。在洗涤、分液操作中,应充分振荡,然后静置,待分层后的操作是
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
5.可以用分液漏斗分离的一组物质是
A.溴和四氯化碳 B.苯和溴苯
C.酒精和水 D.硝基苯和水
6.天然色素的提取往往采用萃取操作,下列溶剂不能用来萃取水溶液中的天然色素的是
A.石油醚 B.二氯甲烷 C.乙醇 D.乙醚
7.以下实验装置一般不用于分离物质的是
8.现有三组混合液:①乙酸乙酯和乙酸钠;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、分液、蒸馏
C.萃取、蒸馏、分液 D.分液、蒸馏、萃取
9.实验室制备苯甲醇和苯甲酸的原理如下:
2+KOH+
+HCl+KCl
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示:
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是______________,乙醚溶液中所溶解的主要成分是_____________。
(2)操作Ⅱ的名称是______________,产品甲是___________________。
(3)操作Ⅲ的名称是_________________,产品乙是__________________。
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是______________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是_________________,收集产品甲的适宜温度为______________。
10.[2017天津]以下实验设计能达到实验目的的是
实验目的 实验设计
A.除去NaHCO3固体中的Na2CO3 将固体加热至恒重B.制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液C.重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶D.鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取
1.【答案】A
2.【答案】C
【解析】图像中纯碱的溶解度随温度变化很大,氯化钠的溶解度随温度变化不大,所以,采用在热水中溶解、降温,纯碱则析出,然后过滤,氯化钠留在水溶液中。即采用重结晶的方法。
3.【答案】C
【解析】A.在组装蒸馏装置时,温度计的水银球应位于烧瓶支管口处,错误;B.乙醇会与水形成共沸物,直接蒸馏无法分离二者,错误;D.要趁热过滤,错误。
4.【答案】D
【解析】乙酸异戊酯的密度比水小,所以在分液漏斗中乙酸异戊酯在上层,水在下层,分液时应先将水从下口放出,再把乙酸异戊酯从上口倒出。
5.【答案】D
【解析】互不相溶的两种液体才能分层,可利用分液漏斗进行分离。A、B、C三项中的两物质互溶,而D项中两物质是互不相溶的。
6.【答案】C
【解析】把色素从水溶液中萃取出来,可用有机溶剂,但乙醇与水互溶,所以不能作萃取剂。
7.【答案】D
【解析】A项是蒸馏,B项是渗析,C项是过滤,它们都是分离提纯物质的常用方法。而D项是配制一定物质的量浓度的溶液的操作。
8.【答案】D
9.【答案】(1)萃取分液 苯甲醇
(2)蒸馏 苯甲醇
(3)过滤 苯甲酸
(4)b 冷凝管、酒精灯、锥形瓶、尾接管 205.3 ℃
【解析】(1)由题意可知,白色糊状物为苯甲醇和苯甲酸钾,加入水和乙醚后,根据相似相溶原理,乙醚中溶有苯甲醇,水中溶有苯甲酸钾,两种液体可用萃取分液法分离。
(2)溶解在乙醚中的苯甲醇沸点远高于乙醚,可采用蒸馏法分离。
(3)加入盐酸后生成的苯甲酸为微溶于水的晶体,可采用过滤法分离。
10.【答案】D
【解析】A、加热碳酸氢纳分解生成了碳酸钠,不能达到实验目的;B、直接蒸发Al与稀盐酸反应生成的AlCl3溶液,铝离子发生水解,最终得到的是Al(OH)3,不能达到实验目的;C、重结晶法提纯苯甲酸的方法是:将粗品水溶,趁热过滤,滤液冷却结晶即可;D、NaBr和NaI都能与氯水反应生成对应的单质,再用四氯化碳萃取,颜色层不同,NaBr的为橙红色,KI的为紫红色。故选D。
聚乙烯塑料——试出来的发明
20世纪30年代,英国两位化学家法维克特和基普森联手研发新产品,他们混合各种有机物,设定各种条件,以期合成一种新物质。当他们将乙烯和苯甲醛混合,在加温加压条件下反应时,助手不慎碰坏了容器,实验终止。但是两人在容器内意外地发现一种白色、蜡状物质,这就是聚乙烯。后来又经过反复试验,他们发明了工业化生产聚乙烯的方法,由此聚乙烯正式登上历史舞台。
第四节 研究有机化合物的一般步骤和方法
第1课时 分离、提纯
1.蒸馏
(1)蒸馏原理
蒸馏的原理是在一定温度和压强下加热液态混合物,________的物质或组分首先气化,将其蒸气导出后再进行______,从而达到与________的物质或组分相分离的目的。
(2)应用范围:分离、提纯__________有机物。
(3)适用条件
①有机物热稳定性__________。
②有机物与杂质的沸点相差__________(一般约__________)。
(4)装置
①仪器A的名称是________。
②仪器B的名称是________。
③仪器C的名称是________。
④仪器D的名称是________。
(5)实验步骤
在250 mL蒸馏烧瓶中加入100 mL工业乙醇,再在烧瓶中投入少量素烧瓷片,安装好蒸馏装置,向冷凝器中通入冷却水,加热蒸馏。
①加素烧瓷片的目的是______________________________________________________。
②温度计水银球应处于_____________________________________________________。
③冷却水进出水方向是_____________________________________________________。
(6)实验结果
收集77~79 ℃的馏分为95.6%的________和4.4%____的共沸混合物。
2.重结晶
(1)重结晶原理
利用有机物和杂质在同一溶剂中________________相差较大,采用冷却或蒸发将有机物分离出来,是提纯______有机物的常用方法。
(2)应用范围:提纯__________有机物。
(3)适用条件
①杂质在此溶剂中溶解度__________,易除去。
②被提纯的有机物在该溶剂中的溶解度受温度的影响__________。
(4)装置与步骤。
____________________→趁热过滤→___________________
3.萃取
(1)原理
①液—液萃取:利用有机物在__________的溶剂中的__________不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用__________从固体物质中溶解出有机物的过程。
(2)装置
【答案】1.(1)沸点低 冷凝 沸点高 (2)液体 (3)①较强 ②较大 大于30 ℃
(4)①温度计 ②蒸馏烧瓶 ③冷凝管 ④锥形瓶
(5)①防止液体暴沸 ②蒸馏烧瓶的支管口处 ③下口进、上口出 (6)乙醇 水
2.(1)溶解度随温度的变化 固体
(2)固体 (3)①很小或溶解度很大 ②较大 (4)加热溶解 冷却结晶
3.(1)①两种互不相溶 溶解性 ②有机溶剂
一、选择有机化合物分离提纯的方法
1.首先要熟记各种分离和提纯方法的适用范围。常见的分离和提纯有机物的方法及适用范围如下表。
方法 适用范围
分液 互不相溶、分层的两种液体
萃取 同温度下溶质在两种互不相溶的溶剂中的溶解度相差很大
蒸馏 液态有机物与杂质的沸点相差较大(一般大于30 ℃)且热稳定性强
重结晶 被提纯有机物的溶解度受温度影响较大而杂质的溶解度受温度影响不大
2.研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
和的一些物理性质如下表所示:
物质 熔点/℃ 沸点/℃ 密度/g· cm-3 水溶性
-10 212 1.162 2 不溶
54 238 1.158 1 不溶
(1)分离这两种物质的混合物可采用的方法是________(填字母)。
a.过滤 b.分液 c.蒸发 d.蒸馏
(2)实验需要用到的主要玻璃仪器是________、________、________、________、________、牛角管。
【解析】由于这两种有机物不溶于水,所以不宜利用溶解度的差异性来分离,而二者的沸点相差较大,所以采用蒸馏方法分离。
【答案】(1)d
(2)酒精灯 蒸馏烧瓶 温度计 冷凝管 锥形瓶
二、物质分离和提纯的物理方法
物质状态 分离方法 适用范围 所需仪器 操作要点 实例
固—固 结晶与重结晶 蒸发溶剂或降温使某溶质达到过饱和而从溶剂中结晶析出,其他溶质因没有达到饱和而留在母液中 蒸发皿、酒精灯、三脚架(铁架台)、坩埚钳、玻璃棒 ①液体不超过容积的2/3;②加热时不断搅拌 分离NaCl和KNO3的混合物
升华 分离固体混合物中受热易升华与不易升华的物质 酒精灯、烧杯、三脚架(铁架台)、烧瓶(盛有冷水) 加热要垫石棉网 分离KI和I2
固—液 过滤 分离固(不溶)、液混合物 普通漏斗(或抽滤漏斗)、烧杯、玻璃棒、滤纸、铁架台 ①一贴、二低、三靠;②沉淀要洗涤;③定量实验要“无损” 除去粗盐中的泥沙
液—液 萃取 从液体中提纯液态有机物 分液漏斗、烧杯、铁架台 ①先查漏;②萃取剂的选择;③要充分振荡;④下层液体从下口放出,上层液体从上口倒出 利用CCl4从溴水中萃取溴
分液 分离互不相溶的液体混合物 分液漏斗、烧杯、铁架台 CCl4和水的分离
蒸馏(分馏) ①难挥发的固体杂质在液体中形成的混合物②沸点不同的液体混合物 蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计、酒精灯、铁架台 ①要加沸石;②温度计水银球位于蒸馏烧瓶支管口处;③冷凝管的冷却水是下口进,上口出 石油的分馏
渗析 分离胶体与混在其中的分子、离子 烧杯、半透膜 更换蒸馏水 除去淀粉胶体中的NaCl溶液
盐析 利用某些物质在加某些无机盐时,其溶解度降低而聚沉的性质来分离物质 烧杯、玻璃棒 无机盐的浓度要尽量大,或用固体盐 从皂化液中分离肥皂、甘油;蛋白质的盐析
气—气 洗气 分离易溶(或与试剂反应)气体与难溶气体 洗气瓶 长进短出 除去CO2气体中的HCl
液化 分离沸点不同的气体 U形管 常用冰水 分离空气中的N2和O2
下列各组液体混合物,可以用分液漏斗分离的是
A.乙醇和水 B.溴乙烷和水 C.溴乙烷和氯仿 D.苯和溴苯
【答案】B
1.关于蒸馏的实验操作说法正确的是
A.蒸馏的原理是利用混合物中各组分的沸点不同实现分离
B.蒸馏烧瓶可以用酒精灯直接加热
C.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
D.苯和水的混合物最好用蒸馏的方法进行分离
2.纯碱和氯化钠的溶解度曲线如下,将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
A.蒸馏法 B.萃取法 C.重结晶法 D.分液法
3.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是
A.在组装蒸馏装置时,温度计的水银球应伸入液面下
B.用96%的工业酒精制取无水乙醇,可采用直接蒸馏的方法
C.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加入少量蒸馏水
D.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤
4.已知乙酸异戊酯是难溶于水且密度比水小的液体。在洗涤、分液操作中,应充分振荡,然后静置,待分层后的操作是
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
5.可以用分液漏斗分离的一组物质是
A.溴和四氯化碳 B.苯和溴苯
C.酒精和水 D.硝基苯和水
6.天然色素的提取往往采用萃取操作,下列溶剂不能用来萃取水溶液中的天然色素的是
A.石油醚 B.二氯甲烷 C.乙醇 D.乙醚
7.以下实验装置一般不用于分离物质的是
8.现有三组混合液:①乙酸乙酯和乙酸钠;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、分液、蒸馏
C.萃取、蒸馏、分液 D.分液、蒸馏、萃取
9.实验室制备苯甲醇和苯甲酸的原理如下:
2+KOH+
+HCl+KCl
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示:
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是______________,乙醚溶液中所溶解的主要成分是_____________。
(2)操作Ⅱ的名称是______________,产品甲是___________________。
(3)操作Ⅲ的名称是_________________,产品乙是__________________。
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是______________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是_________________,收集产品甲的适宜温度为______________。
10.[2017天津]以下实验设计能达到实验目的的是
实验目的 实验设计
A.除去NaHCO3固体中的Na2CO3 将固体加热至恒重B.制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液C.重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶D.鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取
1.【答案】A
2.【答案】C
【解析】图像中纯碱的溶解度随温度变化很大,氯化钠的溶解度随温度变化不大,所以,采用在热水中溶解、降温,纯碱则析出,然后过滤,氯化钠留在水溶液中。即采用重结晶的方法。
3.【答案】C
【解析】A.在组装蒸馏装置时,温度计的水银球应位于烧瓶支管口处,错误;B.乙醇会与水形成共沸物,直接蒸馏无法分离二者,错误;D.要趁热过滤,错误。
4.【答案】D
【解析】乙酸异戊酯的密度比水小,所以在分液漏斗中乙酸异戊酯在上层,水在下层,分液时应先将水从下口放出,再把乙酸异戊酯从上口倒出。
5.【答案】D
【解析】互不相溶的两种液体才能分层,可利用分液漏斗进行分离。A、B、C三项中的两物质互溶,而D项中两物质是互不相溶的。
6.【答案】C
【解析】把色素从水溶液中萃取出来,可用有机溶剂,但乙醇与水互溶,所以不能作萃取剂。
7.【答案】D
【解析】A项是蒸馏,B项是渗析,C项是过滤,它们都是分离提纯物质的常用方法。而D项是配制一定物质的量浓度的溶液的操作。
8.【答案】D
9.【答案】(1)萃取分液 苯甲醇
(2)蒸馏 苯甲醇
(3)过滤 苯甲酸
(4)b 冷凝管、酒精灯、锥形瓶、尾接管 205.3 ℃
【解析】(1)由题意可知,白色糊状物为苯甲醇和苯甲酸钾,加入水和乙醚后,根据相似相溶原理,乙醚中溶有苯甲醇,水中溶有苯甲酸钾,两种液体可用萃取分液法分离。
(2)溶解在乙醚中的苯甲醇沸点远高于乙醚,可采用蒸馏法分离。
(3)加入盐酸后生成的苯甲酸为微溶于水的晶体,可采用过滤法分离。
10.【答案】D
【解析】A、加热碳酸氢纳分解生成了碳酸钠,不能达到实验目的;B、直接蒸发Al与稀盐酸反应生成的AlCl3溶液,铝离子发生水解,最终得到的是Al(OH)3,不能达到实验目的;C、重结晶法提纯苯甲酸的方法是:将粗品水溶,趁热过滤,滤液冷却结晶即可;D、NaBr和NaI都能与氯水反应生成对应的单质,再用四氯化碳萃取,颜色层不同,NaBr的为橙红色,KI的为紫红色。故选D。
聚乙烯塑料——试出来的发明
20世纪30年代,英国两位化学家法维克特和基普森联手研发新产品,他们混合各种有机物,设定各种条件,以期合成一种新物质。当他们将乙烯和苯甲醛混合,在加温加压条件下反应时,助手不慎碰坏了容器,实验终止。但是两人在容器内意外地发现一种白色、蜡状物质,这就是聚乙烯。后来又经过反复试验,他们发明了工业化生产聚乙烯的方法,由此聚乙烯正式登上历史舞台。
