专题2.2.1化学能转化为电能-课时同步2017-2018学年高一化学人教版(必修2)
文档属性
| 名称 | 专题2.2.1化学能转化为电能-课时同步2017-2018学年高一化学人教版(必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 735.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-08 09:34:45 | ||
图片预览




文档简介
第二章 化学反应与能量
2. 2.1 化学能转化为电能
(时间:40分钟)
一、选择题
1.有关电化学知识的描述正确的是
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可利用该反应设计成原电池,把其中的化学能转化为电能
B.原电池的两极一定是由活动性不同的两种金属组成
C.从理论上讲,任何能自发进行的氧化还原反应都可设计成原电池
D.原电池工作时,正极表面一定有气泡产生
【答案】C
有气泡产生,如铁?铜?硫酸铜原电池,正极上析出铜固体,故D错误;故选C。
2.下列说法正确的是
A.原电池是把电能转变成化学能的装置
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化反应和还原反应
D.原电池内部的阳离子向正极移动
【答案】D
【解析】要综合考虑原电池的概念、电极反应、电子移动的方向和电流方向。原电池是把化学能转变为电能的装置,A项错;原电池中的电子移动方向是:负极→外电路→正极,可见B项错;阳离子向正极移动,得电子,发生还原反应,D项正确;在原电池中负极失去电子,发生氧化反应,而正极可以是溶液中的离子或空气中的氧气发生还原反应,C项错。
3.下列装置可以构成原电池的是
【答案】C
【解析】A项,两个电极的材料均为锌,活动性相同,无法构成原电池;B项,蔗糖溶液为非电解质溶液,无法构成原电池;D项,没有形成通路,无法构成原电池。
4.下列反应不可能作为原电池工作时发生的反应的是
A.Cu+2AgNO3===Cu(NO3)2+2Ag
B.2Fe+O2+2H2O===2Fe(OH)2
C.2H2+O2===2H2O
D.NaOH+HCl===NaCl+H2O
【答案】D
5.下图各装置中,能形成原电池的是
A.①中液体为FeCl3溶液 B.②中液体为酒精
C.③中液体为H2SO4溶液 D.④中液体为稀盐酸
【答案】A
【解析】A、该装置符合原电池的构成条件,所以能形成原电池,故A正确;B、乙醇不是电解质溶液,金属锌和乙醇不能自发的进行氧化还原反应,所以不能构成原电池,故B错误;C、因为两电极的活泼性相同,所以该装置不能构成原电池,故C错误;D、该装置没有构成闭合回路,所以不能形成原电池,故D错误;故选A。
6.已知空气—锌电池的电极反应式为
锌片:Zn+2OH??2e?ZnO+H2O;
碳棒:O2+H2O+2e?2OH?。
据此判断,锌片为
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
【答案】D
【解析】Zn失去电子发生氧化反应,作负极。
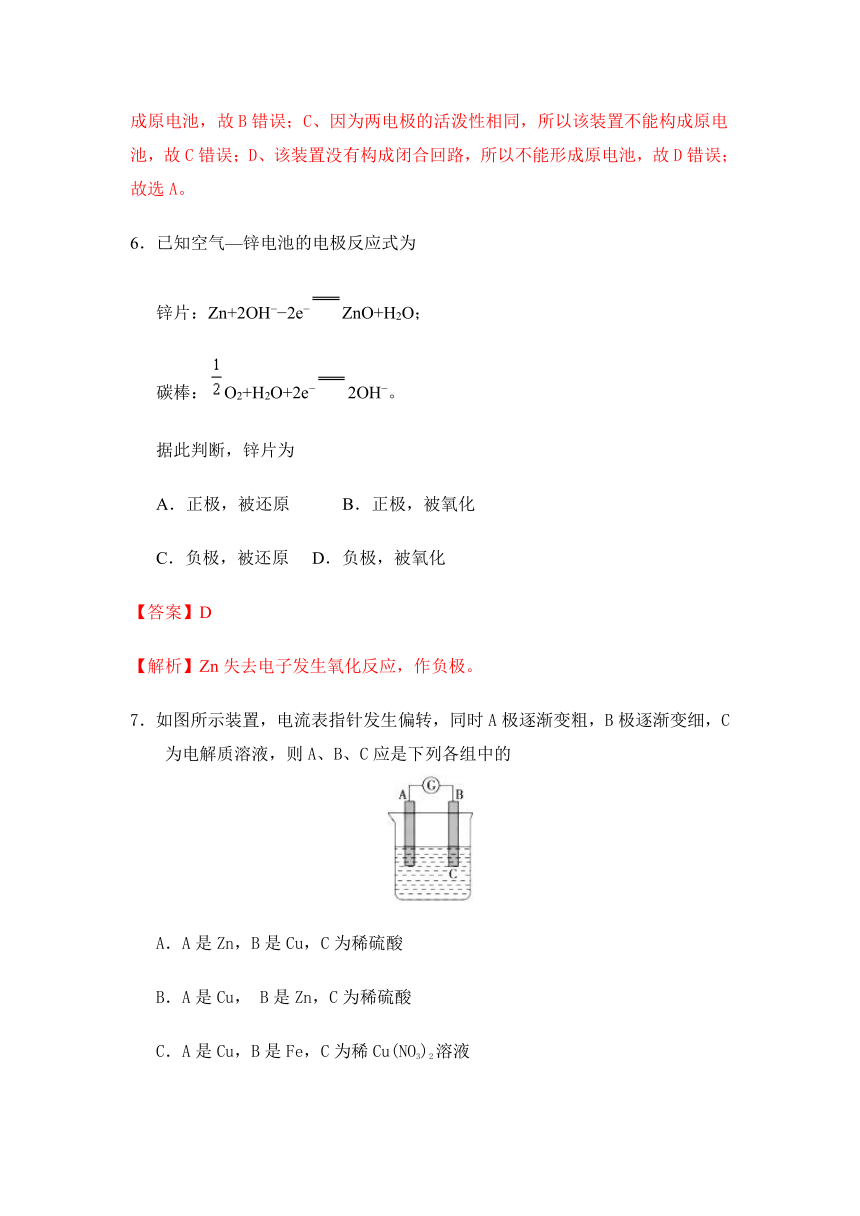
7.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu, B是Zn,C为稀硫酸
C.A是Cu,B是Fe,C为稀Cu(NO3)2溶液
D.A是Fe,B是Ag,C为稀AgNO3溶液
【答案】C
项析出金属,所以C 符合题意,故选C 。
8.把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、c相连时c极上产生大量气泡;b、d相连时b为正极;c、d相连时,电流由d到c.则这四种金属的活动性顺序由大到小为
A.a>c>d>b B.a>b>c>d C.c>a>b>d D.b>d>c>a
【答案】A
【解析】由a、b相连时a为负极得,a的活泼性大于b;由a、c相连时c极上产生大量气泡得,a的活泼性大于c;由b、d相连时b为正极得,d的活泼性大于b;由c、d相连时,电流由d到c得,c的活泼性大于d,所以金属的活动性顺序由大到小为a>c>d>b,答案选A。
9.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为: Fe?2e?===Fe2+
C.a和b用导线连接时,电子从Cu片流向铁片
D.a和b用导线连接时,Cu2+向铜电极移动
【答案】C
线连接时,该装置是原电池,原电池中阳离子Cu2+向正极铜电极移动,选项D正确。
10.某原电池装置如图所示,电池总反应为2Ag+Cl22AgCl。下列说法正确的是
A.正极反应为AgCl+e?Ag+Cl?
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e?时,交换膜左侧溶液中约减少0.02 mol离子
【答案】D
【解析】根据电池总反应可以看出Cl2得电子,Ag失电子,所以在原电池中Cl2在正极上发生还原反应,Ag在负极上发生氧化反应。正极反应为Cl2+2e?===2Cl?,A项错误;因为电解质溶液为盐酸,所以负极上Ag失电子生成的Ag+随即与附近的Cl?反应,B项错误;用氯化钠代替盐酸后,电极反应不发生改变,C项错误;当电路中转移0.01 mol e?时,负极生成0.01 mol Ag+,由于Ag++Cl?AgCl↓,所以消耗掉0.01 mol Cl?,由于电荷守恒,同时有0.01 mol H+通过阳离子变换膜转移至右侧溶液中,D项正确。
二、非选择题
11.利用反应2Cu+O2+2H2SO42CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是________(写名称),电极反应式为_____________________________________。
(2)正极电极反应式为___________________________________________________________。
(3)溶液中向________极移动。
【答案】(1)铜 Cu?2e?===Cu2+
(2)O2+4e?+4H+===2H2O
(3)负
12.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
回答下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)________(填 “相同”或“不同”)。
(2)对实验3完成下列填空:
①铝为________极,电极反应式为___________________________。
②石墨为________极,电极反应式为__________________________。
③电池总反应式为________________________________。
(3)实验4中铝作________极(填“负”或“正”),理由是_________________________。此电池反应的离子方程式为_________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为________________________。
【答案】(1)不同
(2)①负 2Al?6e?===2Al3+
②正 6H++6e?===3H2↑
③2Al+6H+===2Al3++3H2↑
(3)负 铝与NaOH溶液可以发生自发的氧化还原反应 2Al+2OH?+2H2O===2+3H2↑
(4)另一电极材料的活动性和电解质溶液能否与其发生氧化还原反应
电解质溶液能否发生自发的氧化还原反应。
13.分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
(1)以下叙述中,正确的是__________。
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是____________。
(3)装置B中正极反应式为____________,负极反应式为____________。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是__________。
【答案】(1)ACD
(2)化学能转化为电能
(3)2H++2e?===H2↑ Fe?2e?===Fe2+
(4)否 不是氧化还原反应
(2)装置B形成原电池,变化过程中能量转化的形式主要是化学能转化为电能。
(3)Sn作正极,正极上氢离子得电子生成氢气装置B中正极反应式为 2H++2e?===H2↑,活泼金属锌作负极,电极反应为Fe,负极反应式为Fe?2e?===Fe2+。
(4)常温下自发进行的氧化还原反应,可设计成原电池,而Ba(OH)2·8H2O晶体与NH4Cl晶体的反应为非氧化还原反应,则不能设计成原电池。
2. 2.1 化学能转化为电能
(时间:40分钟)
一、选择题
1.有关电化学知识的描述正确的是
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可利用该反应设计成原电池,把其中的化学能转化为电能
B.原电池的两极一定是由活动性不同的两种金属组成
C.从理论上讲,任何能自发进行的氧化还原反应都可设计成原电池
D.原电池工作时,正极表面一定有气泡产生
【答案】C
有气泡产生,如铁?铜?硫酸铜原电池,正极上析出铜固体,故D错误;故选C。
2.下列说法正确的是
A.原电池是把电能转变成化学能的装置
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化反应和还原反应
D.原电池内部的阳离子向正极移动
【答案】D
【解析】要综合考虑原电池的概念、电极反应、电子移动的方向和电流方向。原电池是把化学能转变为电能的装置,A项错;原电池中的电子移动方向是:负极→外电路→正极,可见B项错;阳离子向正极移动,得电子,发生还原反应,D项正确;在原电池中负极失去电子,发生氧化反应,而正极可以是溶液中的离子或空气中的氧气发生还原反应,C项错。
3.下列装置可以构成原电池的是
【答案】C
【解析】A项,两个电极的材料均为锌,活动性相同,无法构成原电池;B项,蔗糖溶液为非电解质溶液,无法构成原电池;D项,没有形成通路,无法构成原电池。
4.下列反应不可能作为原电池工作时发生的反应的是
A.Cu+2AgNO3===Cu(NO3)2+2Ag
B.2Fe+O2+2H2O===2Fe(OH)2
C.2H2+O2===2H2O
D.NaOH+HCl===NaCl+H2O
【答案】D
5.下图各装置中,能形成原电池的是
A.①中液体为FeCl3溶液 B.②中液体为酒精
C.③中液体为H2SO4溶液 D.④中液体为稀盐酸
【答案】A
【解析】A、该装置符合原电池的构成条件,所以能形成原电池,故A正确;B、乙醇不是电解质溶液,金属锌和乙醇不能自发的进行氧化还原反应,所以不能构成原电池,故B错误;C、因为两电极的活泼性相同,所以该装置不能构成原电池,故C错误;D、该装置没有构成闭合回路,所以不能形成原电池,故D错误;故选A。
6.已知空气—锌电池的电极反应式为
锌片:Zn+2OH??2e?ZnO+H2O;
碳棒:O2+H2O+2e?2OH?。
据此判断,锌片为
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
【答案】D
【解析】Zn失去电子发生氧化反应,作负极。
7.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu, B是Zn,C为稀硫酸
C.A是Cu,B是Fe,C为稀Cu(NO3)2溶液
D.A是Fe,B是Ag,C为稀AgNO3溶液
【答案】C
项析出金属,所以C 符合题意,故选C 。
8.把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、c相连时c极上产生大量气泡;b、d相连时b为正极;c、d相连时,电流由d到c.则这四种金属的活动性顺序由大到小为
A.a>c>d>b B.a>b>c>d C.c>a>b>d D.b>d>c>a
【答案】A
【解析】由a、b相连时a为负极得,a的活泼性大于b;由a、c相连时c极上产生大量气泡得,a的活泼性大于c;由b、d相连时b为正极得,d的活泼性大于b;由c、d相连时,电流由d到c得,c的活泼性大于d,所以金属的活动性顺序由大到小为a>c>d>b,答案选A。
9.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为: Fe?2e?===Fe2+
C.a和b用导线连接时,电子从Cu片流向铁片
D.a和b用导线连接时,Cu2+向铜电极移动
【答案】C
线连接时,该装置是原电池,原电池中阳离子Cu2+向正极铜电极移动,选项D正确。
10.某原电池装置如图所示,电池总反应为2Ag+Cl22AgCl。下列说法正确的是
A.正极反应为AgCl+e?Ag+Cl?
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e?时,交换膜左侧溶液中约减少0.02 mol离子
【答案】D
【解析】根据电池总反应可以看出Cl2得电子,Ag失电子,所以在原电池中Cl2在正极上发生还原反应,Ag在负极上发生氧化反应。正极反应为Cl2+2e?===2Cl?,A项错误;因为电解质溶液为盐酸,所以负极上Ag失电子生成的Ag+随即与附近的Cl?反应,B项错误;用氯化钠代替盐酸后,电极反应不发生改变,C项错误;当电路中转移0.01 mol e?时,负极生成0.01 mol Ag+,由于Ag++Cl?AgCl↓,所以消耗掉0.01 mol Cl?,由于电荷守恒,同时有0.01 mol H+通过阳离子变换膜转移至右侧溶液中,D项正确。
二、非选择题
11.利用反应2Cu+O2+2H2SO42CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是________(写名称),电极反应式为_____________________________________。
(2)正极电极反应式为___________________________________________________________。
(3)溶液中向________极移动。
【答案】(1)铜 Cu?2e?===Cu2+
(2)O2+4e?+4H+===2H2O
(3)负
12.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
回答下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)________(填 “相同”或“不同”)。
(2)对实验3完成下列填空:
①铝为________极,电极反应式为___________________________。
②石墨为________极,电极反应式为__________________________。
③电池总反应式为________________________________。
(3)实验4中铝作________极(填“负”或“正”),理由是_________________________。此电池反应的离子方程式为_________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为________________________。
【答案】(1)不同
(2)①负 2Al?6e?===2Al3+
②正 6H++6e?===3H2↑
③2Al+6H+===2Al3++3H2↑
(3)负 铝与NaOH溶液可以发生自发的氧化还原反应 2Al+2OH?+2H2O===2+3H2↑
(4)另一电极材料的活动性和电解质溶液能否与其发生氧化还原反应
电解质溶液能否发生自发的氧化还原反应。
13.分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
(1)以下叙述中,正确的是__________。
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是____________。
(3)装置B中正极反应式为____________,负极反应式为____________。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是__________。
【答案】(1)ACD
(2)化学能转化为电能
(3)2H++2e?===H2↑ Fe?2e?===Fe2+
(4)否 不是氧化还原反应
(2)装置B形成原电池,变化过程中能量转化的形式主要是化学能转化为电能。
(3)Sn作正极,正极上氢离子得电子生成氢气装置B中正极反应式为 2H++2e?===H2↑,活泼金属锌作负极,电极反应为Fe,负极反应式为Fe?2e?===Fe2+。
(4)常温下自发进行的氧化还原反应,可设计成原电池,而Ba(OH)2·8H2O晶体与NH4Cl晶体的反应为非氧化还原反应,则不能设计成原电池。
