化学实验复习教案(广东省深圳市)
图片预览
文档简介
化学实验复习教案
[复习目的与要求]
1. 了解常见仪器的名称、图形、用途和基本操作原理;
2. 掌握重要气体制取的基本原理和方法,并根据气体的性质进行鉴别、除杂和推断;
3. 根据酸、碱、盐等物质的性质及相互反应,培养应用知识解决物质的鉴别、推断、转化、提纯的能力;
4. 依据实验的要求和条件,设计简单实验,做出正确评价,培养综合实验能力。
[知识要点与规律]
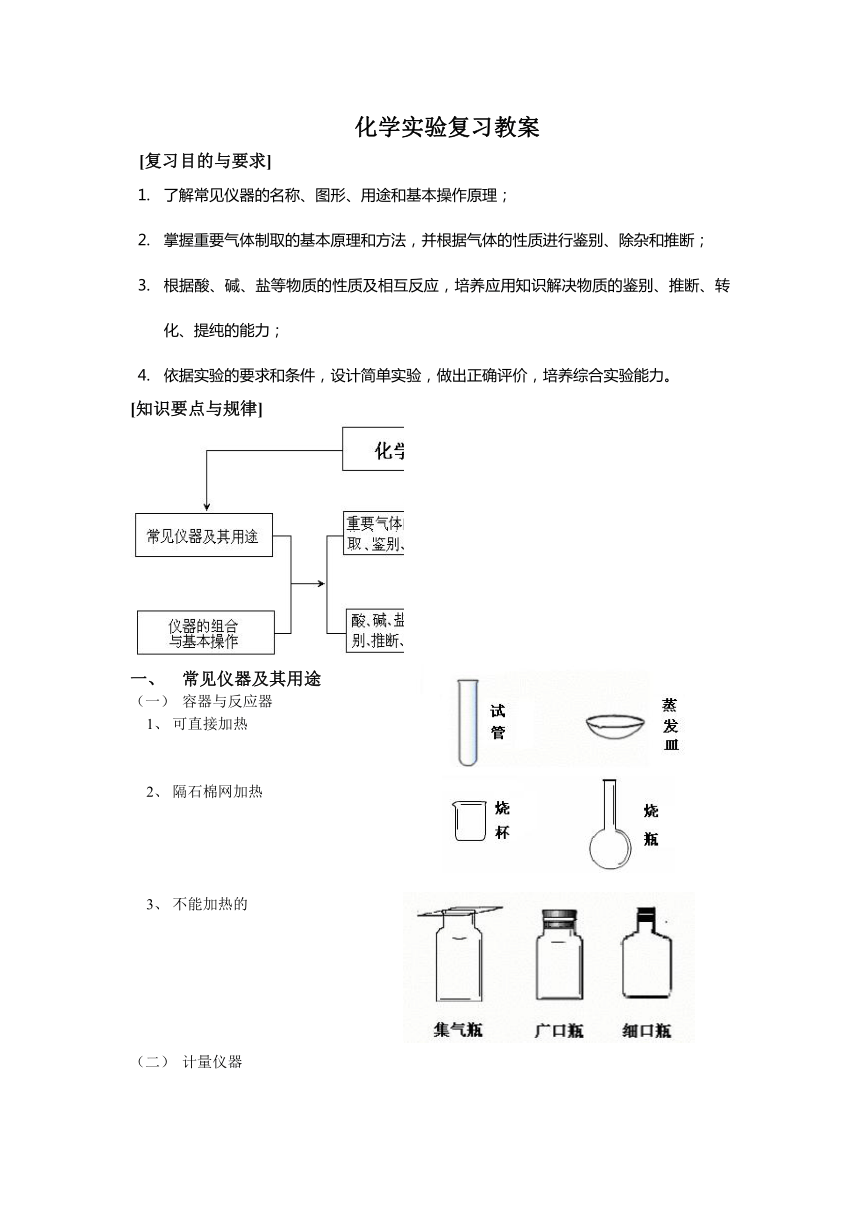
一、 常见仪器及其用途
(1) 容器与反应器
1、 可直接加热
2、 隔石棉网加热
3、 不能加热的
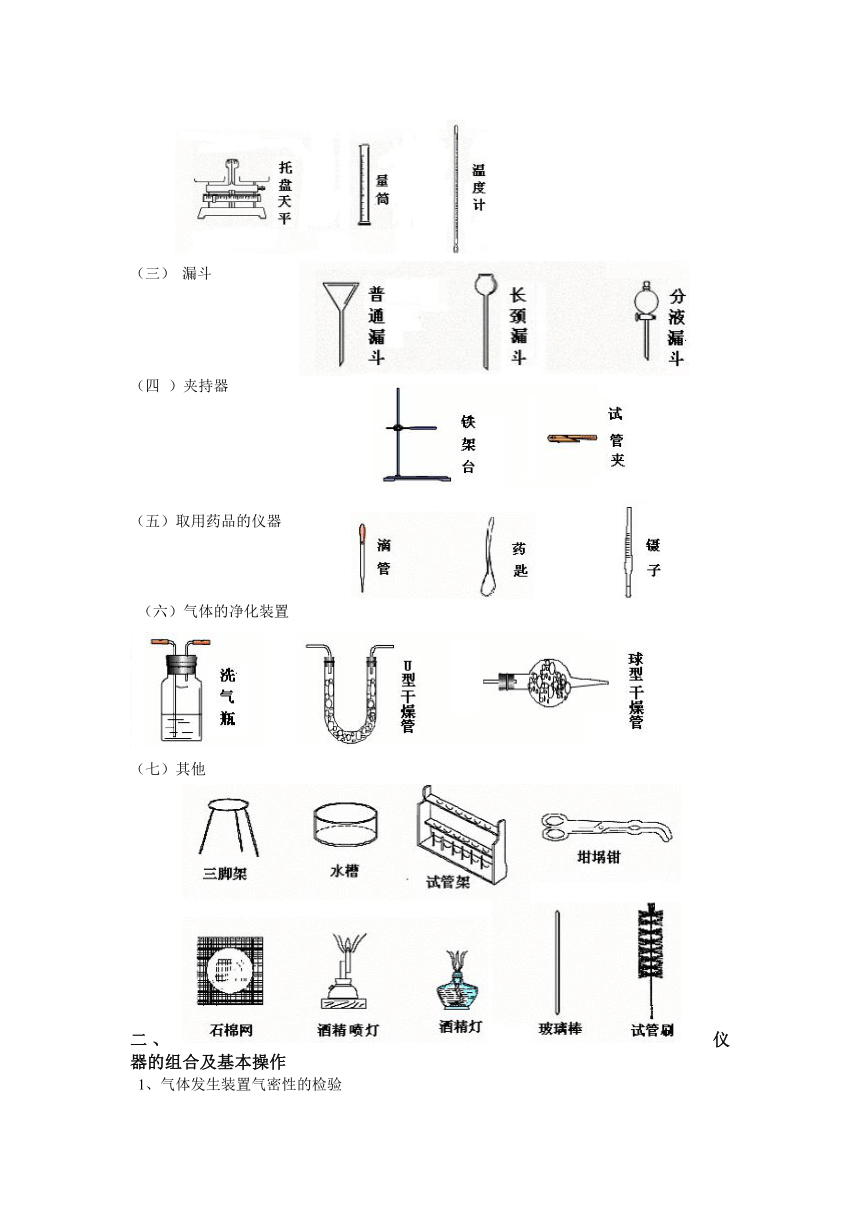
(2) 计量仪器
(3) 漏斗
(四 )夹持器
(五)取用药品的仪器
(六)气体的净化装置
(七)其他
二、仪器的组合及基本操作
1、气体发生装置气密性的检验
2、粗盐的提纯
溶解 过滤 蒸发
3、溶液的配制
*配制一定溶质质量分数溶液的步骤是:①计算;②称量(量取);③配制。配制氯化钠溶液
三、重要气体的性质、制取、鉴别、除杂和推断
(一)*实验室中关于气体实验的设计规律:
1、气体发生装置
气体发生装置的选择原则:根据要制取的气体所需的反应条件(如常温、加热、加催化剂等)、反应物(药品)和生成物的状态等来确定。
2、气体收集装置
收集装置的选择原则是:根据气体在水中的溶解性和密度以及是否能与水或空气反应来确定。
收集装置 选择条件
难溶或不易溶于水且不与水发生反应的气体
比空气的密度大且不与空气发生反应的气体
比空气的密度小且不与空气发生反应的气体
3、气体的除杂与干燥
⑴解答对混合气体进行除杂、干燥实验的相关问题,可参考下列规律:
①考虑干燥与除杂顺序时,若采用溶液除杂,则先除杂后干燥。
②接口的连接:吸收装置(或洗气装置)应“长”进“短”出;
量气装置(排水法)应“短”进“长”出。
③尾气的处理,常采用吸收或点燃两种方法。
⑵除杂方法:
①加热法:气体通过双通玻璃管装置时,杂质与管中药品反应
而除去。
如:除N2中的杂质O2,通过红热的铜网;除CO2中CO,通过加热的CuO。
②洗气法:气体通过洗气瓶,杂质与瓶中试剂反应被吸收。使用时应注意进、出气管位置,应“长进短出”。
如:除CO中的杂质CO2,除H2中的杂质HCl,均用NaOH溶液。除去酸性、中 性气体中的水蒸气可用浓硫酸。
四、酸、碱、盐等物质的鉴别、推断、转化、提纯
*本专题需要掌握的知识有:
⑴常见酸、碱、盐的溶解性;
⑵复分解反应的条件;
⑶金属活动顺序表在金属与酸、金属与盐溶液反应中的应用;
⑷常见物质的检验方法及其现象。
⑸物质除杂的基本方法和原则
⑹掌握一些典型物质的特征,如沉淀、气体、颜色变化等
附表:常见物质的物理特性
①沉淀的颜色
不溶于水也不溶于稀硝酸的白色沉淀:AgCl、BaSO4
不溶于水但能溶于稀硝酸或稀盐酸的沉淀:CaCO3、BaCO3、
Mg(OH)2、Fe(OH)3 Cu(OH)2
红褐色沉淀:Fe(OH)3 蓝色沉淀:Cu(OH)2
②常见固体物质的颜色
白色:NaOH、Ca(OH)2、CaCO3、CuSO4、KClO3、KCl、NaCl、Na2CO3、CaO、MgO、P2O5
红色:红磷(P)、Cu、Cu2O、Fe2O3、
黑色:炭粉(C)、MnO2、Fe3O4、CuO、铁粉(Fe)
绿色:Cu2(OH)2CO3
紫黑色:KMnO4
黄色:硫磺(S)
③溶液的颜色
蓝色:铜盐(Cu2+)溶液,如CuSO4溶液、CuCl2溶液
黄色:铁盐(Fe3+)溶液,如Fe2(SO4)3溶液、FeCl3溶液
浅绿色:亚铁盐(Fe2+)溶液,如FeSO4溶液、FeCl2溶液
紫红色:KMnO4溶液
五、实验设计与评价
*实验设计与评价的原则:
1.实验目的明确;2.实验方法简便,现象明显;3.操作安全可靠;4.推断完整严密。
[复习目的与要求]
1. 了解常见仪器的名称、图形、用途和基本操作原理;
2. 掌握重要气体制取的基本原理和方法,并根据气体的性质进行鉴别、除杂和推断;
3. 根据酸、碱、盐等物质的性质及相互反应,培养应用知识解决物质的鉴别、推断、转化、提纯的能力;
4. 依据实验的要求和条件,设计简单实验,做出正确评价,培养综合实验能力。
[知识要点与规律]
一、 常见仪器及其用途
(1) 容器与反应器
1、 可直接加热
2、 隔石棉网加热
3、 不能加热的
(2) 计量仪器
(3) 漏斗
(四 )夹持器
(五)取用药品的仪器
(六)气体的净化装置
(七)其他
二、仪器的组合及基本操作
1、气体发生装置气密性的检验
2、粗盐的提纯
溶解 过滤 蒸发
3、溶液的配制
*配制一定溶质质量分数溶液的步骤是:①计算;②称量(量取);③配制。配制氯化钠溶液
三、重要气体的性质、制取、鉴别、除杂和推断
(一)*实验室中关于气体实验的设计规律:
1、气体发生装置
气体发生装置的选择原则:根据要制取的气体所需的反应条件(如常温、加热、加催化剂等)、反应物(药品)和生成物的状态等来确定。
2、气体收集装置
收集装置的选择原则是:根据气体在水中的溶解性和密度以及是否能与水或空气反应来确定。
收集装置 选择条件
难溶或不易溶于水且不与水发生反应的气体
比空气的密度大且不与空气发生反应的气体
比空气的密度小且不与空气发生反应的气体
3、气体的除杂与干燥
⑴解答对混合气体进行除杂、干燥实验的相关问题,可参考下列规律:
①考虑干燥与除杂顺序时,若采用溶液除杂,则先除杂后干燥。
②接口的连接:吸收装置(或洗气装置)应“长”进“短”出;
量气装置(排水法)应“短”进“长”出。
③尾气的处理,常采用吸收或点燃两种方法。
⑵除杂方法:
①加热法:气体通过双通玻璃管装置时,杂质与管中药品反应
而除去。
如:除N2中的杂质O2,通过红热的铜网;除CO2中CO,通过加热的CuO。
②洗气法:气体通过洗气瓶,杂质与瓶中试剂反应被吸收。使用时应注意进、出气管位置,应“长进短出”。
如:除CO中的杂质CO2,除H2中的杂质HCl,均用NaOH溶液。除去酸性、中 性气体中的水蒸气可用浓硫酸。
四、酸、碱、盐等物质的鉴别、推断、转化、提纯
*本专题需要掌握的知识有:
⑴常见酸、碱、盐的溶解性;
⑵复分解反应的条件;
⑶金属活动顺序表在金属与酸、金属与盐溶液反应中的应用;
⑷常见物质的检验方法及其现象。
⑸物质除杂的基本方法和原则
⑹掌握一些典型物质的特征,如沉淀、气体、颜色变化等
附表:常见物质的物理特性
①沉淀的颜色
不溶于水也不溶于稀硝酸的白色沉淀:AgCl、BaSO4
不溶于水但能溶于稀硝酸或稀盐酸的沉淀:CaCO3、BaCO3、
Mg(OH)2、Fe(OH)3 Cu(OH)2
红褐色沉淀:Fe(OH)3 蓝色沉淀:Cu(OH)2
②常见固体物质的颜色
白色:NaOH、Ca(OH)2、CaCO3、CuSO4、KClO3、KCl、NaCl、Na2CO3、CaO、MgO、P2O5
红色:红磷(P)、Cu、Cu2O、Fe2O3、
黑色:炭粉(C)、MnO2、Fe3O4、CuO、铁粉(Fe)
绿色:Cu2(OH)2CO3
紫黑色:KMnO4
黄色:硫磺(S)
③溶液的颜色
蓝色:铜盐(Cu2+)溶液,如CuSO4溶液、CuCl2溶液
黄色:铁盐(Fe3+)溶液,如Fe2(SO4)3溶液、FeCl3溶液
浅绿色:亚铁盐(Fe2+)溶液,如FeSO4溶液、FeCl2溶液
紫红色:KMnO4溶液
五、实验设计与评价
*实验设计与评价的原则:
1.实验目的明确;2.实验方法简便,现象明显;3.操作安全可靠;4.推断完整严密。
同课章节目录
