几种重要的盐 第二课时(复分解反应条件)(浙江省杭州市萧山市)
文档属性
| 名称 | 几种重要的盐 第二课时(复分解反应条件)(浙江省杭州市萧山市) |
|
|
| 格式 | rar | ||
| 文件大小 | 338.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2008-09-25 00:00:00 | ||
图片预览







文档简介
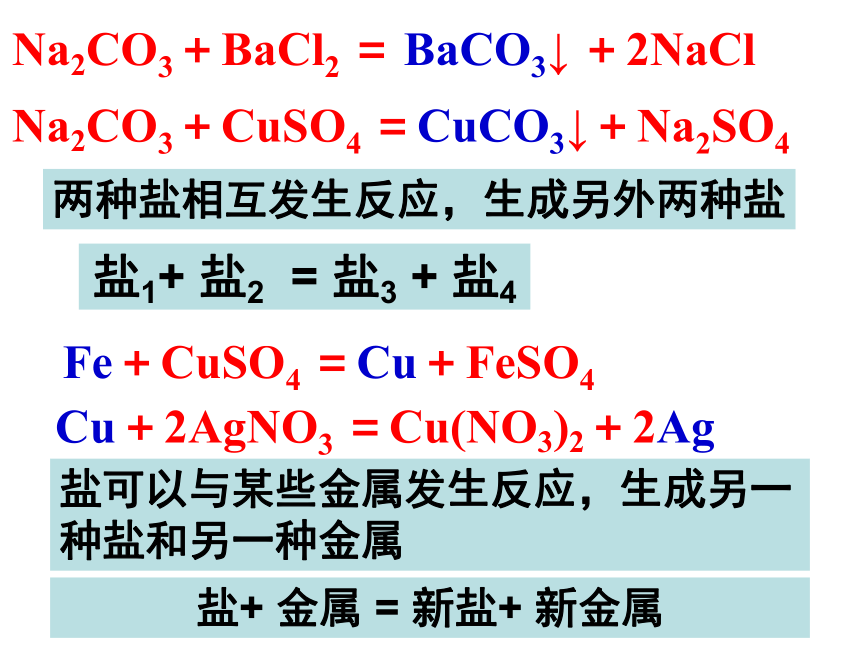
课件26张PPT。 Na2CO3+BaCl2 = BaCO3↓ +2NaCl Na2CO3+CuSO4 =CuCO3↓+Na2SO4 Fe+CuSO4 =Cu+FeSO4 Cu+2AgNO3 =Cu(NO3)2+2Ag两种盐相互发生反应,生成另外两种盐盐可以与某些金属发生反应,生成另一种盐和另一种金属盐1+ 盐2 = 盐3 + 盐4盐+ 金属 = 新盐+ 新金属(1)盐 + 酸 → 新盐 + 新酸
(2)盐 + 碱 → 新盐 + 新碱
(3)盐 + 金属 → 新盐 + 新金属
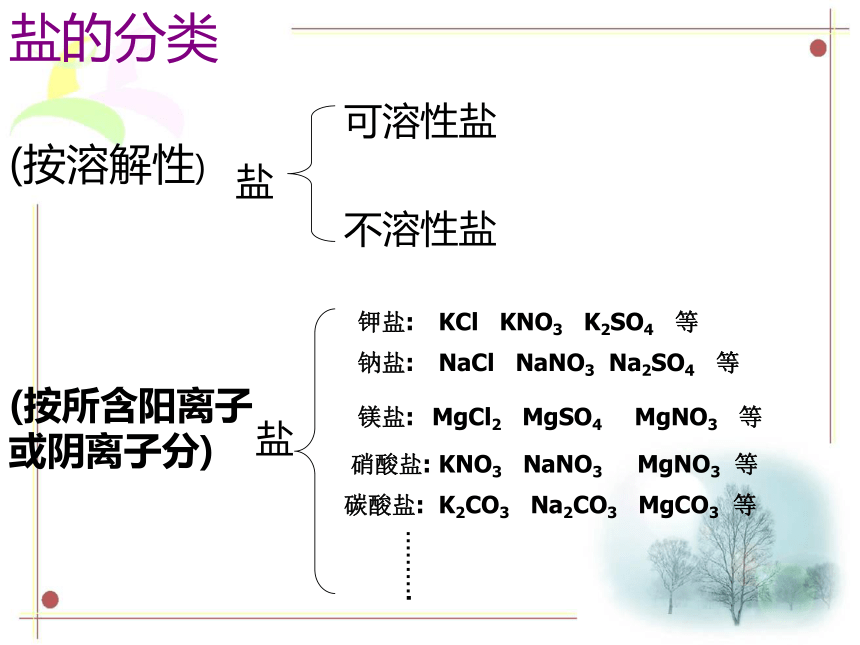
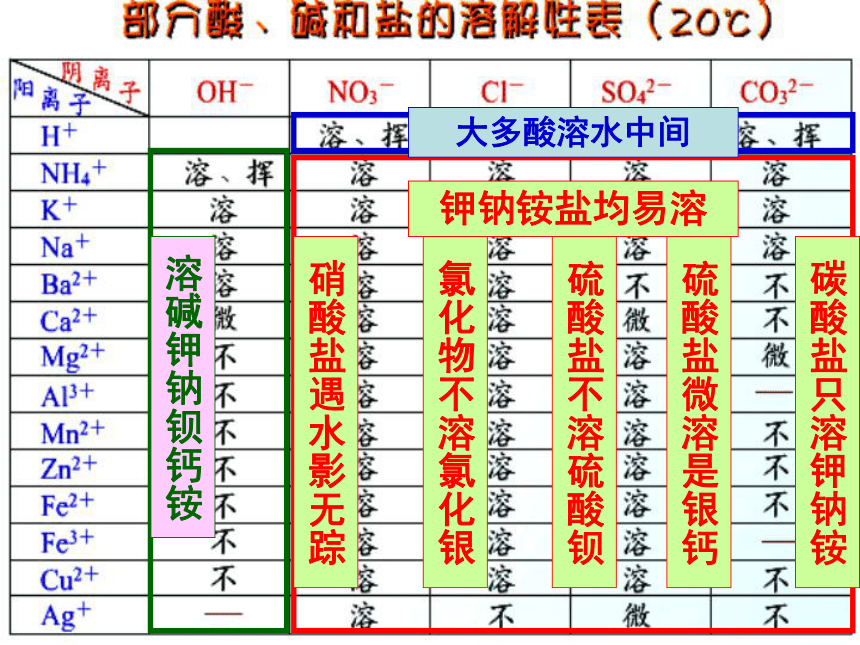
(4)盐 + 盐 → 新盐 + 新盐盐的性质下列各组溶液中,不用其他试剂,只用组内溶液互相混合的方法就能鉴别的一组是 ( )A. Na2SO4、BaCl2、KNO3、NaClB. CuSO4、H2SO4、BaCl2、HClC. NaOH、Na2SO4、FeCl3、BaCl2D. NaCl、AgNO3、NaNO3、HClB 【做一做】现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠。为了确定它们各是哪一种,进行一系列实验,其中观察到如下现象:(1) B跟C两溶液混合,产生白色沉淀;(2) B跟D两溶液混合,产生白色沉淀;(3) B跟E两溶液混合,产生气泡;(4) C溶液能使红色石蕊试纸变蓝。分析上述实验现象,推断出A、B、C、D、E的化学式:A ______ B ________ C ________ D ______ E ____NaClNa2CO3Ca(OH)2CaCl2HClB+C的化学反应方程式: Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH复分解反应的条件第4节 几种重要的盐 (第二课时)盐的分类(按溶解性)盐可溶性盐不溶性盐(按所含阳离子或阴离子分)盐钾盐:KCl KNO3 K2SO4 等钠盐:镁盐:硝酸盐:碳酸盐:……….NaCl NaNO3 Na2SO4 等MgCl2 MgSO4 MgNO3 等KNO3 NaNO3 MgNO3 等K2CO3 Na2CO3 MgCO3 等溶碱钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙判断下列物质是否溶于水?Na2CO3 AgCl BaCO3 MgSO4 BaSO 4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na 3PO4复分解反应两种化合物相互交换成分,
生成另外两种化合物的化学反应置换反应一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应AB + CD = AD + CBA + BC = B + AC四大基本反应类型复分解反应置换反应AB + CD = AD + CBA + BC = B + AC分解反应化合反应A = B + CA + B = C(1)盐 + 金属 → 新盐 + 新金属
(2)盐 + 酸 → 新盐 + 新酸
(3)盐 + 碱 → 新盐 + 新碱
(4)盐 + 盐 → 新盐 + 新盐上述反应中哪些是复分解反应?
哪些是置换反应1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 5、CaO + H2O =Ca(OH)2 2、Zn + H2SO4 = ZnSO4 + H2↑ 7、 CaCO3 高温 CaO + CO2 ↑ 1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 判断下列反应分别属于哪种基本反应类型?复分解反应置换反应分解反应化合反应复分解反应复分解反应复分解反应Fe2O3 +6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2OAgNO3 + NaCl = NaNO3 + AgCl↓ BaCl2 + H2SO4 = 2HCl + BaSO4↓ Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑
NaHCO3 + HCl = NaCl +H2O + CO2↑
CaCO3 + 2HCl = CaCl2 +H2O +CO2↑复分解反应的条件生成物中如果有
↓、↑或有水生成,
复分解反应均可以发生。复分解反应的条件【概念】由于化合物互相交换成分生成新的化合物的反应,叫复分解反应。二. 复分解反应【注意】不是任何的化合物混合在一起都可以发生复分解反应。除了要遵循上述反应规律外,复分解反应发生的条件是:反应物__________;
2. 生成物中有_______________三者之一生成。都溶于水沉淀、气体、水(若反应物中有酸,另一种反应物可以是不溶于水的碱盐金属氧化物)【思考】(1)中和反应是否是复分解反应? 中和反应中化合物_____________符合复分解反应条件,生成物中______是复分解反应。互相交换成分有水 (2) NaCl溶液与KNO3溶液能否发生复分解反应? 答:不符合复分解反应条件,不发生复分解反应。【例2】根据《部分酸、碱、盐的溶解性表》所列部分间或盐在水中的溶解性(20℃)试回答: (1) NaNO3____于水,Mg(OH)2________于水。(填“溶”或“不溶”) (2) 写出Na2CO3溶液CaCl2溶液反应的化学方程式___________________________,该反应类型为_________反应。 (3) 若NaOH+A→B+C,B为蓝色沉淀,写出B和H2SO4溶液反应的化学方程式:___________________________。溶不溶Na2CO3+CaCl2=CaCO3↓+2NaCl复分解Cu(OH)2+H2SO4=CuSO4+2H2O【做一做】下列各组物质的溶液,不能发生复分解反应的是 ( )A 盐酸和氢氧化钙 B 碳酸钠和硫酸C 硝酸银 D 氯化钾和硫酸铜D钠盐钙盐铵盐碳酸【练一练】 2. 两种物质在溶液中互相交换______,如果有______生成或有____生成或有_____放出,那么复分解反应就可以发生。否则不能发生。离子沉淀水气体ACNaCl与HNO3NaCl与H2OAgCl与NaNO3CuSO4和NaOH 下列复分解反应能否发生?能发生的写出化学方程式,不能发生的说明理由√K2SO4和NaOH
Ba(NO3)2和Na2SO4
Na2CO3和HCl
CaCl2和KNO3NaOH和KCl
HCl和K2SO4
NaCl和KNO3√√下列复分解反应能否发生?能发生的写出化学方程式,不能发生的说明理由。
①硫酸溶液与氯化钡
②盐酸与石灰石
③盐酸与硫酸钡
④稀硝酸与氯化银
⑤硫酸溶液与氢氧化钡溶液
⑥硫酸溶液与氢氧化铜
⑦氢氧化钠溶液与硫酸钡
⑧氢氧化钡溶液与硫酸镁溶液
⑨氯化钾溶液与硝酸钠溶液
⑩氯化银与硝酸钡溶液√√√√√在酸性溶液中,离子不能大量存在的是
(A)CO32-
(B)Cl-
(C)Na+
(D)NO3-下列各组物质,在PH=2的溶液中能够共存的是
(A)Na2CO3和KNO3
(B)BaCl2和Na2SO4
(C)NaCl和NaNO3
(D)NaOH和KClAC下列各组离子,在溶液中不能大量共存的是( )
(A) NO3-、Cl-、SO42-、Cu2+
(B)Mg2+、CO32-、K+、OH-
(C)Ba2+、NO32-、K+、OH-
(D)H+、Na+、Cl-、NO3-BDCD有A、B、C、D四种化合物.已知A是硝酸盐,B是酸,C是碱,D是含+3价元素的氯化物.经下列操作,其现象分别是:
①A与B两溶液混合,产生不溶于稀硝酸的白色沉淀;
②B与C两溶液混合,恰好完全反应,其溶液中溶质是食盐;
③C与D两溶液混合,产生红褐色沉淀,其溶液中溶质也是食盐.
(1)用化学式表示各化合物.
A________,B________,C________,D________.
(2)写出有关反应的化学方程式.
①A和B反应_______________________________;
②C和D反应_______________________________.AgNO3HClNaOHFeCl3AgNO3+ HCl=AgCl↓+HNO33NaOH + FeCl3=Fe(OH) 3↓+3NaCl
(2)盐 + 碱 → 新盐 + 新碱
(3)盐 + 金属 → 新盐 + 新金属
(4)盐 + 盐 → 新盐 + 新盐盐的性质下列各组溶液中,不用其他试剂,只用组内溶液互相混合的方法就能鉴别的一组是 ( )A. Na2SO4、BaCl2、KNO3、NaClB. CuSO4、H2SO4、BaCl2、HClC. NaOH、Na2SO4、FeCl3、BaCl2D. NaCl、AgNO3、NaNO3、HClB 【做一做】现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠。为了确定它们各是哪一种,进行一系列实验,其中观察到如下现象:(1) B跟C两溶液混合,产生白色沉淀;(2) B跟D两溶液混合,产生白色沉淀;(3) B跟E两溶液混合,产生气泡;(4) C溶液能使红色石蕊试纸变蓝。分析上述实验现象,推断出A、B、C、D、E的化学式:A ______ B ________ C ________ D ______ E ____NaClNa2CO3Ca(OH)2CaCl2HClB+C的化学反应方程式: Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH复分解反应的条件第4节 几种重要的盐 (第二课时)盐的分类(按溶解性)盐可溶性盐不溶性盐(按所含阳离子或阴离子分)盐钾盐:KCl KNO3 K2SO4 等钠盐:镁盐:硝酸盐:碳酸盐:……….NaCl NaNO3 Na2SO4 等MgCl2 MgSO4 MgNO3 等KNO3 NaNO3 MgNO3 等K2CO3 Na2CO3 MgCO3 等溶碱钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙判断下列物质是否溶于水?Na2CO3 AgCl BaCO3 MgSO4 BaSO 4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na 3PO4复分解反应两种化合物相互交换成分,
生成另外两种化合物的化学反应置换反应一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应AB + CD = AD + CBA + BC = B + AC四大基本反应类型复分解反应置换反应AB + CD = AD + CBA + BC = B + AC分解反应化合反应A = B + CA + B = C(1)盐 + 金属 → 新盐 + 新金属
(2)盐 + 酸 → 新盐 + 新酸
(3)盐 + 碱 → 新盐 + 新碱
(4)盐 + 盐 → 新盐 + 新盐上述反应中哪些是复分解反应?
哪些是置换反应1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 5、CaO + H2O =Ca(OH)2 2、Zn + H2SO4 = ZnSO4 + H2↑ 7、 CaCO3 高温 CaO + CO2 ↑ 1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 判断下列反应分别属于哪种基本反应类型?复分解反应置换反应分解反应化合反应复分解反应复分解反应复分解反应Fe2O3 +6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2OAgNO3 + NaCl = NaNO3 + AgCl↓ BaCl2 + H2SO4 = 2HCl + BaSO4↓ Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑
NaHCO3 + HCl = NaCl +H2O + CO2↑
CaCO3 + 2HCl = CaCl2 +H2O +CO2↑复分解反应的条件生成物中如果有
↓、↑或有水生成,
复分解反应均可以发生。复分解反应的条件【概念】由于化合物互相交换成分生成新的化合物的反应,叫复分解反应。二. 复分解反应【注意】不是任何的化合物混合在一起都可以发生复分解反应。除了要遵循上述反应规律外,复分解反应发生的条件是:反应物__________;
2. 生成物中有_______________三者之一生成。都溶于水沉淀、气体、水(若反应物中有酸,另一种反应物可以是不溶于水的碱盐金属氧化物)【思考】(1)中和反应是否是复分解反应? 中和反应中化合物_____________符合复分解反应条件,生成物中______是复分解反应。互相交换成分有水 (2) NaCl溶液与KNO3溶液能否发生复分解反应? 答:不符合复分解反应条件,不发生复分解反应。【例2】根据《部分酸、碱、盐的溶解性表》所列部分间或盐在水中的溶解性(20℃)试回答: (1) NaNO3____于水,Mg(OH)2________于水。(填“溶”或“不溶”) (2) 写出Na2CO3溶液CaCl2溶液反应的化学方程式___________________________,该反应类型为_________反应。 (3) 若NaOH+A→B+C,B为蓝色沉淀,写出B和H2SO4溶液反应的化学方程式:___________________________。溶不溶Na2CO3+CaCl2=CaCO3↓+2NaCl复分解Cu(OH)2+H2SO4=CuSO4+2H2O【做一做】下列各组物质的溶液,不能发生复分解反应的是 ( )A 盐酸和氢氧化钙 B 碳酸钠和硫酸C 硝酸银 D 氯化钾和硫酸铜D钠盐钙盐铵盐碳酸【练一练】 2. 两种物质在溶液中互相交换______,如果有______生成或有____生成或有_____放出,那么复分解反应就可以发生。否则不能发生。离子沉淀水气体ACNaCl与HNO3NaCl与H2OAgCl与NaNO3CuSO4和NaOH 下列复分解反应能否发生?能发生的写出化学方程式,不能发生的说明理由√K2SO4和NaOH
Ba(NO3)2和Na2SO4
Na2CO3和HCl
CaCl2和KNO3NaOH和KCl
HCl和K2SO4
NaCl和KNO3√√下列复分解反应能否发生?能发生的写出化学方程式,不能发生的说明理由。
①硫酸溶液与氯化钡
②盐酸与石灰石
③盐酸与硫酸钡
④稀硝酸与氯化银
⑤硫酸溶液与氢氧化钡溶液
⑥硫酸溶液与氢氧化铜
⑦氢氧化钠溶液与硫酸钡
⑧氢氧化钡溶液与硫酸镁溶液
⑨氯化钾溶液与硝酸钠溶液
⑩氯化银与硝酸钡溶液√√√√√在酸性溶液中,离子不能大量存在的是
(A)CO32-
(B)Cl-
(C)Na+
(D)NO3-下列各组物质,在PH=2的溶液中能够共存的是
(A)Na2CO3和KNO3
(B)BaCl2和Na2SO4
(C)NaCl和NaNO3
(D)NaOH和KClAC下列各组离子,在溶液中不能大量共存的是( )
(A) NO3-、Cl-、SO42-、Cu2+
(B)Mg2+、CO32-、K+、OH-
(C)Ba2+、NO32-、K+、OH-
(D)H+、Na+、Cl-、NO3-BDCD有A、B、C、D四种化合物.已知A是硝酸盐,B是酸,C是碱,D是含+3价元素的氯化物.经下列操作,其现象分别是:
①A与B两溶液混合,产生不溶于稀硝酸的白色沉淀;
②B与C两溶液混合,恰好完全反应,其溶液中溶质是食盐;
③C与D两溶液混合,产生红褐色沉淀,其溶液中溶质也是食盐.
(1)用化学式表示各化合物.
A________,B________,C________,D________.
(2)写出有关反应的化学方程式.
①A和B反应_______________________________;
②C和D反应_______________________________.AgNO3HClNaOHFeCl3AgNO3+ HCl=AgCl↓+HNO33NaOH + FeCl3=Fe(OH) 3↓+3NaCl
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
