2018年高考化学备考中等生百日捷进提升专题14化学反应和化学方程式(1)
文档属性
| 名称 | 2018年高考化学备考中等生百日捷进提升专题14化学反应和化学方程式(1) |  | |
| 格式 | zip | ||
| 文件大小 | 388.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-14 22:18:18 | ||
图片预览

文档简介
一、常见无机化学反应
(1)Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3→NaCl→Na
Na→NaOH→Na2CO3(+CaCl2)→CaCO3→CaO→Ca(OH)2→NaOH
(2)Mg→MgO→MgCl2→Mg(OH)2→MgSO4→MgCl2→Mg
(3)Al→Al2O3→AlCl3→Al(OH)3→Al2(SO4)3→Al(OH)3→Al2O3→Al→NaAlO2→Al(OH)3→Al2O3→NaAlO2
(4)Fe→ Fe2O3→FeCl3→Fe(NO3)3→Fe(OH)3→Fe2(SO4)3→ FeSO4→Fe(OH)2→Fe(OH)3→FeCl3→ Fe(SCN)3
(5)Cu → CuO→CuSO4→ Cu(OH)2 → CuO → Cu→ CuCl2 → [Cu(NH3)4]SO4
(6)C→ CO→ CO2 → CaCO3 → Ca(HCO3)2 → CO2→CO
(7)Si→ SiO2→Na2SiO3→ H2SiO3 → SiO2→ Si(粗硅)→ SiCl4→ Si (纯硅)→ SiO2→ SiF4
(8)NH3→ N2 → NO→ NO2 → HNO3 → NO2 → N2O4
NH3→NH4Cl→NH3→NH3·H2O→(NH4)2SO4→NH3→NO→HNO3→Cu(NO3)2→NO2→HNO3 →
(9)H2S→S→SO2→SO3→H2SO4→SO2→H2SO4→BaSO4
(10)Cl2→HCl→Cl2→NaClO→Cl2→Ca(ClO)2→HClO→O2
(11)金属+Cl2、卤素间的置换、H2S+Cl2
二、有机物的转化关系
(1)CH3CH3→CH3CH2Cl→CH2==CH2→CH3CH2OH→CH2==CH2→CH3CH2Br→CH3CH2OH→CH3CHO →CH3COOH→CH3COOCH2CH3→CH3CH2OH→CH2==CH2→—CH2-CH2—
(2)
(3)
(4)淀粉→葡萄糖→酒精→CO2→葡萄糖→淀粉
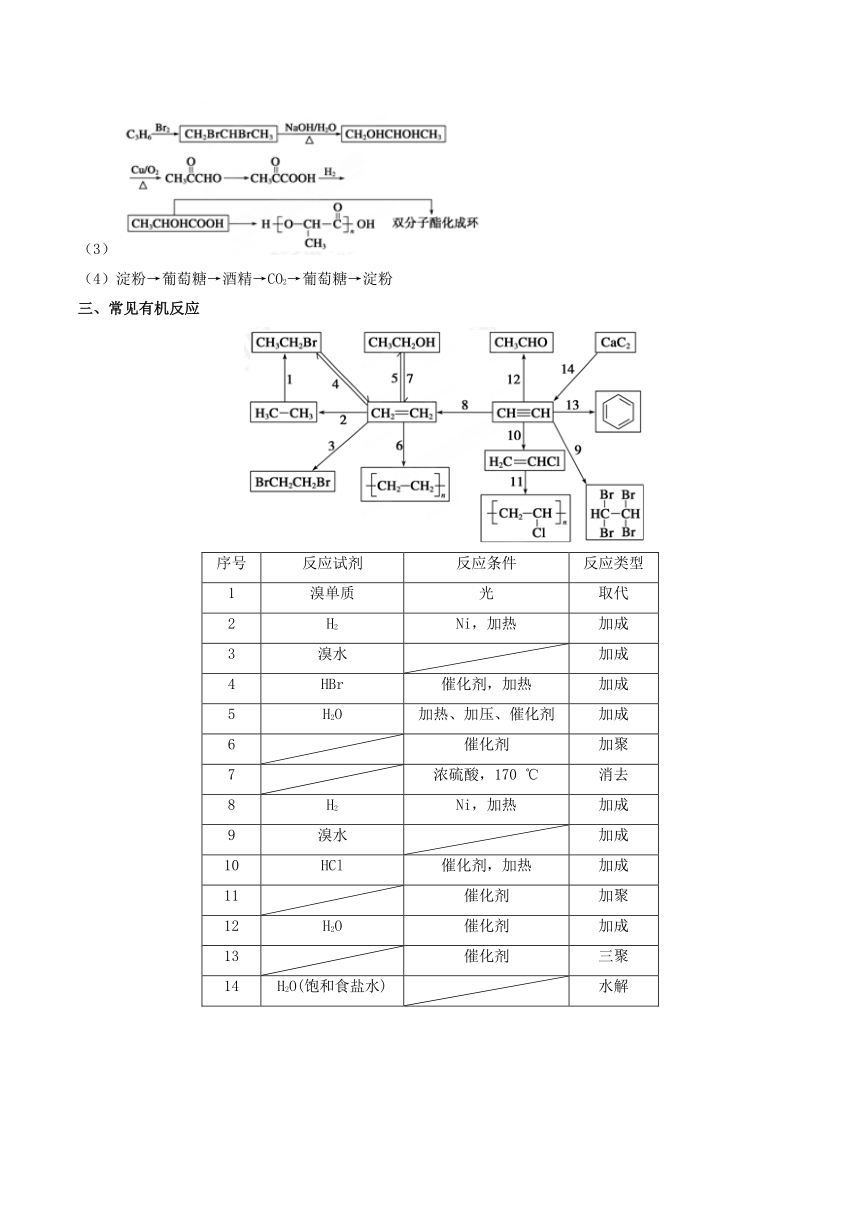
三、常见有机反应
序号
反应试剂
反应条件
反应类型
1
溴单质
光
取代
2
H2
Ni,加热
加成
3
溴水
加成
4
HBr
催化剂,加热
加成
5
H2O
加热、加压、催化剂
加成
6
催化剂
加聚
7
浓硫酸,170 ℃
消去
8
H2
Ni,加热
加成
9
溴水
加成
10
HCl
催化剂,加热
加成
11
催化剂
加聚
12
H2O
催化剂
加成
13
催化剂
三聚
14
H2O(饱和食盐水)
水解
序号
反应试剂
反应条件
反应类型
1
NaOH/H2O
加热
水解(取代)
2
NaOH/醇
加热
消去
3
Na
置换(取代)
4
HBr
加热
取代
5
浓硫酸,170 ℃
消去
6
浓硫酸,140 ℃
取代
7
O2
Cu或Ag,加热
氧化
8
H2
Ni,加热
加成(还原)
9
O2、溴水或KMnO4/H+
催化剂,加热
氧化
10
乙醇或乙酸
浓硫酸,加热
酯化(取代)
11
H2O/H+
水浴加热
水解
序号
反应试剂
反应条件
反应类型
1
H2
Ni/加热
加成(还原)
2
浓硝酸
浓硫酸/55~60℃
取代(硝化)
3
液溴
Fe(FeCl3)
取代(卤代)
4
NaOH/H2O
催化剂/加热
取代(水解)
5
NaOH
中和(取代)
6
CO2+H2O
复分解
7
溴水
取代
8
FeCl3
溴水
9
KMnO4/H+
氧化
10
浓硝酸
浓硫酸/加热
取代
11
CH3COOH
取代
12
H2O
H+或OH-
水解
几种有机物性质比较如下表:
试剂
Na
NaOH
Na2CO3
NaHCO3
Br2水(Br2)
KMnO4/H+
烷烃
×(√)
×
烯烃
√
√
炔烃
√
√
×(√)
×
×(√)
√
R—Cl
×
√
×
×
×
×
R—OH
√
×
×
×
√
√
√
√
×
√
√
R—CHO
×
×
×
×
√
√
R—COOH
√
√
√
√
×
×
RCOOR’
×
√
×
×
×
×
注:×表示不能反应,√表示能发生反应
同课章节目录
