中学化学常见气体的实验室制法(浙江省杭州市)
文档属性
| 名称 | 中学化学常见气体的实验室制法(浙江省杭州市) |  | |
| 格式 | rar | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2009-03-25 12:29:00 | ||
图片预览




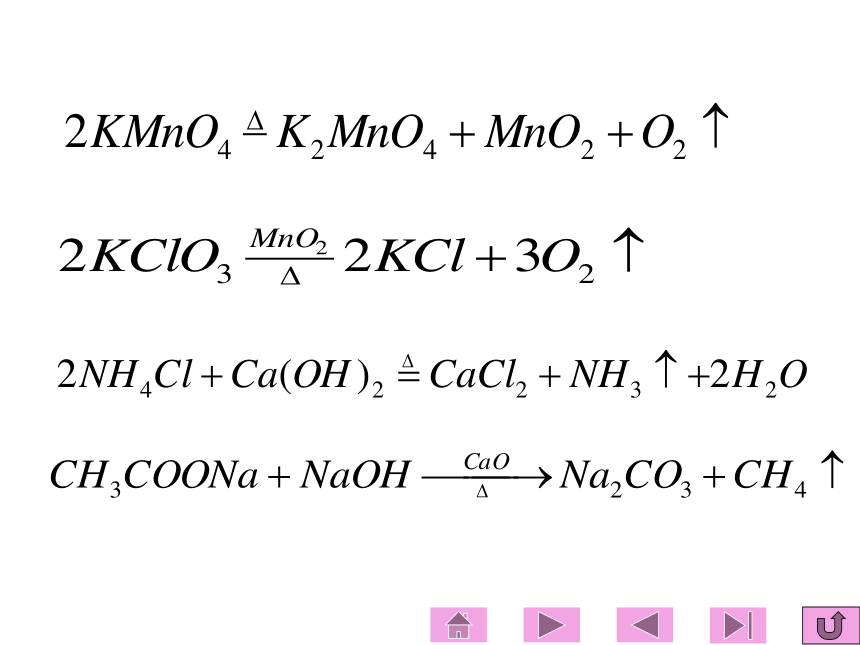



文档简介
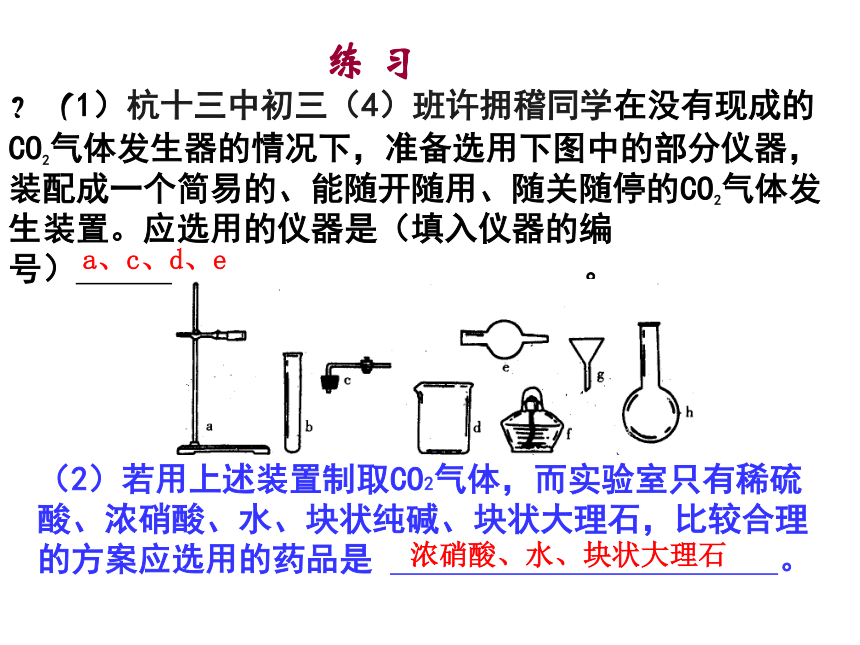
课件39张PPT。他是谁?他打算做啥?练 习?(1)杭十三中初三(4)班许拥稽同学在没有现成的CO2气体发生器的情况下,准备选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。应选用的仪器是(填入仪器的编号) 。(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案应选用的药品是 。a、c、d、e浓硝酸、水、块状大理石化学专题--
实验设计与评价(1)讲师 曹老师中学化学中常见气体的实验室制法想一想 气体制取的发生装置有几种类型?如何选择气体的发生装置? 根据反应物质的状态和反应条件2 气体发生装置的基本类型A、固体反应物(加热)B、固液反应物(不加热)一 气体发生装置
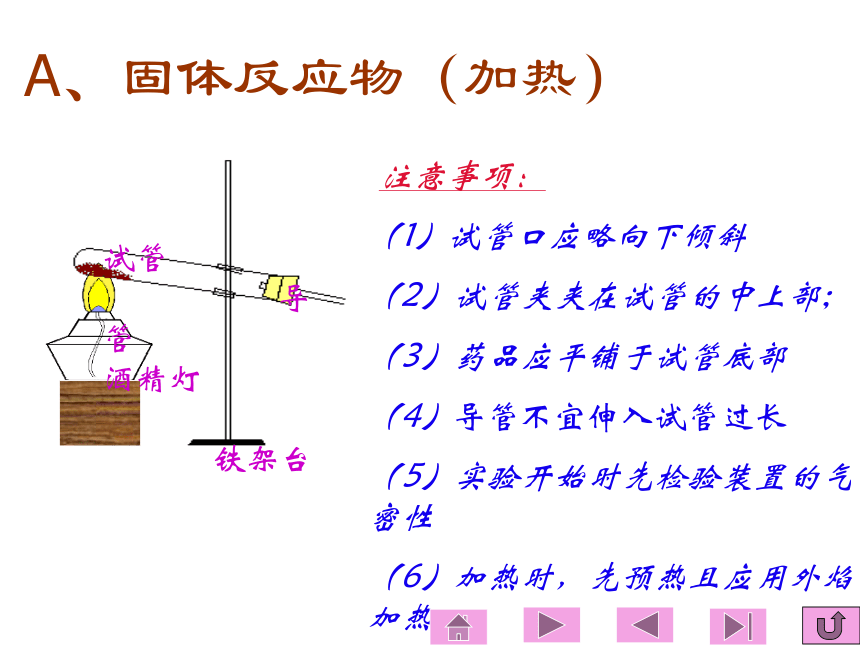
1 气体发生装置的设计原则: 可用于制备O2、NH3和CH4A、固体反应物(加热) 注意事项:
(1)试管口应略向下倾斜
(2)试管夹夹在试管的中上部;
(3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的气密性
(6)加热时,先预热且应用外焰加热试管
导管
酒精灯
铁架台可用于制备H2、O2、H2S、NO2和C2H2。简易
装置简单
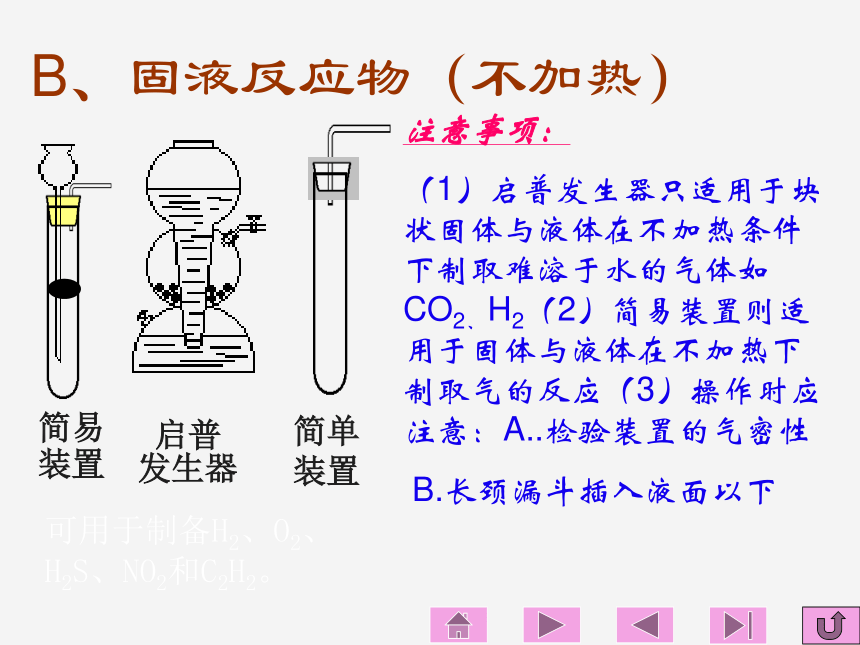
装置B、固液反应物(不加热)注意事项:
(1)启普发生器只适用于块状固体与液体在不加热条件下制取难溶于水的气体如CO2、H2(2)简易装置则适用于固体与液体在不加热下制取气的反应(3)操作时应注意:A..检验装置的气密性
B.长颈漏斗插入液面以下启普
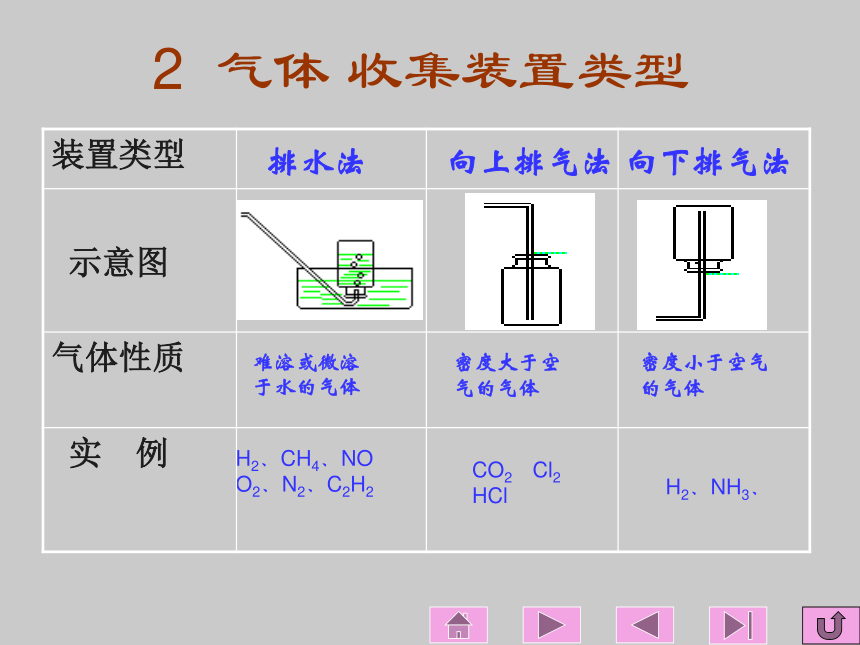
发生器思考题 气体的收集装置和净化装置分别有几种类型?根据什么原则选择有关装置?二 气体收集装置
1 气体收集装置的设计原则:
根据气体的溶解性或密度2 气体 收集装置类型 排水法 H2、CH4、NO
O2、N2、C2H2向上排气法向下排气法难溶或微溶
于水的气体密度大于空 气的气体密度小于空气的气体 H2、NH3、 CO2 Cl2
HCl三 气体净化装置
1 气体净化装置的设计原则:
根据净化药品的状态和净化条件 洗气瓶
进气管应“长进短出” 干燥管
应大口方向进气,
小口出气 。 2 气体净化装置类型 液体试剂固体试剂固体试剂需加热干燥剂选择干燥剂状态选择干燥装置酸性干燥剂(如:浓硫酸、P2O5、硅胶等)不能用来干燥碱性气体; 碱性干燥剂 (如碱石灰、生石灰、固体NaOH等)不能用来干燥酸性气体如C02。有氧化性的干燥剂(如浓硫酸)不能干燥有还原性气体(如H2S、HI等)。 ①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。1、选择原则3、常见干燥剂2、选择方法 → →浓硫酸无水CaCl2碱石灰H2,O2,SO2,CO,O2,HCl,SO2, H2, CO,,CH4H2,O2,
CH4,NH3NH3,NH3SO2,CO2,?????????1、???燃烧法
如CH4、H2、CO等。?????????2、碱液反应法
如Cl2、H2S、CO2、SO2、等。????????????3、水溶解法
如HCl、NH3等。四、除尾气装置 思考题 分析下面装置有哪些作用?A、净化气体B、向上排气法收集气体C、向下排气法收集气体D、排水集气法收集气体发 生
装 置净 化
装 置干 燥
装 置收 集
装 置吸 收
装 置气体装置的设计 1、装置连接顺序 气体装置的设计 装药品防倒吸
防氧化措施仪器拆卸等。查气密性 2、操作顺序一般包括:仪器连接 3、气体的净化原则:一、要分析杂质气体的性质 二、要分析被净化气的性质; 4、实验操作的先与后 A、装配仪器时:先下后上;先左后右 B、加入试剂时:先固后液C、实验开始时:先查仪器的气密性,
再加药品,后点酒精灯; D、有些实验为防倒吸,往往最后停止加热或最后停止通气 ;E、有些实验为防氧化往往最后停止通气。 F、仪器拆卸的一般过程:从右到左,自上而下,先拆主体,
后拆部件。 气体装置的设计 G、净化气体时,一般先除去有毒、有刺激性气味的气体, 后除去无毒、无气味的气体, 最后除水蒸气。? 科学性 安全性 可行性 简约性 设计化学实验时,应遵循四个基本要求: ? 即实验原理、操作程序和方法必须正确? 即用药及操作要注意安全,注意环境保护等问题要满足中学现有的实验条件装置简单、步骤少、药品用量少、时间短等气体装置的设计 1.陶杨同学设计用氢气燃烧法测定空气中氧气体积分数的实验。实验装置如右:
⑴ 丙装置中C仪器的名称是_________。
⑵ 关闭止水夹B(止水夹起开关的作用),打开止水夹A,
将氢气验纯后,点燃氢气并插入乙装置的容器内,直至火
焰刚好熄灭时关闭止水夹A。冷却至室温后,下一步操作
是_________________,观察到的乙装置中发生的实验现象
是___________。
⑶ 实验后,李宇豪同学提出:为了使测定的结果更准
确,应在甲、乙装置之间增加丁装置(如右图表示)。你
的意见如何?为什么?2.在实验室里,甲、乙两同学欲测定碳酸钙样品中碳酸钙的质量分数(杂质不与酸反应,且加热不分解),分别设计了甲、乙两个实验方案,请回答方案中的问题。
甲方案:①称取一定质量的碳酸钙样品;②用酒精灯加热样品,直至质量不再改变;③在干燥的器皿中将固体残留物冷却后称量;④计算。
问题⑴:甲为什么要加热样品,直至质量不再改变?______________________。
问题⑵:甲为什么要将固体残留物放在干燥的器皿中冷却?_________________。
乙方案:①称取碳酸钙样品12.5g;②加入质量分数为10%的盐酸109.5g,使碳酸钙完全反应;③向反应后的溶液中,加入质量分数为8%的氢氧化钠溶液50g,恰好中和过量盐酸;④计算。
问题⑶:称取样品时,所需的仪器_________________。
问题⑷:写出碳酸钙与盐酸反应的化学方程式:___________________________。
问题⑸:乙方案中,样品中碳酸钙的质量分数是_________。
综上所述,你认为甲、乙两方案中,切实可行的方案是________。不采用另一个方案的原因是:__________________________________________。3.根据下列所给出的药品、实验装置和实验中可测得的数据,设计实验来粗略测定由铜和锌两种金属组成的合金a g中锌的质量分数(合金已加工成粉末)。 药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜。 在实验中可测得的数据: 充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g。请你设计三个方案填入下表中: ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 789123456无水硫酸铜练 习1、实验室可用氯气与金属反应制备无水三氯化铁,该化合物呈棕红色、易潮解100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:4HCl+MnO2=MnCl2+2H2O+Cl2↑ 1)B中反应的化学方程式为 B中反应一段时间后,看到黄绿色气体充满装置,才开始加热D 2)D中的反应开始前,需排除装置中的空气,应采取的方法是3)D中反应的化学方程式为:2Fe+3Cl2=2FeCl3 4)装置(Ⅰ)的主要缺点是导管易被产品堵塞;尾气排入空气,易造成环境污染 5)装置(Ⅱ)的主要缺点是:6)如果选用Ⅱ装置来完成实验,则必须采取的改进措施是产品易潮解 在瓶E和F之间连接装有干燥剂的装置 练 习 1、实验室用甲酸与浓硫酸在加热条件下制取CO气体反应为:HCOOH H2O+CO↑,请设计一装置以制取干燥纯净的CO气体。H2SO4
△
2、某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数(即质量百分含量),其实验步骤如下:粗氧化铜W1g ①加过量盐酸过滤?溶液Ⅰ沉淀Ⅰ W2g沉淀ⅡW3 g②加入X ?溶液Ⅱ ③加入Y
过滤 ?溶液Ⅲ ⑤ ④ 氯化铜晶体
CuCl2·2H2O无水氯化铜
W4 g 实验过程中所用的物质X、Y及pH值控制可参照下列附表确定。 回答下列问题:
1、??沉淀Ⅱ的成分是(写化学式) 。
2、??物质X可选用表二中的 ,物质Y可选用表二中的 。
(填序号,且全部选出)
3、过滤Ⅱ操作中所用仪器有铁架台(带铁圈)、烧杯、滤纸等,还需使用的
仪器是(填仪器名称) 。
Fe(OH)3 H、E A、D 漏斗、玻棒 练 习3、某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数(即质量百分含量),其实验步骤如下:粗氧化铜W1g ①加过量盐酸过滤?溶液Ⅰ沉淀Ⅰ W2g沉淀ⅡW3 g②加入X ?溶液Ⅱ ③加入Y
过滤 ?溶液Ⅲ ⑤ ④ 氯化铜晶体
CuCl2·2H2O无水氯化铜
W4 g ④ 、⑤步操作中,所需装置如图所示: ①??按气流的方向从左到右的顺序,各装置的连接顺序(填接口字母)为
接 、 接 、 接 。
②? D中所发生反应的化学方程式为: 。
③? C的作用是 ,
浓H2SO4 碱石灰
A B C Da、防空气中的水蒸气进入B,而得不到纯的无水CuCl2
b、吸收HCl气体及分解产生的水蒸气。 g3、某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数(即质量百分含量),其实验步骤如下:粗氧化铜W1g ①加过量盐酸过滤?溶液Ⅰ沉淀Ⅰ W2g沉淀ⅡW3 g②加入X ?溶液Ⅱ ③加入Y
过滤 ?溶液Ⅲ ⑤ ④ 氯化铜晶体
CuCl2·2H2O无水氯化铜
W4 g ④若第④步中有80%的氯化铜转入晶体,其余各步骤转化都是完全的,则样品中
氧化铜的质量分数(质量百分含量)的计算式为: 。解题方法与思路明确试验目的原理———明确试验的目的要求
选择仪器药品———选择合理的化学仪器和药品
设计装置步骤———设计出合理的实验装置和实验操作步骤
记录现象、数据
分析得出结论———根据实验观察的现象和得出的数据,通过分析、计算、图表、推理等处理,得出正确的结论
谢谢
实验设计与评价(1)讲师 曹老师中学化学中常见气体的实验室制法想一想 气体制取的发生装置有几种类型?如何选择气体的发生装置? 根据反应物质的状态和反应条件2 气体发生装置的基本类型A、固体反应物(加热)B、固液反应物(不加热)一 气体发生装置
1 气体发生装置的设计原则: 可用于制备O2、NH3和CH4A、固体反应物(加热) 注意事项:
(1)试管口应略向下倾斜
(2)试管夹夹在试管的中上部;
(3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的气密性
(6)加热时,先预热且应用外焰加热试管
导管
酒精灯
铁架台可用于制备H2、O2、H2S、NO2和C2H2。简易
装置简单
装置B、固液反应物(不加热)注意事项:
(1)启普发生器只适用于块状固体与液体在不加热条件下制取难溶于水的气体如CO2、H2(2)简易装置则适用于固体与液体在不加热下制取气的反应(3)操作时应注意:A..检验装置的气密性
B.长颈漏斗插入液面以下启普
发生器思考题 气体的收集装置和净化装置分别有几种类型?根据什么原则选择有关装置?二 气体收集装置
1 气体收集装置的设计原则:
根据气体的溶解性或密度2 气体 收集装置类型 排水法 H2、CH4、NO
O2、N2、C2H2向上排气法向下排气法难溶或微溶
于水的气体密度大于空 气的气体密度小于空气的气体 H2、NH3、 CO2 Cl2
HCl三 气体净化装置
1 气体净化装置的设计原则:
根据净化药品的状态和净化条件 洗气瓶
进气管应“长进短出” 干燥管
应大口方向进气,
小口出气 。 2 气体净化装置类型 液体试剂固体试剂固体试剂需加热干燥剂选择干燥剂状态选择干燥装置酸性干燥剂(如:浓硫酸、P2O5、硅胶等)不能用来干燥碱性气体; 碱性干燥剂 (如碱石灰、生石灰、固体NaOH等)不能用来干燥酸性气体如C02。有氧化性的干燥剂(如浓硫酸)不能干燥有还原性气体(如H2S、HI等)。 ①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。1、选择原则3、常见干燥剂2、选择方法 → →浓硫酸无水CaCl2碱石灰H2,O2,SO2,CO,O2,HCl,SO2, H2, CO,,CH4H2,O2,
CH4,NH3NH3,NH3SO2,CO2,?????????1、???燃烧法
如CH4、H2、CO等。?????????2、碱液反应法
如Cl2、H2S、CO2、SO2、等。????????????3、水溶解法
如HCl、NH3等。四、除尾气装置 思考题 分析下面装置有哪些作用?A、净化气体B、向上排气法收集气体C、向下排气法收集气体D、排水集气法收集气体发 生
装 置净 化
装 置干 燥
装 置收 集
装 置吸 收
装 置气体装置的设计 1、装置连接顺序 气体装置的设计 装药品防倒吸
防氧化措施仪器拆卸等。查气密性 2、操作顺序一般包括:仪器连接 3、气体的净化原则:一、要分析杂质气体的性质 二、要分析被净化气的性质; 4、实验操作的先与后 A、装配仪器时:先下后上;先左后右 B、加入试剂时:先固后液C、实验开始时:先查仪器的气密性,
再加药品,后点酒精灯; D、有些实验为防倒吸,往往最后停止加热或最后停止通气 ;E、有些实验为防氧化往往最后停止通气。 F、仪器拆卸的一般过程:从右到左,自上而下,先拆主体,
后拆部件。 气体装置的设计 G、净化气体时,一般先除去有毒、有刺激性气味的气体, 后除去无毒、无气味的气体, 最后除水蒸气。? 科学性 安全性 可行性 简约性 设计化学实验时,应遵循四个基本要求: ? 即实验原理、操作程序和方法必须正确? 即用药及操作要注意安全,注意环境保护等问题要满足中学现有的实验条件装置简单、步骤少、药品用量少、时间短等气体装置的设计 1.陶杨同学设计用氢气燃烧法测定空气中氧气体积分数的实验。实验装置如右:
⑴ 丙装置中C仪器的名称是_________。
⑵ 关闭止水夹B(止水夹起开关的作用),打开止水夹A,
将氢气验纯后,点燃氢气并插入乙装置的容器内,直至火
焰刚好熄灭时关闭止水夹A。冷却至室温后,下一步操作
是_________________,观察到的乙装置中发生的实验现象
是___________。
⑶ 实验后,李宇豪同学提出:为了使测定的结果更准
确,应在甲、乙装置之间增加丁装置(如右图表示)。你
的意见如何?为什么?2.在实验室里,甲、乙两同学欲测定碳酸钙样品中碳酸钙的质量分数(杂质不与酸反应,且加热不分解),分别设计了甲、乙两个实验方案,请回答方案中的问题。
甲方案:①称取一定质量的碳酸钙样品;②用酒精灯加热样品,直至质量不再改变;③在干燥的器皿中将固体残留物冷却后称量;④计算。
问题⑴:甲为什么要加热样品,直至质量不再改变?______________________。
问题⑵:甲为什么要将固体残留物放在干燥的器皿中冷却?_________________。
乙方案:①称取碳酸钙样品12.5g;②加入质量分数为10%的盐酸109.5g,使碳酸钙完全反应;③向反应后的溶液中,加入质量分数为8%的氢氧化钠溶液50g,恰好中和过量盐酸;④计算。
问题⑶:称取样品时,所需的仪器_________________。
问题⑷:写出碳酸钙与盐酸反应的化学方程式:___________________________。
问题⑸:乙方案中,样品中碳酸钙的质量分数是_________。
综上所述,你认为甲、乙两方案中,切实可行的方案是________。不采用另一个方案的原因是:__________________________________________。3.根据下列所给出的药品、实验装置和实验中可测得的数据,设计实验来粗略测定由铜和锌两种金属组成的合金a g中锌的质量分数(合金已加工成粉末)。 药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜。 在实验中可测得的数据: 充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g。请你设计三个方案填入下表中: ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 789123456无水硫酸铜练 习1、实验室可用氯气与金属反应制备无水三氯化铁,该化合物呈棕红色、易潮解100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:4HCl+MnO2=MnCl2+2H2O+Cl2↑ 1)B中反应的化学方程式为 B中反应一段时间后,看到黄绿色气体充满装置,才开始加热D 2)D中的反应开始前,需排除装置中的空气,应采取的方法是3)D中反应的化学方程式为:2Fe+3Cl2=2FeCl3 4)装置(Ⅰ)的主要缺点是导管易被产品堵塞;尾气排入空气,易造成环境污染 5)装置(Ⅱ)的主要缺点是:6)如果选用Ⅱ装置来完成实验,则必须采取的改进措施是产品易潮解 在瓶E和F之间连接装有干燥剂的装置 练 习 1、实验室用甲酸与浓硫酸在加热条件下制取CO气体反应为:HCOOH H2O+CO↑,请设计一装置以制取干燥纯净的CO气体。H2SO4
△
2、某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数(即质量百分含量),其实验步骤如下:粗氧化铜W1g ①加过量盐酸过滤?溶液Ⅰ沉淀Ⅰ W2g沉淀ⅡW3 g②加入X ?溶液Ⅱ ③加入Y
过滤 ?溶液Ⅲ ⑤ ④ 氯化铜晶体
CuCl2·2H2O无水氯化铜
W4 g 实验过程中所用的物质X、Y及pH值控制可参照下列附表确定。 回答下列问题:
1、??沉淀Ⅱ的成分是(写化学式) 。
2、??物质X可选用表二中的 ,物质Y可选用表二中的 。
(填序号,且全部选出)
3、过滤Ⅱ操作中所用仪器有铁架台(带铁圈)、烧杯、滤纸等,还需使用的
仪器是(填仪器名称) 。
Fe(OH)3 H、E A、D 漏斗、玻棒 练 习3、某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数(即质量百分含量),其实验步骤如下:粗氧化铜W1g ①加过量盐酸过滤?溶液Ⅰ沉淀Ⅰ W2g沉淀ⅡW3 g②加入X ?溶液Ⅱ ③加入Y
过滤 ?溶液Ⅲ ⑤ ④ 氯化铜晶体
CuCl2·2H2O无水氯化铜
W4 g ④ 、⑤步操作中,所需装置如图所示: ①??按气流的方向从左到右的顺序,各装置的连接顺序(填接口字母)为
接 、 接 、 接 。
②? D中所发生反应的化学方程式为: 。
③? C的作用是 ,
浓H2SO4 碱石灰
A B C Da、防空气中的水蒸气进入B,而得不到纯的无水CuCl2
b、吸收HCl气体及分解产生的水蒸气。 g3、某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数(即质量百分含量),其实验步骤如下:粗氧化铜W1g ①加过量盐酸过滤?溶液Ⅰ沉淀Ⅰ W2g沉淀ⅡW3 g②加入X ?溶液Ⅱ ③加入Y
过滤 ?溶液Ⅲ ⑤ ④ 氯化铜晶体
CuCl2·2H2O无水氯化铜
W4 g ④若第④步中有80%的氯化铜转入晶体,其余各步骤转化都是完全的,则样品中
氧化铜的质量分数(质量百分含量)的计算式为: 。解题方法与思路明确试验目的原理———明确试验的目的要求
选择仪器药品———选择合理的化学仪器和药品
设计装置步骤———设计出合理的实验装置和实验操作步骤
记录现象、数据
分析得出结论———根据实验观察的现象和得出的数据,通过分析、计算、图表、推理等处理,得出正确的结论
谢谢
