课题 3 金属资源的利用和保护(34张PPT)
文档属性
| 名称 | 课题 3 金属资源的利用和保护(34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 668.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-17 00:00:00 | ||
图片预览










文档简介
课件34张PPT。课题3
金属资源的利用和保护一、金属在自然界的存在形式
1.存在形式:金属资源广泛存在于地壳和海洋中,除少数极不
活泼的金属如金、银等有_____形式存在外,其余都以_______
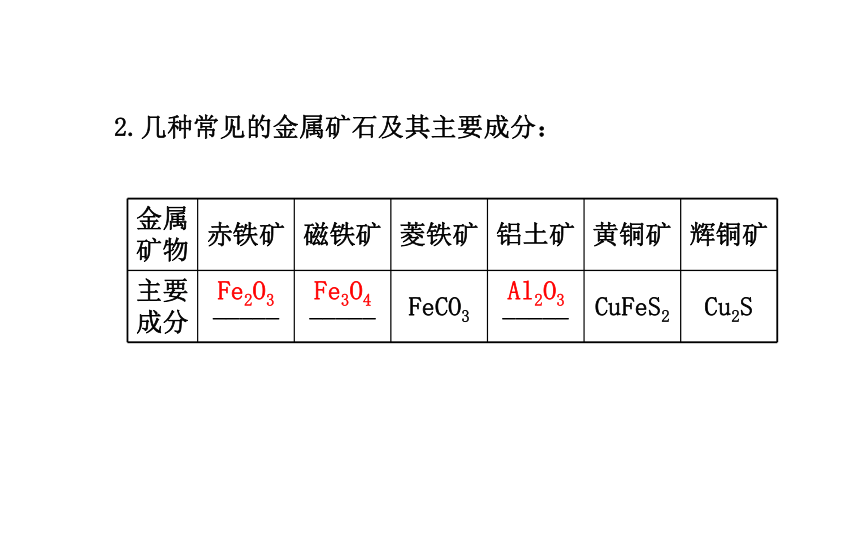
形式存在。单质化合物2.几种常见的金属矿石及其主要成分:Fe2O3Fe3O4Al2O3二、铁的冶炼
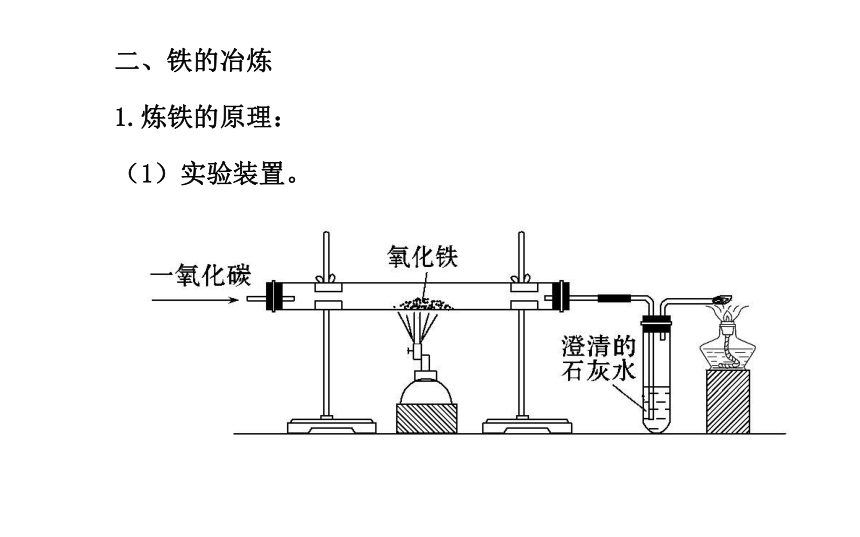
1.炼铁的原理:
(1)实验装置。(2)实验现象:玻璃管中,红棕色的氧化铁逐渐变为_____,试管中澄清的石灰水_______,右侧导管口有_________。
(3)实验原理(用化学方程式表示):
______________________。黑色变浑浊蓝色火焰Fe2O3+3CO 3CO2+2Fe【微点拨】
由于一氧化碳有毒,不能直接排放到空气中,装置中右侧的酒精灯所起的作用是点燃未反应的一氧化碳气体,防止污染空气。2.工业炼铁:
(1)主要设备:_____。
(2)原料:_______、_____、石灰石和空气等。
(3)发生的主要反应。
①产生还原剂:C+O2 CO2;CO2+C 2CO。
②生成生铁:
______________________。高炉铁矿石焦炭Fe2O3+3CO 3CO2+2Fe3.含杂质物质的化学方程式的计算:
(1)化学方程式所表达的是纯净的物质间的质量关系,因此当反应物或生成物含杂质时,应首先换算成纯净物质的质量,再进行计算。
(2)不纯物质、纯物质和纯度之间的关系。
①纯物质的质量=_____________________。
②不纯物质的质量=___________________。
③纯度= ×100%。不纯物质的质量×纯度纯物质的质量÷纯度三、金属资源保护
1.铁制品锈蚀:
(1)条件:与空气中的_____和___接触。
(2)铁锈的主要成分:Fe2O3·xH2O,结构很疏松,不能阻碍
里层的铁继续被锈蚀。
2.防止铁制品锈蚀的方法:
(1)保持铁制品表面的___________。
(2)在铁制品表面覆盖_______,如在铁制品表面涂油、刷
漆、电镀等。
(3)改变铁的组成和结构,制成耐腐蚀的_____,如不锈钢。氧气水洁净与干燥保护层合金3.金属资源保护:
(1)保护金属资源的原因。
①金属矿物的储量有限,而且不能再生。
②废旧金属的随意丢弃会污染环境。
(2)保护金属资源的措施。
①防止金属_____。
②_________废旧金属。
③_____________地开采矿物。
④寻找金属的_______。锈蚀回收利用有计划、合理代用品1.判断正误:
(1)自然界中的金属都以化合物形式存在。( )
提示:少数金属如金、银等在自然界以单质的形式存在。
(2)磁铁矿、黄铁矿都是含铁的矿石,都适合炼铁。( )
提示:黄铁矿所含的硫元素与氧气反应生成有害气体二氧化硫,造成空气污染,不适合炼铁。××(3)自然界中的金属资源是取之不尽的。( )
提示:自然界中的金属资源是有限的,并不是取之不尽的。
(4)回收利用废旧金属、寻找金属代用品都是保护金属资源的有效途径。( )
提示:由于金属资源不可再生,回收利用废旧金属、寻找金属的代用品是保护金属资源的有效途径。×√2.某工厂要用1 000 t含氧化铁80%的赤铁矿石炼铁,理论上可以炼出含铁量为96%的生铁的质量是( )
A.560 t B.583 t C.800 t D.720 t
【解析】选B。1 000 t含氧化铁80%的赤铁矿石中氧化铁的质量为800 t,根据氧化铁与一氧化碳反应的化学方程式可以确定Fe2O3与Fe的质量关系,即 ,然后由Fe2O3的质量800 t,计算生成铁的质量为560 t,从而可以计算生铁的质量为 =583 t。3.在日常生活中,常会发现许多铁制品表面都喷上了油漆,喷油漆的目的是( )
A.增大硬度、防止破坏 B.增加厚度、防止磨损
C.防止铁生锈,而且美观 D.增大铁制品的强度
【解析】选C。铁制品表面喷上油漆,起到隔绝层的作用,不仅防止了铁生锈,而且美观。4.下列措施中,不能防止铁制品锈蚀的是( )
A.喷漆 B.镀一层耐腐蚀的金属
C.制成不锈钢 D.存放在潮湿的空气中
【解析】选D。A项,喷漆能使铁制品与水和氧气隔绝,能够防止生锈;B项,镀一层耐腐蚀的金属能使铁制品与水和氧气隔绝,能够防止生锈;C项,制成不锈钢能够改变铁制品的结构,能够防止生锈;D项,铁制品放在潮湿的空气中时,能够和水与氧气充分接触,容易生锈。要点一 铁的冶炼
冶炼原理(一氧化碳还原氧化铁)
(1)实验装置:
(2)实验原理:Fe2O3+3CO 2Fe+3CO2。(3)实验注意问题。
①本实验对温度要求较高,应该用酒精喷灯加热,如果用酒精灯需加上网罩。
②实验开始时要先通入一氧化碳,以排净玻璃管中的空气,避免加热时发生爆炸。
③实验结束时应先停止加热,继续通入一氧化碳至冷却至室温,防止高温的铁被氧化。
④由于一氧化碳有毒,不能直接排放到空气中,因此必须有尾气处理装置,可直接点燃使其变为无毒的二氧化碳;或者在导气管尾端接气球等将其收集起来。【示范题1】炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见下图:对实验进行分析并回答:
(1)给玻璃管加热的仪器叫酒精喷灯,要用其________(填“外焰”“内焰”或“焰心”)进行加热。
(2)实验中玻璃管里氧化铁粉末的颜色变化是___________,观察到澄清石灰水的现象是_____________。
(3)实验前“通入CO”与“开始加热”的顺序是_________;实验后“停止通入CO”与“停止加热”的顺序是__________。
(4)实验要在装置末端a处燃着一盏酒精灯,此处所发生反应的化学方程式为____________________________。【解析】本题考查铁的冶炼原理,解题时要注意分析仪器的作用、操作顺序、尾气处理等问题。(1)酒精喷灯的外焰温度最高,故应用外焰加热。(2)氧化铁粉末被还原为铁,可观察到粉末由红棕色逐渐变为黑色,生成的二氧化碳使澄清的石灰水变浑浊。(3)实验开始时要先通入一氧化碳,以排净玻璃管中的空气,避免加热时发生爆炸,然后再加热;实验结束时应先停止加热,继续通入一氧化碳至冷却至室温,防止高温的铁被氧化。(4)由于尾气中的一氧化碳有毒,不能直接排放到空气中,因此必须有尾气处理装置,装置末端a处的酒精灯可点燃未反应的一氧化碳气体,防止污染空气。答案:(1)外焰 (2)由红棕色逐渐变为黑色 变浑浊
(3)先通入CO,再开始加热 先停止加热,后停止通入CO
(4)2CO+O2 2CO2要点二 铁制品的锈蚀与防护
1.铁制品的锈蚀:
(1)铁生锈是铁与氧气、水等物质相互作用,发生的一系列复杂化学反应,有氧气参加,进程缓慢,没有发光现象,放热不易察觉,所以铁生锈发生的是缓慢氧化。
(2)钢铁的纯度、环境的温度、湿度和酸碱性等也是影响钢铁锈蚀的因素。2.防止铁生锈常采用的方法:
(1)干:保持铁制品表面洁净和干燥。
(2)膜:在铁制品表面覆盖保护膜,如在车、船的表面喷涂油漆,机械表面涂油,在杯子表面烧涂搪瓷等。
(3)镀:在铁制品表面镀一层其他金属,如在钢铁表面镀锌、镀铬等。
(4)烤:用化学方法使铁制品表面形成致密的氧化膜,如锯条上的烤蓝。
(5)改:改善金属的本质,添加合金元素,如在铁制品中加入镍制成不锈钢,可以增强耐腐蚀性能。【示范题2】“对比法”是实验探究中常用的一种科学方法。分析以下铁钉生锈实验的设计,得出的结论不正确的是( )A.对比①②可以说明铁生锈一定要有氧气参加
B.对比②③可以说明铁生锈一定要有水参加
C.对比①③可以说明铁生锈一定要有水参加
D.对比①②③可以说明铁生锈必须水和氧气同时参加
【解析】选B。对比②③可以看出有两个变量在变,无法判断铁生锈需要的条件。故选B。【拓展延伸】金属的生锈
许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,“铜锈”即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的结果。金属铝也易生“锈”,但“铝锈”同铁锈、铜锈不同,它是一层致密的氧化铝薄膜,覆盖在金属铝的表面,能防止内部的铝继续与氧气反应,起到自我保护的作用。要点三 含杂质物质的化学方程式的计算
1.在计算过程中,不论是反应物还是生成物,代入化学方程式进行计算的量都必须是纯净物的质量。
2.若已知物质不纯,需先计算出其中纯物质的质量:纯物质的质量=不纯物质的质量×纯物质的质量分数,然后用纯物质的质量,根据化学方程式计算求出其他物质的质量。
3.若待求物不纯,需先根据化学方程式计算出待求物中纯物质的质量,再由纯物质的质量计算出不纯物质的质量。不纯物质的质量=纯物质的质量÷纯物质的质量分数。【示范题3】在工业制取硫酸的过程中,有发生如下反应:4FeS2+11O2 2Fe2O3+8SO2。现有含FeS260%的黄铁矿100 t(假设杂质不参加反应),最多可生产SO2多少吨?
【解析】本题主要考查含有杂质的有关物质的计算。代入化学方程式的量必须是纯净物质量,可以先计算黄铁矿中FeS2的质量,再根据化学方程式计算生成的SO2的质量。答案:解:设最多可生产SO2的质量为x,
4FeS2+11O2 2Fe2O3+8SO2
480 512
100 t×60% x
480∶512 =(100 t×60%)∶x x=64 t
答:最多可生产SO2的质量为64 t。【教你一招】解答含有杂质物质的化学方程式的计算步骤
第一步:将含有杂质物质质量换算成纯物质的质量(纯物质质量=含杂质物质质量×纯度);
第二步:将纯物质质量代入化学方程式进行计算;
第三步:将计算得到的纯物质质量换算成含杂质物质质量(含杂质物质质量=纯物质质量÷纯度)。1.观察一氧化碳还原氧化铁的实验装置,然后结合你所学的知识完成图中的空白。提示:一氧化碳还原氧化铁时生成使澄清石灰水变浑浊的二氧化碳气体和黑色的铁粉;将没有反应的一氧化碳气体燃烧掉,可防止对空气产生污染。2.将图中三支试管放置一周时间,只有试管①内的铁钉在水面上的部分生锈,而试管②和试管③内的铁钉没有明显变化,据此完成图中的空白和结论:提示:①、②两支试管作对照,说明铁制品生锈需要有空气;①、③两支试管作对照,说明铁制品生锈需要有水,从而得出铁制品生锈的条件是与空气中的氧气和水蒸气同时接触。
金属资源的利用和保护一、金属在自然界的存在形式
1.存在形式:金属资源广泛存在于地壳和海洋中,除少数极不
活泼的金属如金、银等有_____形式存在外,其余都以_______
形式存在。单质化合物2.几种常见的金属矿石及其主要成分:Fe2O3Fe3O4Al2O3二、铁的冶炼
1.炼铁的原理:
(1)实验装置。(2)实验现象:玻璃管中,红棕色的氧化铁逐渐变为_____,试管中澄清的石灰水_______,右侧导管口有_________。
(3)实验原理(用化学方程式表示):
______________________。黑色变浑浊蓝色火焰Fe2O3+3CO 3CO2+2Fe【微点拨】
由于一氧化碳有毒,不能直接排放到空气中,装置中右侧的酒精灯所起的作用是点燃未反应的一氧化碳气体,防止污染空气。2.工业炼铁:
(1)主要设备:_____。
(2)原料:_______、_____、石灰石和空气等。
(3)发生的主要反应。
①产生还原剂:C+O2 CO2;CO2+C 2CO。
②生成生铁:
______________________。高炉铁矿石焦炭Fe2O3+3CO 3CO2+2Fe3.含杂质物质的化学方程式的计算:
(1)化学方程式所表达的是纯净的物质间的质量关系,因此当反应物或生成物含杂质时,应首先换算成纯净物质的质量,再进行计算。
(2)不纯物质、纯物质和纯度之间的关系。
①纯物质的质量=_____________________。
②不纯物质的质量=___________________。
③纯度= ×100%。不纯物质的质量×纯度纯物质的质量÷纯度三、金属资源保护
1.铁制品锈蚀:
(1)条件:与空气中的_____和___接触。
(2)铁锈的主要成分:Fe2O3·xH2O,结构很疏松,不能阻碍
里层的铁继续被锈蚀。
2.防止铁制品锈蚀的方法:
(1)保持铁制品表面的___________。
(2)在铁制品表面覆盖_______,如在铁制品表面涂油、刷
漆、电镀等。
(3)改变铁的组成和结构,制成耐腐蚀的_____,如不锈钢。氧气水洁净与干燥保护层合金3.金属资源保护:
(1)保护金属资源的原因。
①金属矿物的储量有限,而且不能再生。
②废旧金属的随意丢弃会污染环境。
(2)保护金属资源的措施。
①防止金属_____。
②_________废旧金属。
③_____________地开采矿物。
④寻找金属的_______。锈蚀回收利用有计划、合理代用品1.判断正误:
(1)自然界中的金属都以化合物形式存在。( )
提示:少数金属如金、银等在自然界以单质的形式存在。
(2)磁铁矿、黄铁矿都是含铁的矿石,都适合炼铁。( )
提示:黄铁矿所含的硫元素与氧气反应生成有害气体二氧化硫,造成空气污染,不适合炼铁。××(3)自然界中的金属资源是取之不尽的。( )
提示:自然界中的金属资源是有限的,并不是取之不尽的。
(4)回收利用废旧金属、寻找金属代用品都是保护金属资源的有效途径。( )
提示:由于金属资源不可再生,回收利用废旧金属、寻找金属的代用品是保护金属资源的有效途径。×√2.某工厂要用1 000 t含氧化铁80%的赤铁矿石炼铁,理论上可以炼出含铁量为96%的生铁的质量是( )
A.560 t B.583 t C.800 t D.720 t
【解析】选B。1 000 t含氧化铁80%的赤铁矿石中氧化铁的质量为800 t,根据氧化铁与一氧化碳反应的化学方程式可以确定Fe2O3与Fe的质量关系,即 ,然后由Fe2O3的质量800 t,计算生成铁的质量为560 t,从而可以计算生铁的质量为 =583 t。3.在日常生活中,常会发现许多铁制品表面都喷上了油漆,喷油漆的目的是( )
A.增大硬度、防止破坏 B.增加厚度、防止磨损
C.防止铁生锈,而且美观 D.增大铁制品的强度
【解析】选C。铁制品表面喷上油漆,起到隔绝层的作用,不仅防止了铁生锈,而且美观。4.下列措施中,不能防止铁制品锈蚀的是( )
A.喷漆 B.镀一层耐腐蚀的金属
C.制成不锈钢 D.存放在潮湿的空气中
【解析】选D。A项,喷漆能使铁制品与水和氧气隔绝,能够防止生锈;B项,镀一层耐腐蚀的金属能使铁制品与水和氧气隔绝,能够防止生锈;C项,制成不锈钢能够改变铁制品的结构,能够防止生锈;D项,铁制品放在潮湿的空气中时,能够和水与氧气充分接触,容易生锈。要点一 铁的冶炼
冶炼原理(一氧化碳还原氧化铁)
(1)实验装置:
(2)实验原理:Fe2O3+3CO 2Fe+3CO2。(3)实验注意问题。
①本实验对温度要求较高,应该用酒精喷灯加热,如果用酒精灯需加上网罩。
②实验开始时要先通入一氧化碳,以排净玻璃管中的空气,避免加热时发生爆炸。
③实验结束时应先停止加热,继续通入一氧化碳至冷却至室温,防止高温的铁被氧化。
④由于一氧化碳有毒,不能直接排放到空气中,因此必须有尾气处理装置,可直接点燃使其变为无毒的二氧化碳;或者在导气管尾端接气球等将其收集起来。【示范题1】炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见下图:对实验进行分析并回答:
(1)给玻璃管加热的仪器叫酒精喷灯,要用其________(填“外焰”“内焰”或“焰心”)进行加热。
(2)实验中玻璃管里氧化铁粉末的颜色变化是___________,观察到澄清石灰水的现象是_____________。
(3)实验前“通入CO”与“开始加热”的顺序是_________;实验后“停止通入CO”与“停止加热”的顺序是__________。
(4)实验要在装置末端a处燃着一盏酒精灯,此处所发生反应的化学方程式为____________________________。【解析】本题考查铁的冶炼原理,解题时要注意分析仪器的作用、操作顺序、尾气处理等问题。(1)酒精喷灯的外焰温度最高,故应用外焰加热。(2)氧化铁粉末被还原为铁,可观察到粉末由红棕色逐渐变为黑色,生成的二氧化碳使澄清的石灰水变浑浊。(3)实验开始时要先通入一氧化碳,以排净玻璃管中的空气,避免加热时发生爆炸,然后再加热;实验结束时应先停止加热,继续通入一氧化碳至冷却至室温,防止高温的铁被氧化。(4)由于尾气中的一氧化碳有毒,不能直接排放到空气中,因此必须有尾气处理装置,装置末端a处的酒精灯可点燃未反应的一氧化碳气体,防止污染空气。答案:(1)外焰 (2)由红棕色逐渐变为黑色 变浑浊
(3)先通入CO,再开始加热 先停止加热,后停止通入CO
(4)2CO+O2 2CO2要点二 铁制品的锈蚀与防护
1.铁制品的锈蚀:
(1)铁生锈是铁与氧气、水等物质相互作用,发生的一系列复杂化学反应,有氧气参加,进程缓慢,没有发光现象,放热不易察觉,所以铁生锈发生的是缓慢氧化。
(2)钢铁的纯度、环境的温度、湿度和酸碱性等也是影响钢铁锈蚀的因素。2.防止铁生锈常采用的方法:
(1)干:保持铁制品表面洁净和干燥。
(2)膜:在铁制品表面覆盖保护膜,如在车、船的表面喷涂油漆,机械表面涂油,在杯子表面烧涂搪瓷等。
(3)镀:在铁制品表面镀一层其他金属,如在钢铁表面镀锌、镀铬等。
(4)烤:用化学方法使铁制品表面形成致密的氧化膜,如锯条上的烤蓝。
(5)改:改善金属的本质,添加合金元素,如在铁制品中加入镍制成不锈钢,可以增强耐腐蚀性能。【示范题2】“对比法”是实验探究中常用的一种科学方法。分析以下铁钉生锈实验的设计,得出的结论不正确的是( )A.对比①②可以说明铁生锈一定要有氧气参加
B.对比②③可以说明铁生锈一定要有水参加
C.对比①③可以说明铁生锈一定要有水参加
D.对比①②③可以说明铁生锈必须水和氧气同时参加
【解析】选B。对比②③可以看出有两个变量在变,无法判断铁生锈需要的条件。故选B。【拓展延伸】金属的生锈
许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,“铜锈”即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的结果。金属铝也易生“锈”,但“铝锈”同铁锈、铜锈不同,它是一层致密的氧化铝薄膜,覆盖在金属铝的表面,能防止内部的铝继续与氧气反应,起到自我保护的作用。要点三 含杂质物质的化学方程式的计算
1.在计算过程中,不论是反应物还是生成物,代入化学方程式进行计算的量都必须是纯净物的质量。
2.若已知物质不纯,需先计算出其中纯物质的质量:纯物质的质量=不纯物质的质量×纯物质的质量分数,然后用纯物质的质量,根据化学方程式计算求出其他物质的质量。
3.若待求物不纯,需先根据化学方程式计算出待求物中纯物质的质量,再由纯物质的质量计算出不纯物质的质量。不纯物质的质量=纯物质的质量÷纯物质的质量分数。【示范题3】在工业制取硫酸的过程中,有发生如下反应:4FeS2+11O2 2Fe2O3+8SO2。现有含FeS260%的黄铁矿100 t(假设杂质不参加反应),最多可生产SO2多少吨?
【解析】本题主要考查含有杂质的有关物质的计算。代入化学方程式的量必须是纯净物质量,可以先计算黄铁矿中FeS2的质量,再根据化学方程式计算生成的SO2的质量。答案:解:设最多可生产SO2的质量为x,
4FeS2+11O2 2Fe2O3+8SO2
480 512
100 t×60% x
480∶512 =(100 t×60%)∶x x=64 t
答:最多可生产SO2的质量为64 t。【教你一招】解答含有杂质物质的化学方程式的计算步骤
第一步:将含有杂质物质质量换算成纯物质的质量(纯物质质量=含杂质物质质量×纯度);
第二步:将纯物质质量代入化学方程式进行计算;
第三步:将计算得到的纯物质质量换算成含杂质物质质量(含杂质物质质量=纯物质质量÷纯度)。1.观察一氧化碳还原氧化铁的实验装置,然后结合你所学的知识完成图中的空白。提示:一氧化碳还原氧化铁时生成使澄清石灰水变浑浊的二氧化碳气体和黑色的铁粉;将没有反应的一氧化碳气体燃烧掉,可防止对空气产生污染。2.将图中三支试管放置一周时间,只有试管①内的铁钉在水面上的部分生锈,而试管②和试管③内的铁钉没有明显变化,据此完成图中的空白和结论:提示:①、②两支试管作对照,说明铁制品生锈需要有空气;①、③两支试管作对照,说明铁制品生锈需要有水,从而得出铁制品生锈的条件是与空气中的氧气和水蒸气同时接触。
同课章节目录
