11.1 课题1 生活中常见的盐(37张PPT)
文档属性
| 名称 | 11.1 课题1 生活中常见的盐(37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 592.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-17 21:43:39 | ||
图片预览











文档简介
课件37张PPT。第十一单元 盐 化肥
课题1 生活中常见的盐一、氯化钠
1.盐的概念:组成里含有____________________和_________的一类化合物。金属离子(或铵根离子)酸根离子【微点拨】
有的盐中不含有金属离子,如氯化铵(NH4Cl)等。2.氯化钠:
(1)在人体中的存在与作用。
①存在:氯化钠俗称_____,化学式为_____。大部分以_____形式存在于体液中。
②作用:
a.钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用。
b.氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。NaCl离子食盐(2)主要用途。
①医疗上用来配制_________。
②农业上用氯化钠溶液来_____。
③工业上以氯化钠为原料制取碳酸钠、氢氧化钠等。
④生活中用作_______和防腐剂等。
⑤交通上用于消除公路上的_____。生理盐水选种调味品积雪【微点拨】
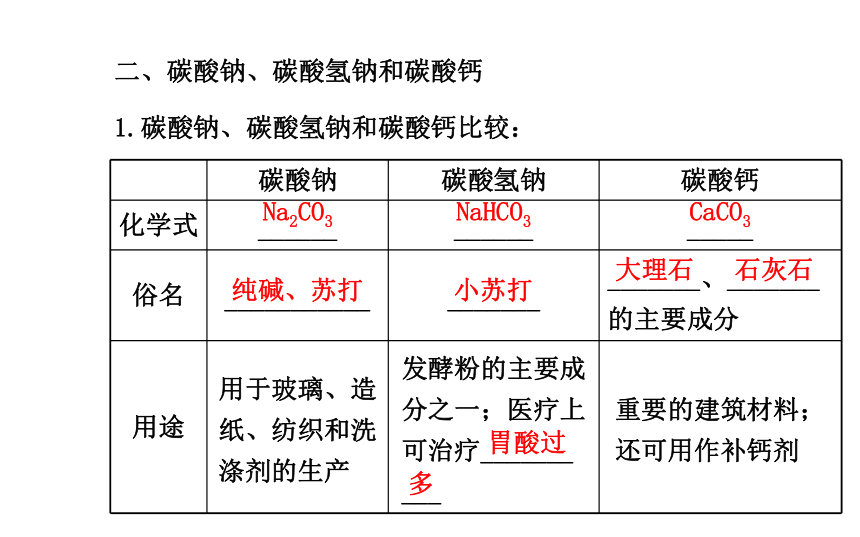
提纯后的精盐仍然含有一些可溶性杂质,属于混合物。二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠、碳酸氢钠和碳酸钙比较:Na2CO3NaHCO3CaCO3纯碱、苏打小苏打大理石石灰石胃酸过多2.碳酸钠、碳酸氢钠和碳酸钙的化学性质:
(1)与盐酸反应。
反应的化学方程式分别为
①碳酸钙:_____________________________。
②碳酸钠:______________________________。
③碳酸氢钠:____________________________。CaCO3+2HCl====CaCl2+H2O+CO2↑Na2CO3+2HCl====2NaCl+CO2↑+H2ONaHCO3+HCl====NaCl+H2O+CO2↑【微点拨】
含有碳酸根离子或碳酸氢根离子的盐都能与盐酸反应生成二氧化碳气体。(2)碳酸钠与氢氧化钙的反应:向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,溶液_______,反应的化学方程式为
_______________________________。 变浑浊Ca(OH)2+Na2CO3====CaCO3↓+2NaOH三、复分解反应
1.概念:两种化合物_____________,生成另外___________的反应。
2.反应表达式:AB+CD====AD+CB。
3.发生的条件:生成物中有_____或有_____或有___生成。互相交换成分两种化合物沉淀气体水1.判断正误:
(1)盐都有咸味,都可用作调味品。( )
提示:盐是一类物质,并不都有咸味,工业盐中的亚硝酸钠、硫酸铜、氯化钡都有毒,不可食用。
(2)纯碱属于碱类,可用于玻璃、造纸、纺织、洗涤剂的生产等。( )
提示:纯碱是碳酸钠的俗称,属于盐类物质。××(3)小苏打可以用于治疗胃酸过多,是因为能与胃液中的盐酸反应。( )
提示:小苏打是碳酸氢钠的俗称,含有碳酸氢根离子,能与盐酸反应生成二氧化碳,从而消耗多余的胃酸。
(4)酸、碱或盐在溶液中一定能发生复分解反应。( )
提示:生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。√×2.下列物质的名称、俗名与化学式完全对应的是( )
A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH
【解析】选D。氯化钠的化学式为NaCl;碳酸氢钠俗称为小苏打,化学式为NaHCO3,碳酸钠俗称纯碱,化学式为Na2CO3;氢氧化钙的化学式为Ca(OH)2。故D选项正确。3.下列常见盐在生产、生活中的用途不合理的是( )
A.用亚硝酸钠腌渍食品 B.用高锰酸钾制取氧气
C.用纯碱消耗面粉发酵生成的酸 D.用食盐生产烧碱
【解析】选A。亚硝酸钠有毒,不能用于腌渍食品。4.小明同学用实验方法区别稀盐酸和硫酸钠溶液(记作A、B)。
(1)他向A、B两溶液中分别加入Na2CO3溶液,观察到A溶液中产生无色气体。则A是________,发生反应的化学方程式为
_____________________________。
(2)他向A、B两溶液中分别加入BaCl2溶液,B溶液中的现象是_____________________________。(3)他还用了下列试剂中的一种区别A、B两溶液,这种试剂是________(填序号)。
①石蕊溶液 ②CuSO4溶液 ③醋酸溶液
④KCl溶液【解析】(1)稀盐酸与Na2CO3溶液反应产生气泡,硫酸钠溶液与Na2CO3溶液不反应。(2)硫酸钠溶液与BaCl2溶液反应产生白色的沉淀,稀盐酸和BaCl2溶液由于含有相同的氯离子,不发生反应。(3)稀盐酸和硫酸钠溶液分别显酸性和中性,故可用石蕊溶液鉴别。
答案:(1)稀盐酸 Na2CO3+2HCl====2NaCl+CO2↑+H2O
(2)产生白色沉淀 (3)①要点一 正确理解盐的化学性质
1.盐的化学性质的一般规律及反应类型:2.碳酸盐或碳酸氢盐的检验:加入稀盐酸,产生能使澄清石灰水变浑浊的气体。【示范题1】将一定量的碳酸钠溶液与氯化钡溶液混合,过滤反应后的混合物,某研究小组的同学们欲探究滤液中溶质的组成。请你一同参与探究并回答有关问题:
【查阅资料】碳酸钠溶液显碱性;氯化钠、氯化钡溶液显中性。
请你写出碳酸钠溶液与氯化钡溶液反应的化学方程式:_____
___________________________________。【提出猜想】
猜想1:滤液中溶质是NaCl;
猜想2:滤液中溶质是NaCl和____________(填化学式)的混合物;
猜想3:滤液中溶质是NaCl和Na2CO3的混合物。
【实验探究】
(1)取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象,同学们认为猜想________不成立。
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有
________(填实验现象),证明猜想2成立。【问题讨论】
(1)甲同学认为要证明猜想2成立也可以改用硫酸钠溶液。你认为甲同学________(填“能”或“不能”)达到实验目的。
(2)乙同学认为要证明猜想2成立也可以改用硝酸银溶液。你认为乙同学________(填“能”或“不能”)达到实验目的。【解析】碳酸钠与氯化钡反应生成白色沉淀,反应方程式为
Na2CO3+BaCl2====BaCO3↓+2NaCl。由于上述反应的发生,滤液
中一定有NaCl,还可能有BaCl2或Na2CO3,但二者不能共存。因
此滤液的成分出现三种可能①NaCl;②NaCl、BaCl2;③NaCl、
Na2CO3。取少量滤液滴加无色酚酞试液,无明显现象说明溶液
呈酸性或者中性,碳酸钠溶液呈碱性,故猜想3不正确;另取
少量溶液,滴加碳酸钠溶液时,要想证明猜想2正确,说明加
入碳酸钠后,发生反应Na2CO3+BaCl2====BaCO3↓+2NaCl,出现
白色沉淀生成的现象。当然,在探究BaCl2是否存在时,也可利用硫酸钠,二者反应生成白色的硫酸钡沉淀。但是不能利用硝酸银溶液,因为滤液中一定有NaCl,它也能与硝酸银反应生成白色的氯化银沉淀。
答案:【查阅资料】Na2CO3+BaCl2====BaCO3↓+2NaCl
【提出猜想】猜想2:BaCl2
【实验探究】(1)3 (2)白色沉淀生成
【问题讨论】(1)能 (2)不能要点二 复分解反应及其发生的条件
1.复分解反应的特点:
(1)反应表达式:AB+CD→AD+CB。
(2)实质:化合物间互相交换成分。
(3)发生的条件:有沉淀、气体或水生成。三者必具其一。
2.常见的复分解反应:
(1)酸+金属氧化物→盐+水。
(2)酸+碱→盐+水。
(3)酸+盐→盐+酸。
(4)碱+盐→碱+盐。
(5)盐+盐→盐+盐。【示范题2】某小组为了验证复分解反应发生的条件,选用了下列部分药品进行实验。
①氢氧化钠溶液 ②硫酸铜溶液
③稀盐酸 ④硝酸钾溶液
(1)为了验证有水生成的复分解反应能发生,某同学选择了①和③。你认为除上述四种药品外,还需增加的一种试剂是________。(2)选择________(填序号)两种物质进行实验,能验证有沉淀生成的复分解反应能发生,其化学方程式__________。
(3)下列反应中,能验证有气体生成的复分解反应能发生的是________(填序号)。
A.锌与稀硫酸反应
B.天然气燃烧
C.石灰石与稀盐酸反应
D.过氧化氢分解【解析】本题考查复分解反应的条件和应用。
(1)①和③之间能发生复分解反应,但由于反应无明显现象,故无法判断反应是否发生,可借助于反应中溶液pH的变化引起的指示剂颜色的变化,判断该反应是否发生;(2)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀与硫酸钠,故可用此反应验证有沉淀生成的复分解反应能发生;(3)复分解反应的反应物是两种化合物,锌与稀硫酸反应和天然气燃烧的反应物均有一种是单质、过氧化氢分解的反应物只有一种,故A、B、D不属于复分解反应。答案:(1)酚酞溶液(或石蕊溶液)
(2)①② 2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
(3)C【备选习题】下列各组物质的溶液混合后,不能发生反应的
是( )
A.NaCl和H2SO4 B.NaOH和HCl
C.Na2CO3和H2SO4 D.AgNO3和NaCl
【解析】选A。B中有水生成,C中有水和气体生成,D中有沉淀生成,都符合复分解反应的条件,都能发生反应。A中不符合复分解反应的条件,不能发生反应。【示范题3】下列各组离子在水中能大量共存的是( )
A.Na+、Ba2+、 B.H+、Cu2+、OH-
C.K+、 、Cl- D.H+、 、Cl-
【解析】选C。A项,Ba2+、 反应生成BaSO4,不能共存;B项,Cu2+、OH-反应生成Cu(OH)2沉淀,H+、OH-反应生成水,不能共存;C项,K+、 、Cl-三种离子间相互都不反应,能共存;D项,H+、 反应生成CO2和H2O,不能共存;故选C。【拓展归纳】初中常见在溶液中能反应的离子 1.结合所学过的盐的化学性质,将下表填写完整。提示:盐与某些金属反应生成另一种金属和另一种盐,属于置换反应。盐与某些酸反应生成另一种盐和另一种酸;盐与某些碱反应生成另一种盐和另一种碱;盐与某些盐反应生成两种新的盐。盐与酸、碱、盐之间的反应属于复分解反应。2.请结合氯化钠溶液与硝酸银溶液反应的微观实质,在方框的圆圈中用离子符号或物质的化学式填写完整。提示:氯化钠溶液与硝酸银溶液反应的实质是溶液中的Cl-与
Ag+结合生成氯化银沉淀,而Na+与 在溶液中不发生改变。
所以右边应填Na+、 及AgCl。
课题1 生活中常见的盐一、氯化钠
1.盐的概念:组成里含有____________________和_________的一类化合物。金属离子(或铵根离子)酸根离子【微点拨】
有的盐中不含有金属离子,如氯化铵(NH4Cl)等。2.氯化钠:
(1)在人体中的存在与作用。
①存在:氯化钠俗称_____,化学式为_____。大部分以_____形式存在于体液中。
②作用:
a.钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用。
b.氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。NaCl离子食盐(2)主要用途。
①医疗上用来配制_________。
②农业上用氯化钠溶液来_____。
③工业上以氯化钠为原料制取碳酸钠、氢氧化钠等。
④生活中用作_______和防腐剂等。
⑤交通上用于消除公路上的_____。生理盐水选种调味品积雪【微点拨】
提纯后的精盐仍然含有一些可溶性杂质,属于混合物。二、碳酸钠、碳酸氢钠和碳酸钙
1.碳酸钠、碳酸氢钠和碳酸钙比较:Na2CO3NaHCO3CaCO3纯碱、苏打小苏打大理石石灰石胃酸过多2.碳酸钠、碳酸氢钠和碳酸钙的化学性质:
(1)与盐酸反应。
反应的化学方程式分别为
①碳酸钙:_____________________________。
②碳酸钠:______________________________。
③碳酸氢钠:____________________________。CaCO3+2HCl====CaCl2+H2O+CO2↑Na2CO3+2HCl====2NaCl+CO2↑+H2ONaHCO3+HCl====NaCl+H2O+CO2↑【微点拨】
含有碳酸根离子或碳酸氢根离子的盐都能与盐酸反应生成二氧化碳气体。(2)碳酸钠与氢氧化钙的反应:向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,溶液_______,反应的化学方程式为
_______________________________。 变浑浊Ca(OH)2+Na2CO3====CaCO3↓+2NaOH三、复分解反应
1.概念:两种化合物_____________,生成另外___________的反应。
2.反应表达式:AB+CD====AD+CB。
3.发生的条件:生成物中有_____或有_____或有___生成。互相交换成分两种化合物沉淀气体水1.判断正误:
(1)盐都有咸味,都可用作调味品。( )
提示:盐是一类物质,并不都有咸味,工业盐中的亚硝酸钠、硫酸铜、氯化钡都有毒,不可食用。
(2)纯碱属于碱类,可用于玻璃、造纸、纺织、洗涤剂的生产等。( )
提示:纯碱是碳酸钠的俗称,属于盐类物质。××(3)小苏打可以用于治疗胃酸过多,是因为能与胃液中的盐酸反应。( )
提示:小苏打是碳酸氢钠的俗称,含有碳酸氢根离子,能与盐酸反应生成二氧化碳,从而消耗多余的胃酸。
(4)酸、碱或盐在溶液中一定能发生复分解反应。( )
提示:生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。√×2.下列物质的名称、俗名与化学式完全对应的是( )
A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH
【解析】选D。氯化钠的化学式为NaCl;碳酸氢钠俗称为小苏打,化学式为NaHCO3,碳酸钠俗称纯碱,化学式为Na2CO3;氢氧化钙的化学式为Ca(OH)2。故D选项正确。3.下列常见盐在生产、生活中的用途不合理的是( )
A.用亚硝酸钠腌渍食品 B.用高锰酸钾制取氧气
C.用纯碱消耗面粉发酵生成的酸 D.用食盐生产烧碱
【解析】选A。亚硝酸钠有毒,不能用于腌渍食品。4.小明同学用实验方法区别稀盐酸和硫酸钠溶液(记作A、B)。
(1)他向A、B两溶液中分别加入Na2CO3溶液,观察到A溶液中产生无色气体。则A是________,发生反应的化学方程式为
_____________________________。
(2)他向A、B两溶液中分别加入BaCl2溶液,B溶液中的现象是_____________________________。(3)他还用了下列试剂中的一种区别A、B两溶液,这种试剂是________(填序号)。
①石蕊溶液 ②CuSO4溶液 ③醋酸溶液
④KCl溶液【解析】(1)稀盐酸与Na2CO3溶液反应产生气泡,硫酸钠溶液与Na2CO3溶液不反应。(2)硫酸钠溶液与BaCl2溶液反应产生白色的沉淀,稀盐酸和BaCl2溶液由于含有相同的氯离子,不发生反应。(3)稀盐酸和硫酸钠溶液分别显酸性和中性,故可用石蕊溶液鉴别。
答案:(1)稀盐酸 Na2CO3+2HCl====2NaCl+CO2↑+H2O
(2)产生白色沉淀 (3)①要点一 正确理解盐的化学性质
1.盐的化学性质的一般规律及反应类型:2.碳酸盐或碳酸氢盐的检验:加入稀盐酸,产生能使澄清石灰水变浑浊的气体。【示范题1】将一定量的碳酸钠溶液与氯化钡溶液混合,过滤反应后的混合物,某研究小组的同学们欲探究滤液中溶质的组成。请你一同参与探究并回答有关问题:
【查阅资料】碳酸钠溶液显碱性;氯化钠、氯化钡溶液显中性。
请你写出碳酸钠溶液与氯化钡溶液反应的化学方程式:_____
___________________________________。【提出猜想】
猜想1:滤液中溶质是NaCl;
猜想2:滤液中溶质是NaCl和____________(填化学式)的混合物;
猜想3:滤液中溶质是NaCl和Na2CO3的混合物。
【实验探究】
(1)取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象,同学们认为猜想________不成立。
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有
________(填实验现象),证明猜想2成立。【问题讨论】
(1)甲同学认为要证明猜想2成立也可以改用硫酸钠溶液。你认为甲同学________(填“能”或“不能”)达到实验目的。
(2)乙同学认为要证明猜想2成立也可以改用硝酸银溶液。你认为乙同学________(填“能”或“不能”)达到实验目的。【解析】碳酸钠与氯化钡反应生成白色沉淀,反应方程式为
Na2CO3+BaCl2====BaCO3↓+2NaCl。由于上述反应的发生,滤液
中一定有NaCl,还可能有BaCl2或Na2CO3,但二者不能共存。因
此滤液的成分出现三种可能①NaCl;②NaCl、BaCl2;③NaCl、
Na2CO3。取少量滤液滴加无色酚酞试液,无明显现象说明溶液
呈酸性或者中性,碳酸钠溶液呈碱性,故猜想3不正确;另取
少量溶液,滴加碳酸钠溶液时,要想证明猜想2正确,说明加
入碳酸钠后,发生反应Na2CO3+BaCl2====BaCO3↓+2NaCl,出现
白色沉淀生成的现象。当然,在探究BaCl2是否存在时,也可利用硫酸钠,二者反应生成白色的硫酸钡沉淀。但是不能利用硝酸银溶液,因为滤液中一定有NaCl,它也能与硝酸银反应生成白色的氯化银沉淀。
答案:【查阅资料】Na2CO3+BaCl2====BaCO3↓+2NaCl
【提出猜想】猜想2:BaCl2
【实验探究】(1)3 (2)白色沉淀生成
【问题讨论】(1)能 (2)不能要点二 复分解反应及其发生的条件
1.复分解反应的特点:
(1)反应表达式:AB+CD→AD+CB。
(2)实质:化合物间互相交换成分。
(3)发生的条件:有沉淀、气体或水生成。三者必具其一。
2.常见的复分解反应:
(1)酸+金属氧化物→盐+水。
(2)酸+碱→盐+水。
(3)酸+盐→盐+酸。
(4)碱+盐→碱+盐。
(5)盐+盐→盐+盐。【示范题2】某小组为了验证复分解反应发生的条件,选用了下列部分药品进行实验。
①氢氧化钠溶液 ②硫酸铜溶液
③稀盐酸 ④硝酸钾溶液
(1)为了验证有水生成的复分解反应能发生,某同学选择了①和③。你认为除上述四种药品外,还需增加的一种试剂是________。(2)选择________(填序号)两种物质进行实验,能验证有沉淀生成的复分解反应能发生,其化学方程式__________。
(3)下列反应中,能验证有气体生成的复分解反应能发生的是________(填序号)。
A.锌与稀硫酸反应
B.天然气燃烧
C.石灰石与稀盐酸反应
D.过氧化氢分解【解析】本题考查复分解反应的条件和应用。
(1)①和③之间能发生复分解反应,但由于反应无明显现象,故无法判断反应是否发生,可借助于反应中溶液pH的变化引起的指示剂颜色的变化,判断该反应是否发生;(2)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀与硫酸钠,故可用此反应验证有沉淀生成的复分解反应能发生;(3)复分解反应的反应物是两种化合物,锌与稀硫酸反应和天然气燃烧的反应物均有一种是单质、过氧化氢分解的反应物只有一种,故A、B、D不属于复分解反应。答案:(1)酚酞溶液(或石蕊溶液)
(2)①② 2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
(3)C【备选习题】下列各组物质的溶液混合后,不能发生反应的
是( )
A.NaCl和H2SO4 B.NaOH和HCl
C.Na2CO3和H2SO4 D.AgNO3和NaCl
【解析】选A。B中有水生成,C中有水和气体生成,D中有沉淀生成,都符合复分解反应的条件,都能发生反应。A中不符合复分解反应的条件,不能发生反应。【示范题3】下列各组离子在水中能大量共存的是( )
A.Na+、Ba2+、 B.H+、Cu2+、OH-
C.K+、 、Cl- D.H+、 、Cl-
【解析】选C。A项,Ba2+、 反应生成BaSO4,不能共存;B项,Cu2+、OH-反应生成Cu(OH)2沉淀,H+、OH-反应生成水,不能共存;C项,K+、 、Cl-三种离子间相互都不反应,能共存;D项,H+、 反应生成CO2和H2O,不能共存;故选C。【拓展归纳】初中常见在溶液中能反应的离子 1.结合所学过的盐的化学性质,将下表填写完整。提示:盐与某些金属反应生成另一种金属和另一种盐,属于置换反应。盐与某些酸反应生成另一种盐和另一种酸;盐与某些碱反应生成另一种盐和另一种碱;盐与某些盐反应生成两种新的盐。盐与酸、碱、盐之间的反应属于复分解反应。2.请结合氯化钠溶液与硝酸银溶液反应的微观实质,在方框的圆圈中用离子符号或物质的化学式填写完整。提示:氯化钠溶液与硝酸银溶液反应的实质是溶液中的Cl-与
Ag+结合生成氯化银沉淀,而Na+与 在溶液中不发生改变。
所以右边应填Na+、 及AgCl。
同课章节目录
