二轮物质化学专题练习(浙江省湖州市)
图片预览





文档简介
课件17张PPT。二轮之物质化学专题练习1.颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”。请回答以下问题:
(1)写出生成“纳米铁”的化学方程式_______________。
(2)反应中需要保护气的原因是 。
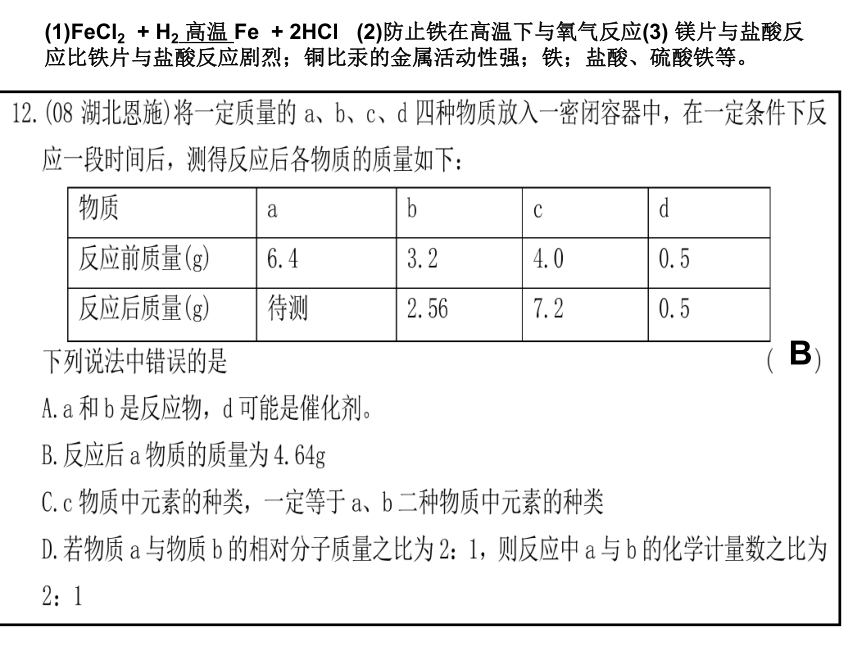
(3)某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和镁片分别加入到溶质质量分数相同的稀盐酸中;②将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;③将金属片A加入到溶液B中。根据实验①判断出镁的金属活动性比铁强,依据的现象是 ;根据实验②的现象得出的结论是 ;要通过实验③得出铁和铜的金属活动性顺序,那么,如果B是硫酸铜溶液,则金属A是 ,如果A是铜,则溶液B是 。(1)FeCl2 + H2 高温 Fe + 2HCl (2)防止铁在高温下与氧气反应(3) 镁片与盐酸反应比铁片与盐酸反应剧烈;铜比汞的金属活动性强;铁;盐酸、硫酸铁等。B3. A、B、C三种物质各15 g,它们化合时只能生成30 g新物质D。若增加10 g A,则反应停止后,原反应物中只余C。根据上述条件推断下列说法中正确的是( )
A.第一次反应停止后,B剩余9 g
B.第二次反应后,D的质量为50 g
C.反应中A和B的质量比是3∶2
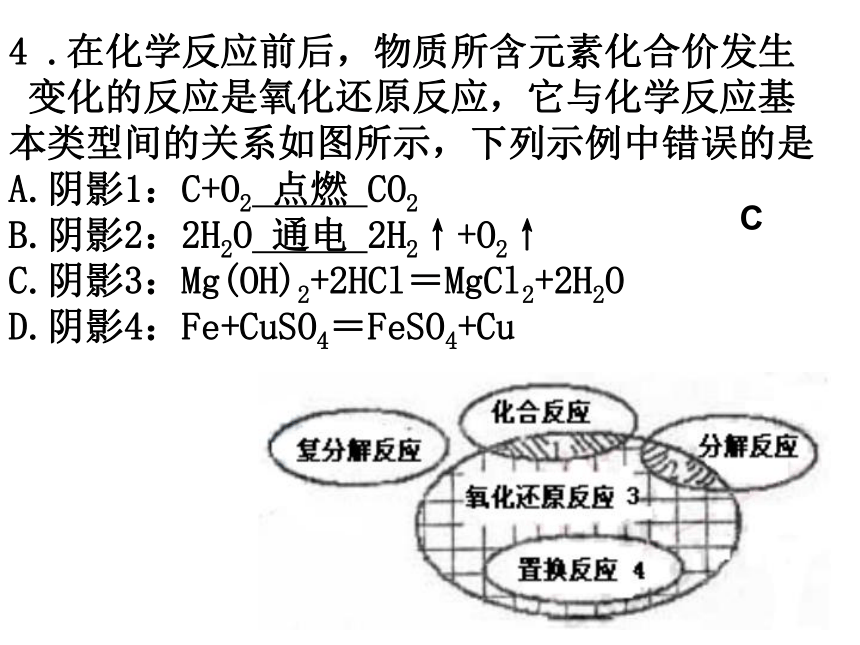
D.反应中A和C的质量比是5∶2D4 .在化学反应前后,物质所含元素化合价发生
变化的反应是氧化还原反应,它与化学反应基
本类型间的关系如图所示,下列示例中错误的是
A.阴影1:C+O2 点燃 CO2
B.阴影2:2H2O 通电 2H2↑+O2↑
C.阴影3:Mg(OH)2+2HCl=MgCl2+2H2O
D.阴影4:Fe+CuSO4=FeSO4+CuC5.阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里 面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0 g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2 g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。求: (1)8.0 g滤渣中Fe和Fe2O3两种物质的总质量。 (2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比。 (3)该“脱氧剂”的变质程度。(1)1.2 g的固体是活性炭。 (1分)
8.0 g滤渣中Fe和Fe2O3两种物质的总质量为8.0 g-1.2 g = 6.8 g (1分)
(2)Fe元素的质量为:8.0 g×70% = 5.6 g
则Fe粉和活性炭的质量之比为5.6∶1.2 = 14∶3 (1分)
(3)由于铁变质而增加的氧元素的质量为:6.8 g-5.6 g = 1.2 g
变质铁的质量为1.2 g ÷ = 2.8 g (1分)
脱氧剂的变质程度=×100% = 50% (1分)6. 下图是一幅贴在汽车加油站上的宣传广告。围绕这幅广告画以下叙述错误的是 ( )
A.玉米汁可用作汽车燃料
B.由玉米生产的酒精汽油可作汽车燃料
C.推广玉米生产的燃料可在一定程度上缓解当前的能源危机
D.以农作物为原料来生产化学品是可行的A7. 目前,科学家提出了一种最经济最理想的获得氢能源的循环体系(如图),下列说法错误的是 ( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.该氢能源的循环体系能够实现太阳能转化为电能
C.在此循环中发生了反应:2H2O 电解 2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂C8.酸雨是天空降水呈酸性(pH小于5.6)的统称,个别地方酸雨的pH竟低于2.1(食醋的pH=3),可见其严重程度.形成酸雨的主要物质是大气中的SO2和氮氧化物。
(1)SO2主要来源是煤和石油的燃烧,全世界每年有1.5亿吨SO2的排放量。SO2在空气中受阳光及尘埃等催化时可被氧化,最终与雨水形成酸雨。试写出这一过程中所发生的两个化学反应方程式: ; 。
(2)酸雨可导致的危害有 (填编号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.影响农作物生长
(3)为了减少酸雨的形成,必须减少SO2的排放量,熟石灰的悬浊液、澄清石灰水、浓NaOH溶液都能吸收废气中的SO2,从净化效果、净化成本等方面综合考虑,你认为用哪一种试剂比较合理?请用简要的文字说明理由。(1)2SO2+O2 光 2SO3;SO3+H2O=H2SO4;(2)ABD(3)熟石灰悬浊液。澄清石灰水中Ca(OH)2的浓度小,吸收SO2的量少且速度慢,效果不佳;浓NaOH溶液清除SO2效果虽好,但其价格高,会导致生产成本的上升。熟石灰悬浊液克服了上述两者的缺点,是一种价廉物美的SO2吸收剂。故选用熟石灰悬浊液比较适宜。8.小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但同学告诉她菠菜不能与豆腐同食。
[发现问题]菠菜为什么不能与豆腐同食?
[查阅资料]a.制作豆腐需要加入石膏(主要成分:CaSO4);b.菠菜中含有草酸、草酸盐等成分;c.草酸钙是一种既不溶于水也不溶于醋酸的白色固体,是诱发人体结石的物质之一。
[提出猜想]菠菜与豆腐同食可能会产生人体不能吸收的沉淀物。
[设计实验][发现新问题]被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:[反思与应用]
(1)家庭中常常将菠菜放在开水中烫过后再烹饪,其目的是 .
(2)联想到人体胃液中含有盐酸,请提出一个你想要探究的关于食用波菜的新问题: .[设计实验]①硫酸钙(或氯化钙等)②草酸钙 ③澄清石灰水[或Ca(OH)2溶液];产生白色沉淀;二氧化碳(或CO2) [反思与应用](1)除去(或减少)菠菜中的草酸、草酸盐等。(2)草酸钙能否溶于盐酸?(或草酸钙在胃部会不会形成结石?)(其他合理答案均可)9.印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是 ( )
A.溶液中一定含FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含FeCl2、CuCl2,固体一定含铜
D.溶液中一定含FeCl2,固体一定是铁和铜B10.某无色混合气体可能含有 CO2、 CO 、H2O(水蒸气) H2中的一种或几种,依次进行如下处理(假设每次处理均完全反应)①通过碱石灰时,气体体积变小。②通过炽热的CuO时, CuO固体变为红色。③通过白色硫酸铜粉末时,粉末变为蓝色。④通过澄清石灰水时溶液变得浑浊。由此可以确定原混合气体中 一定含 可能含有
如果本题中。第一次通过的不是碱石灰,而是炽热的炭,体积没有变化,结果应该是:
一定不含有 。
一定含有 。CO H2 H2O CO2中的一种或两种CO2、 H2OCO H2 11.下面检验气体的实验方法:
① 只用燃着的木条检验
② 只用澄清的石灰水检验
③ 只用紫色石蕊试液检验
④ 只用氯化钡溶液检验
⑤ 只用氢氧化钡溶液检验
⑥ 只用盐酸检验。
其中能区别氧气与二氧化碳两种无色气体的方法是 ( )1235 5.85克 氯化钠样品(其中混有少量下列某种盐)
当它与足量硝酸银溶液充分反应后,得到白色沉淀氯
化银14.5克。则可能混入的盐是 ( )
A。氯化钾 B。氯化钙 C。氯化钡 D。 氯化铜B13. 如图所示,X为一种纯净的气体,玻璃管A中的??勰┪?趸??蚰咎炕蛄秸叩幕旌衔铮ǜ?菪枰?尤?
时可用酒精灯):
①若A中黑色粉末为氧化铜,实验过程中,黑色粉末变红,B中物质无变化。则X为 ,C 中产生的现象是 。
②若X为二氧化碳,在出口处可导出可燃性气体,C中可能出现
现象。这是因为 ,
。
③若B中的白色粉末变蓝色,C中出现白色沉淀。则X为 ,
A中的黑色粉末为 。CO变浑浊变浑浊CO2与碳反应变成COCO2与澄清石灰水反应,生成碳酸钙H2氧化铜和炭无水硫酸铜澄清石灰水
(1)写出生成“纳米铁”的化学方程式_______________。
(2)反应中需要保护气的原因是 。
(3)某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和镁片分别加入到溶质质量分数相同的稀盐酸中;②将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;③将金属片A加入到溶液B中。根据实验①判断出镁的金属活动性比铁强,依据的现象是 ;根据实验②的现象得出的结论是 ;要通过实验③得出铁和铜的金属活动性顺序,那么,如果B是硫酸铜溶液,则金属A是 ,如果A是铜,则溶液B是 。(1)FeCl2 + H2 高温 Fe + 2HCl (2)防止铁在高温下与氧气反应(3) 镁片与盐酸反应比铁片与盐酸反应剧烈;铜比汞的金属活动性强;铁;盐酸、硫酸铁等。B3. A、B、C三种物质各15 g,它们化合时只能生成30 g新物质D。若增加10 g A,则反应停止后,原反应物中只余C。根据上述条件推断下列说法中正确的是( )
A.第一次反应停止后,B剩余9 g
B.第二次反应后,D的质量为50 g
C.反应中A和B的质量比是3∶2
D.反应中A和C的质量比是5∶2D4 .在化学反应前后,物质所含元素化合价发生
变化的反应是氧化还原反应,它与化学反应基
本类型间的关系如图所示,下列示例中错误的是
A.阴影1:C+O2 点燃 CO2
B.阴影2:2H2O 通电 2H2↑+O2↑
C.阴影3:Mg(OH)2+2HCl=MgCl2+2H2O
D.阴影4:Fe+CuSO4=FeSO4+CuC5.阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里 面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0 g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2 g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。求: (1)8.0 g滤渣中Fe和Fe2O3两种物质的总质量。 (2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比。 (3)该“脱氧剂”的变质程度。(1)1.2 g的固体是活性炭。 (1分)
8.0 g滤渣中Fe和Fe2O3两种物质的总质量为8.0 g-1.2 g = 6.8 g (1分)
(2)Fe元素的质量为:8.0 g×70% = 5.6 g
则Fe粉和活性炭的质量之比为5.6∶1.2 = 14∶3 (1分)
(3)由于铁变质而增加的氧元素的质量为:6.8 g-5.6 g = 1.2 g
变质铁的质量为1.2 g ÷ = 2.8 g (1分)
脱氧剂的变质程度=×100% = 50% (1分)6. 下图是一幅贴在汽车加油站上的宣传广告。围绕这幅广告画以下叙述错误的是 ( )
A.玉米汁可用作汽车燃料
B.由玉米生产的酒精汽油可作汽车燃料
C.推广玉米生产的燃料可在一定程度上缓解当前的能源危机
D.以农作物为原料来生产化学品是可行的A7. 目前,科学家提出了一种最经济最理想的获得氢能源的循环体系(如图),下列说法错误的是 ( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.该氢能源的循环体系能够实现太阳能转化为电能
C.在此循环中发生了反应:2H2O 电解 2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂C8.酸雨是天空降水呈酸性(pH小于5.6)的统称,个别地方酸雨的pH竟低于2.1(食醋的pH=3),可见其严重程度.形成酸雨的主要物质是大气中的SO2和氮氧化物。
(1)SO2主要来源是煤和石油的燃烧,全世界每年有1.5亿吨SO2的排放量。SO2在空气中受阳光及尘埃等催化时可被氧化,最终与雨水形成酸雨。试写出这一过程中所发生的两个化学反应方程式: ; 。
(2)酸雨可导致的危害有 (填编号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.影响农作物生长
(3)为了减少酸雨的形成,必须减少SO2的排放量,熟石灰的悬浊液、澄清石灰水、浓NaOH溶液都能吸收废气中的SO2,从净化效果、净化成本等方面综合考虑,你认为用哪一种试剂比较合理?请用简要的文字说明理由。(1)2SO2+O2 光 2SO3;SO3+H2O=H2SO4;(2)ABD(3)熟石灰悬浊液。澄清石灰水中Ca(OH)2的浓度小,吸收SO2的量少且速度慢,效果不佳;浓NaOH溶液清除SO2效果虽好,但其价格高,会导致生产成本的上升。熟石灰悬浊液克服了上述两者的缺点,是一种价廉物美的SO2吸收剂。故选用熟石灰悬浊液比较适宜。8.小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但同学告诉她菠菜不能与豆腐同食。
[发现问题]菠菜为什么不能与豆腐同食?
[查阅资料]a.制作豆腐需要加入石膏(主要成分:CaSO4);b.菠菜中含有草酸、草酸盐等成分;c.草酸钙是一种既不溶于水也不溶于醋酸的白色固体,是诱发人体结石的物质之一。
[提出猜想]菠菜与豆腐同食可能会产生人体不能吸收的沉淀物。
[设计实验][发现新问题]被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:[反思与应用]
(1)家庭中常常将菠菜放在开水中烫过后再烹饪,其目的是 .
(2)联想到人体胃液中含有盐酸,请提出一个你想要探究的关于食用波菜的新问题: .[设计实验]①硫酸钙(或氯化钙等)②草酸钙 ③澄清石灰水[或Ca(OH)2溶液];产生白色沉淀;二氧化碳(或CO2) [反思与应用](1)除去(或减少)菠菜中的草酸、草酸盐等。(2)草酸钙能否溶于盐酸?(或草酸钙在胃部会不会形成结石?)(其他合理答案均可)9.印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是 ( )
A.溶液中一定含FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含FeCl2、CuCl2,固体一定含铜
D.溶液中一定含FeCl2,固体一定是铁和铜B10.某无色混合气体可能含有 CO2、 CO 、H2O(水蒸气) H2中的一种或几种,依次进行如下处理(假设每次处理均完全反应)①通过碱石灰时,气体体积变小。②通过炽热的CuO时, CuO固体变为红色。③通过白色硫酸铜粉末时,粉末变为蓝色。④通过澄清石灰水时溶液变得浑浊。由此可以确定原混合气体中 一定含 可能含有
如果本题中。第一次通过的不是碱石灰,而是炽热的炭,体积没有变化,结果应该是:
一定不含有 。
一定含有 。CO H2 H2O CO2中的一种或两种CO2、 H2OCO H2 11.下面检验气体的实验方法:
① 只用燃着的木条检验
② 只用澄清的石灰水检验
③ 只用紫色石蕊试液检验
④ 只用氯化钡溶液检验
⑤ 只用氢氧化钡溶液检验
⑥ 只用盐酸检验。
其中能区别氧气与二氧化碳两种无色气体的方法是 ( )1235 5.85克 氯化钠样品(其中混有少量下列某种盐)
当它与足量硝酸银溶液充分反应后,得到白色沉淀氯
化银14.5克。则可能混入的盐是 ( )
A。氯化钾 B。氯化钙 C。氯化钡 D。 氯化铜B13. 如图所示,X为一种纯净的气体,玻璃管A中的??勰┪?趸??蚰咎炕蛄秸叩幕旌衔铮ǜ?菪枰?尤?
时可用酒精灯):
①若A中黑色粉末为氧化铜,实验过程中,黑色粉末变红,B中物质无变化。则X为 ,C 中产生的现象是 。
②若X为二氧化碳,在出口处可导出可燃性气体,C中可能出现
现象。这是因为 ,
。
③若B中的白色粉末变蓝色,C中出现白色沉淀。则X为 ,
A中的黑色粉末为 。CO变浑浊变浑浊CO2与碳反应变成COCO2与澄清石灰水反应,生成碳酸钙H2氧化铜和炭无水硫酸铜澄清石灰水
