质量守恒定律及其应用(浙江省衢州市江山市)
文档属性
| 名称 | 质量守恒定律及其应用(浙江省衢州市江山市) |  | |
| 格式 | rar | ||
| 文件大小 | 21.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2009-06-04 11:04:00 | ||
图片预览







文档简介
课件20张PPT。质量守恒定律及其应用质量守恒定律:
在化学反应中参加反应的各物质质量总和 等于反应后生成的各物质的质量总和从微观方面分析在化学反应中“质量守恒”的原因:
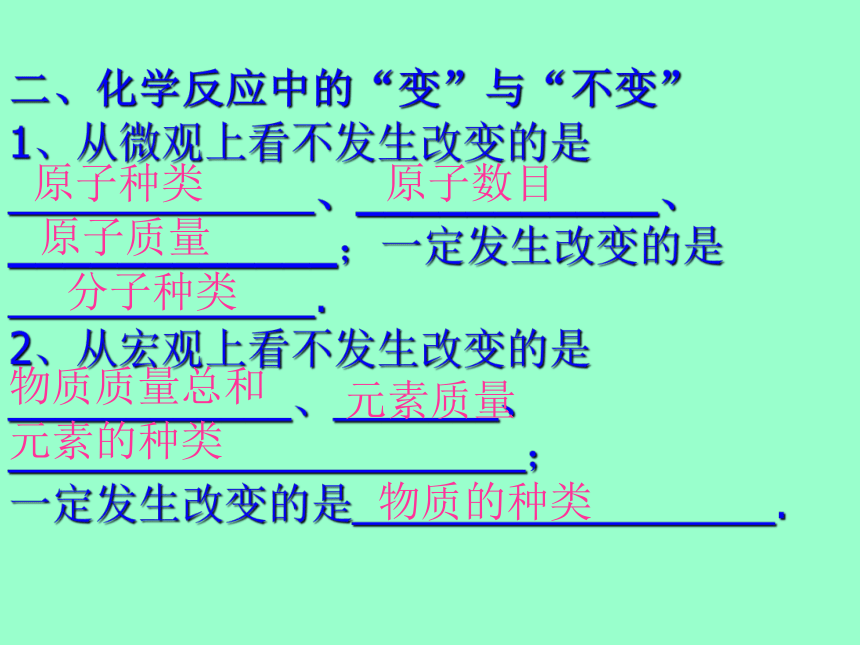
在化学反应前后原子种类没有改变、原子数目没有增减,原子质量没有改变。一、质量守恒定律的内容二、化学反应中的“变”与“不变”
1、从微观上看不发生改变的是_____________、___________、____________;一定发生改变的是_____________.
2、从宏观上看不发生改变的是____________、_______、
______________________;
一定发生改变的是__________________.原子种类原子数目原子质量分子种类物质质量总和元素的种类物质的种类元素质量三、质量守恒定律的应用简单计算例1、在化学反应A +B = C+D 中,10克A物质恰好与8克B物质完全反应,同时生成2克D,则生成C物质的质量为 克
(化学反应前后物质的总质量守恒)在密闭的容器中有A、B、C、D四种物质,对其加热后发生了化学反应,反应前后四种物质的质量数据如下表格,
则表格中m的数值是 。美国PPG公司生产的“自净玻璃”的神奇之处全在于它穿上40纳米厚的二氧化钛(TiO2)“纳米膜外套”。其“纳米膜外套”可与太阳光线中的紫外线作用,分解落在玻璃上的有机物,使有机物化为乌有;还能使玻璃表面的雨点或雾气变成一个薄层而使玻璃表面湿润,并 洗掉表面的脏物。工业上二氧化钛可用下列方法制得:
2FeTiO3+7Cl2+3C=2X+2FeCl3+3CO2,
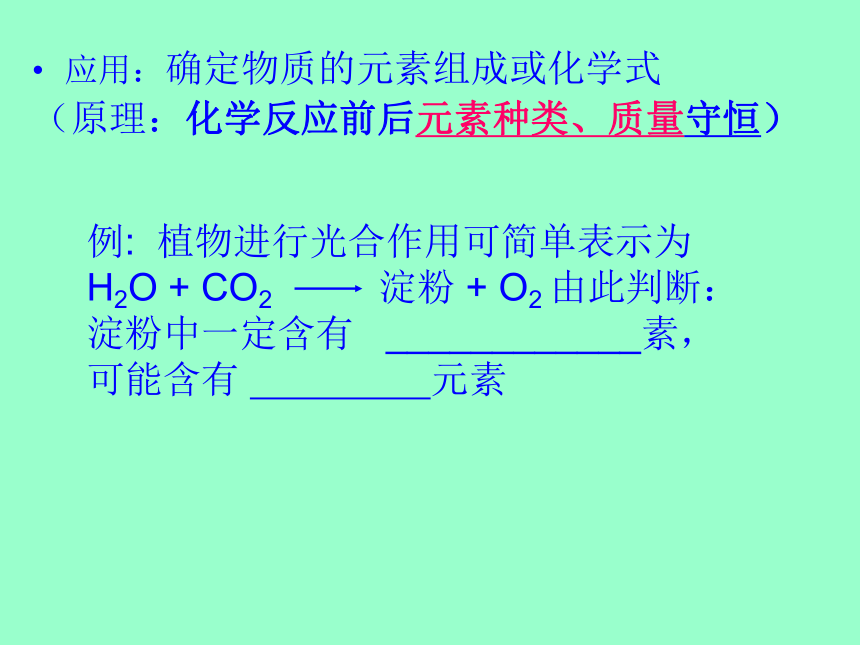
X+O2=TiO2+2Cl2,则X的化学式为 。 简单计算(利用化学反应前后原子的种类和数量不变)应用:确定物质的元素组成或化学式
(原理:化学反应前后元素种类、质量守恒)例: 植物进行光合作用可简单表示为
H2O + CO2 淀粉 + O2 由此判断:淀粉中一定含有 ____________素,
可能含有 元素例:用含铁40%铁矿石1000吨炼铁,可得到含杂质3%的生铁多少吨?应用:化学方程式原理:质量守恒定律书写化学方程式的步骤:
1:写出反应物和生成物
2:配平化学方程式
3:标出反应条件和气体、沉淀符号
4:划上等号用奇偶法配平化学方程式例:汽车尾气中含有N0和C0,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成N2和C02,该反应的化学方程式为_________________________。 写出甲烷燃烧的化学方程式关于化学方程式的计算化学方程式:2H2+O2===2H2O给我们提供了哪些重要信息?点燃1、反应物是氢气和氧气、生成物是水
2、反应条件是点燃
3、氢气、氧气和水的分子个数比为2:1:2
4、氢气、氧气和水的的质量比为 4:32:36化学方程式计算的依据:各个反应物和生成物的质量比是确定的。只要找到一种物质的质量,就可按比例算出其它物质的质量。例:加热分解5.8克氯酸钾,可得到多少克的氧气?注意事项:
1、代入计算的数据必须是实际参与反应的物质或生成的物质的质量
2、代入计算的数据必须是纯净物的质量(混合物或溶液的质量不能代入计算)例1、我国约在南北朝时就开始炼制黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品,为了测定某黄铜中铜的质量分数,取10克黄铜加入到50克稀硫酸中,恰好完全反应,产生氢气0.1g,试求:
⑴该黄铜样品中铜的质量分数;
⑵原稀硫酸溶液中溶质的质量分数 例2、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?例3:要冶炼出含杂质3%的生铁
600吨,须要含(Fe2O3)的80%
铁矿石多少吨?战术归纳:含杂质的物质,要先计算出其中纯净物的质量,才能代入计算例4: 有金属Cu和CuO的混合物共6g,用H2完全还原后,得到Cu共5.2g,则原混合物中Cu的质量分数为多少?例5:10克重的铁条放入硫酸铜溶液中,过一会取出,洗涤干燥后称得其质量为10.8克,求有多少克铁被反应掉了?例6:取22.2g石灰石样品,放入盛有126g稀盐酸的烧杯中,恰好完全反应(杂质不反应,也不溶于水),此时烧杯内物质的质量为139.4g 1.生产二氧化碳的质量为多少克? 2.反应后所得溶液中溶质的质量分数是多少? 战术归纳:如所有的数据都不能代入计算,则分析反应前后物质的质量变化值,往往有玄机例7、某学校的兴趣小组为了测定某一不纯碳酸钠样品(其中杂质不溶于水,也不与其它物质发生化学反应)中碳酸钠的含量,将样品放入稀盐酸中进行反应,关系如表中所示:
求:⑴该样品中碳酸钠的质量分数。⑵原稀盐酸的溶质质量分数。⑶若将4克样品溶于水形成50克溶液后,用于150克石灰水恰好使之完全反应。例8、某石灰厂有一批石灰石原料,其中含有杂质 (杂质不溶于水,不能与盐酸反应)。为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表。
请认真分析表中数据,结合图象信息,计算:
(1)该石灰石样品的纯度;
(2)所用稀盐酸的溶质质量分数。36.向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。 据图回答:
(1)整个反应过程中, 离子个数不变。
(2)P点溶液中的溶质是 。
(3)M点溶液中的溶质质量分数是多少?
(4)m1的值是多少?战术归纳:要善于从图表中分析出计算所需的数据
在化学反应中参加反应的各物质质量总和 等于反应后生成的各物质的质量总和从微观方面分析在化学反应中“质量守恒”的原因:
在化学反应前后原子种类没有改变、原子数目没有增减,原子质量没有改变。一、质量守恒定律的内容二、化学反应中的“变”与“不变”
1、从微观上看不发生改变的是_____________、___________、____________;一定发生改变的是_____________.
2、从宏观上看不发生改变的是____________、_______、
______________________;
一定发生改变的是__________________.原子种类原子数目原子质量分子种类物质质量总和元素的种类物质的种类元素质量三、质量守恒定律的应用简单计算例1、在化学反应A +B = C+D 中,10克A物质恰好与8克B物质完全反应,同时生成2克D,则生成C物质的质量为 克
(化学反应前后物质的总质量守恒)在密闭的容器中有A、B、C、D四种物质,对其加热后发生了化学反应,反应前后四种物质的质量数据如下表格,
则表格中m的数值是 。美国PPG公司生产的“自净玻璃”的神奇之处全在于它穿上40纳米厚的二氧化钛(TiO2)“纳米膜外套”。其“纳米膜外套”可与太阳光线中的紫外线作用,分解落在玻璃上的有机物,使有机物化为乌有;还能使玻璃表面的雨点或雾气变成一个薄层而使玻璃表面湿润,并 洗掉表面的脏物。工业上二氧化钛可用下列方法制得:
2FeTiO3+7Cl2+3C=2X+2FeCl3+3CO2,
X+O2=TiO2+2Cl2,则X的化学式为 。 简单计算(利用化学反应前后原子的种类和数量不变)应用:确定物质的元素组成或化学式
(原理:化学反应前后元素种类、质量守恒)例: 植物进行光合作用可简单表示为
H2O + CO2 淀粉 + O2 由此判断:淀粉中一定含有 ____________素,
可能含有 元素例:用含铁40%铁矿石1000吨炼铁,可得到含杂质3%的生铁多少吨?应用:化学方程式原理:质量守恒定律书写化学方程式的步骤:
1:写出反应物和生成物
2:配平化学方程式
3:标出反应条件和气体、沉淀符号
4:划上等号用奇偶法配平化学方程式例:汽车尾气中含有N0和C0,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成N2和C02,该反应的化学方程式为_________________________。 写出甲烷燃烧的化学方程式关于化学方程式的计算化学方程式:2H2+O2===2H2O给我们提供了哪些重要信息?点燃1、反应物是氢气和氧气、生成物是水
2、反应条件是点燃
3、氢气、氧气和水的分子个数比为2:1:2
4、氢气、氧气和水的的质量比为 4:32:36化学方程式计算的依据:各个反应物和生成物的质量比是确定的。只要找到一种物质的质量,就可按比例算出其它物质的质量。例:加热分解5.8克氯酸钾,可得到多少克的氧气?注意事项:
1、代入计算的数据必须是实际参与反应的物质或生成的物质的质量
2、代入计算的数据必须是纯净物的质量(混合物或溶液的质量不能代入计算)例1、我国约在南北朝时就开始炼制黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品,为了测定某黄铜中铜的质量分数,取10克黄铜加入到50克稀硫酸中,恰好完全反应,产生氢气0.1g,试求:
⑴该黄铜样品中铜的质量分数;
⑵原稀硫酸溶液中溶质的质量分数 例2、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?例3:要冶炼出含杂质3%的生铁
600吨,须要含(Fe2O3)的80%
铁矿石多少吨?战术归纳:含杂质的物质,要先计算出其中纯净物的质量,才能代入计算例4: 有金属Cu和CuO的混合物共6g,用H2完全还原后,得到Cu共5.2g,则原混合物中Cu的质量分数为多少?例5:10克重的铁条放入硫酸铜溶液中,过一会取出,洗涤干燥后称得其质量为10.8克,求有多少克铁被反应掉了?例6:取22.2g石灰石样品,放入盛有126g稀盐酸的烧杯中,恰好完全反应(杂质不反应,也不溶于水),此时烧杯内物质的质量为139.4g 1.生产二氧化碳的质量为多少克? 2.反应后所得溶液中溶质的质量分数是多少? 战术归纳:如所有的数据都不能代入计算,则分析反应前后物质的质量变化值,往往有玄机例7、某学校的兴趣小组为了测定某一不纯碳酸钠样品(其中杂质不溶于水,也不与其它物质发生化学反应)中碳酸钠的含量,将样品放入稀盐酸中进行反应,关系如表中所示:
求:⑴该样品中碳酸钠的质量分数。⑵原稀盐酸的溶质质量分数。⑶若将4克样品溶于水形成50克溶液后,用于150克石灰水恰好使之完全反应。例8、某石灰厂有一批石灰石原料,其中含有杂质 (杂质不溶于水,不能与盐酸反应)。为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表。
请认真分析表中数据,结合图象信息,计算:
(1)该石灰石样品的纯度;
(2)所用稀盐酸的溶质质量分数。36.向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。 据图回答:
(1)整个反应过程中, 离子个数不变。
(2)P点溶液中的溶质是 。
(3)M点溶液中的溶质质量分数是多少?
(4)m1的值是多少?战术归纳:要善于从图表中分析出计算所需的数据
