鲁教版化学九年级下册第三节 海水“制碱”课件(32张ppt)
文档属性
| 名称 | 鲁教版化学九年级下册第三节 海水“制碱”课件(32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 994.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-24 00:00:00 | ||
图片预览










文档简介
课件32张PPT。第三节 海水“制碱”西藏碱湖天然碱 1.了解氨碱法制纯碱的原理和步骤。
2 .知道氨碱法制纯碱的化学反应原理。
?3 .了解纯碱在日常生活和工农业生产中
的应用。
?4 .学会知识的总结,培养解决问题的能
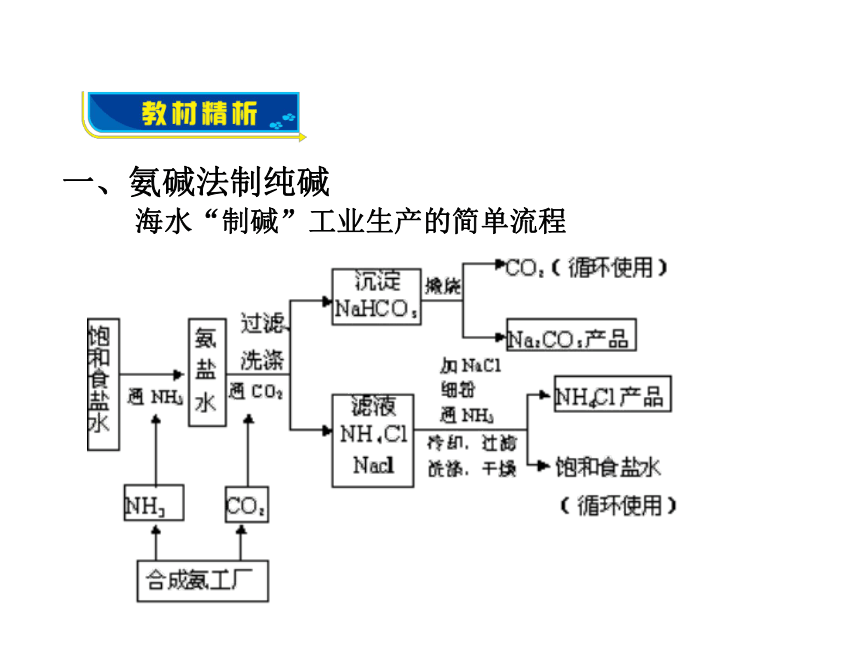
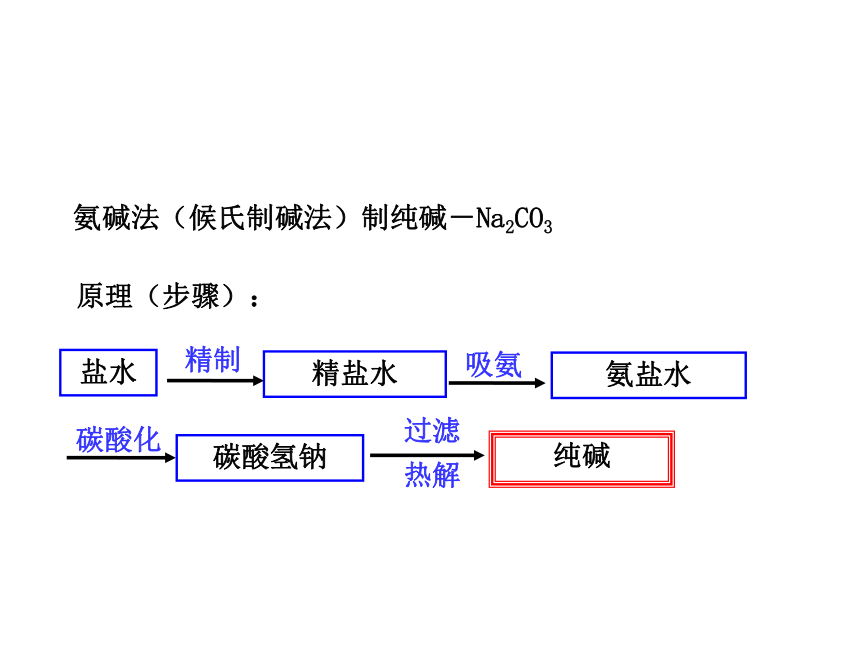
力、信息获取能力。 纯碱工业始创于18世纪,在很长一段时间内制碱技术把持在英、法、德、美等西方发达国家手中。1921年正在美国留学的侯德榜先生为了发展我国的民族工业,应爱国实业家范旭东先生之邀毅然回国,潜心研究制碱技术,成功地摸索和改进了西方的制碱方法,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献。侯德榜红三角牌纯碱 永利化工厂 海水“制碱”工业生产的简单流程 一、氨碱法制纯碱氨碱法(候氏制碱法)制纯碱-Na2CO3 原理(步骤): 盐水精盐水精制吸氨碳酸化碳酸氢钠纯碱过滤
热解氨盐水(1)先向饱和食盐水中通入NH3; (2)再通入足量CO2: 1.为什么氨盐水比食盐水更易吸收二氧化碳?
氨水显碱性、二氧化碳溶于水生成碳酸,两者
之间能发生中和反应。 NaCl、NaHCO3、NH4Cl和NH4HCO3同时存在于水溶液中。这四种物质在室温条件下, NaHCO3的溶解度最小,因此先析出晶体。2.氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,
哪种物质首先结晶析出?为什么?碳酸钠、碳酸氢钠
1.碳酸钠(化学式):
俗名:
物理性质:
用途: 纯碱、苏打白色粉末状固体,易溶于水,其水溶液呈碱性。纯碱不是碱,是盐。Na2CO3玻璃纤维工业纯碱(Na2CO3)主要用于玻璃、化工、冶金、造纸、印染、合成洗涤剂、石油化工等工业。
食用纯碱(Na2CO3)主要用于食品工业。2.碳酸氢钠(化学式):
俗名:
物理性质:
用途:
化学性质:NaHCO3白色粉末状固体,易溶于水,其水溶液呈碱性。作食品添加剂、治疗胃酸过多、用作灭火剂等。小苏打 实验:用试管取适量的碳酸钠溶液,向试管中滴加酚酞试液。
现象:_________________。
可见,碳酸钠 (难、易)溶于水,溶液呈 性。 溶液颜色变红碱1.与指示剂的作用易二、纯碱的性质2.与盐酸和稀硫酸的反应 3.与氢氧化钙的反应 4.与氯化钡的反应 思考:如何鉴别碳酸根离子 取样品于试管中,滴加稀盐酸,可观察到有气泡产生,将产生的气体通入澄清的石灰水中,若石灰水变浑浊,则样品中有碳酸根离子或碳酸氢根离子。盐的溶解性口诀:
钾、钠、铵、硝酸盐全都溶;氯化物中银不溶,
硫酸盐中钡不溶,硫酸钙、银是微溶;碳酸盐只溶钾、钠、铵。这些你都记住了吗?说明:1.钾、钠、铵、硝酸盐都可溶。
2.盐酸盐只有氯化银不溶。
3.硫酸盐只有硫酸钡不溶。
4.碳酸盐只溶钾、钠、铵,碳酸镁微溶,
剩下都不溶。5.酸都溶
6.可溶性溶碱有五位:钾、钠、铵、钙、钡。复分解反应的实质H2CO3复分解反应1.概念:
2.字母表达式:3.酸、碱、盐之间发生的反应为复分解反应,这一类的反应有一个非常重要的特点:由两种化合物互相交换成分,生成另外两种化合物的反应。反应前后各元素的化合价保持不变。4.酸、碱、盐之间在水溶液中发生的反应为复分解反应的实质: 酸、碱、盐所电离出的离子相互结合生成沉淀、气体或水的
过程。
5.复分解反应发生的条件:须二者都可溶有沉淀生成
或有气体放出
或有水生成碱 + 盐盐 + 盐盐 + 酸酸 + 碱酸+金属氧化物1.判断下列反应能否进行: AgNO3 + FeCl3
AgCl + NaNO3
CaCO3 + NaOH
Na2SO4 + HCl
Fe(OH)3 + H2SO433 AgCl +Fe (NO3)3不反应,盐和盐反应时须均可溶不反应,碱和盐反应时须均可溶生成物中无气体、沉淀或水Fe2(SO4)3 + H2O3622.除去下列物质中的少量杂质(1)Na2CO3固体中混有NaHCO3,方法是加热, 反应的化学方程是 。 (2)NaCl溶液中混有Na2CO3,方法是滴加适量稀盐酸,反应的化学方程式是 。(3)妈妈在洗碗筷时,经常在水中加入一种物质,很快就能将“油乎乎”的菜盘洗得干干净净。妈妈在水中加入的物质可能是( )
A.汽油 B.烧碱 C.纯碱 D.食盐水C4.A是一种白色难溶于水的钙盐,由三种元素组成,其相对分子质量为100。(1)用化学式表示:A ________,B ________
(2)写出A与盐酸反应的化学方程式:
______________________________________
(3)D中一定含有的溶质是 ,
可能含有的溶质是 。CaCO3CO2CaOCaCO3Na2CO3或Ca(OH)2NaOHCaCO3CaO(4)为进一步确定D溶液中可能存在的组成,还需设计实验并填写下表:(可不填满,也可补充)Na2CO3Ca(OH)2稀盐酸碳酸钠溶液若有气泡产生,D溶液中存在Na2CO3若溶液变浑浊,D溶液中存在Ca(OH)2若上述两实验均无明显现象,Na2CO3和Ca(OH)2都不存在分别进行上述两实验Na2CO3和Ca(OH)2都不存在5.已知可溶性钡盐有毒,而在医院里做胃镜透视时,要用BaSO4造影,俗称“钡餐”,吃下BaSO4无毒是因为( )。但如果无意中误服了BaCO3则会引起中毒,这是因为(用化学方程式表示,下同)( ),误服后, 应立即用泻盐MgSO4解毒,这是因为( )。BaSO4不溶于水,也不与酸反应常见盐的保健功能
1.高锰酸钾(又称PP粉):具有强氧化性,能杀死病菌,常用以消毒。其中,它的深紫色溶液(约0.3%~0.5%)杀菌力最强,多用于浴缸、便具、痰盂的消毒;紫红色溶液(约0.05%)可用以清洗伤口,浸洗足癣,也可用以对瓜果、蔬菜及餐具的消毒;浅红色溶液(0.01%以下)可用以漱口,有除臭消炎防龋作用。2.硫酸亚铁:亚铁离子是血红蛋白的重要成分,硫酸亚铁可用于治疗缺铁性贫血。许多补血糖浆中均含有硫酸亚铁。
3.氯化钙:人体内的钙,是保证骨骼硬度、促进骨骼生长的主要成分。口服或注射氯化钙,可防治佝偻病、软骨病。与维生素D合用能更好地促进钙的吸收和储存。4.氯化铁:手指一旦被划破后常会血流不止,若将氯化铁粉末撒入伤口,很快就能使流血凝固,且无痛感。原因在于它是一种重金属盐,能使血红蛋白变性。
5.硫酸锌:锌是人体内重要的微量元素,与生物体内七十多种酶的功能活性密切相关。锌摄取不足时,会产生体、智发育障碍、胃肠功能紊乱、偏头痛、夜盲、异食癖等。服用硫酸锌糖浆或片剂即可快速补充体内的锌元素。6.碳酸钙:是自然界中大理石、石灰石、白垩的主要成分,实验室常用它做制取二氧化碳的原料:
CaCO3+2HCl CaCl2+H2O+CO2↑
碳酸钙除了可做补钙剂,还是牙膏内的摩擦剂,通常由纯碱和熟石灰反应制得,反应的化学方程式为
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH。 汉白玉7.亚硝酸钠(NaNO2) ——小心亚硝酸钠成为“杀手”
亚硝酸钠亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。是致癌物质,其不仅存在于午餐肉中,在香肠、火腿等一些腌腊制品中都非常常见(主要作为一种增色剂、防腐剂使用,使肉颜色红润);尤其是煮过的剩菜中也存有亚硝酸钠。虽然亚硝酸钠是剧毒物质,但只要严格控制其食用量,对人体不会产生太大危害。 人体不能摄入过量的亚硝酸钠,否则0.3克~
0.5克便能中毒,3克便能致死。中毒后症状为心率加速,嗜睡,烦躁不安,呼吸急促,恶心呕吐,腹痛腹泻等,重者甚至昏迷、昏厥,常死于呼吸衰竭。 ???专家提醒,为避免亚硝酸钠对人体的危害,
平时要尽量少吃含有亚硝酸钠的食物。8.硫酸钡
天然BaSO4又称重晶石,由于其中含有CaCO3等杂质.天然BaSO4用于生产涂料或高级纸张,可用作白色颜料 ,并可作为油漆,油墨,塑料,橡胶的原料及填充剂。化工领域用它生产BaCl2及其他含钡化合物。
沉淀BaSO4较为纯净,在医学上,主要用作检查肠胃的内服药剂,进行钡餐透视。重晶石
2 .知道氨碱法制纯碱的化学反应原理。
?3 .了解纯碱在日常生活和工农业生产中
的应用。
?4 .学会知识的总结,培养解决问题的能
力、信息获取能力。 纯碱工业始创于18世纪,在很长一段时间内制碱技术把持在英、法、德、美等西方发达国家手中。1921年正在美国留学的侯德榜先生为了发展我国的民族工业,应爱国实业家范旭东先生之邀毅然回国,潜心研究制碱技术,成功地摸索和改进了西方的制碱方法,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献。侯德榜红三角牌纯碱 永利化工厂 海水“制碱”工业生产的简单流程 一、氨碱法制纯碱氨碱法(候氏制碱法)制纯碱-Na2CO3 原理(步骤): 盐水精盐水精制吸氨碳酸化碳酸氢钠纯碱过滤
热解氨盐水(1)先向饱和食盐水中通入NH3; (2)再通入足量CO2: 1.为什么氨盐水比食盐水更易吸收二氧化碳?
氨水显碱性、二氧化碳溶于水生成碳酸,两者
之间能发生中和反应。 NaCl、NaHCO3、NH4Cl和NH4HCO3同时存在于水溶液中。这四种物质在室温条件下, NaHCO3的溶解度最小,因此先析出晶体。2.氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,
哪种物质首先结晶析出?为什么?碳酸钠、碳酸氢钠
1.碳酸钠(化学式):
俗名:
物理性质:
用途: 纯碱、苏打白色粉末状固体,易溶于水,其水溶液呈碱性。纯碱不是碱,是盐。Na2CO3玻璃纤维工业纯碱(Na2CO3)主要用于玻璃、化工、冶金、造纸、印染、合成洗涤剂、石油化工等工业。
食用纯碱(Na2CO3)主要用于食品工业。2.碳酸氢钠(化学式):
俗名:
物理性质:
用途:
化学性质:NaHCO3白色粉末状固体,易溶于水,其水溶液呈碱性。作食品添加剂、治疗胃酸过多、用作灭火剂等。小苏打 实验:用试管取适量的碳酸钠溶液,向试管中滴加酚酞试液。
现象:_________________。
可见,碳酸钠 (难、易)溶于水,溶液呈 性。 溶液颜色变红碱1.与指示剂的作用易二、纯碱的性质2.与盐酸和稀硫酸的反应 3.与氢氧化钙的反应 4.与氯化钡的反应 思考:如何鉴别碳酸根离子 取样品于试管中,滴加稀盐酸,可观察到有气泡产生,将产生的气体通入澄清的石灰水中,若石灰水变浑浊,则样品中有碳酸根离子或碳酸氢根离子。盐的溶解性口诀:
钾、钠、铵、硝酸盐全都溶;氯化物中银不溶,
硫酸盐中钡不溶,硫酸钙、银是微溶;碳酸盐只溶钾、钠、铵。这些你都记住了吗?说明:1.钾、钠、铵、硝酸盐都可溶。
2.盐酸盐只有氯化银不溶。
3.硫酸盐只有硫酸钡不溶。
4.碳酸盐只溶钾、钠、铵,碳酸镁微溶,
剩下都不溶。5.酸都溶
6.可溶性溶碱有五位:钾、钠、铵、钙、钡。复分解反应的实质H2CO3复分解反应1.概念:
2.字母表达式:3.酸、碱、盐之间发生的反应为复分解反应,这一类的反应有一个非常重要的特点:由两种化合物互相交换成分,生成另外两种化合物的反应。反应前后各元素的化合价保持不变。4.酸、碱、盐之间在水溶液中发生的反应为复分解反应的实质: 酸、碱、盐所电离出的离子相互结合生成沉淀、气体或水的
过程。
5.复分解反应发生的条件:须二者都可溶有沉淀生成
或有气体放出
或有水生成碱 + 盐盐 + 盐盐 + 酸酸 + 碱酸+金属氧化物1.判断下列反应能否进行: AgNO3 + FeCl3
AgCl + NaNO3
CaCO3 + NaOH
Na2SO4 + HCl
Fe(OH)3 + H2SO433 AgCl +Fe (NO3)3不反应,盐和盐反应时须均可溶不反应,碱和盐反应时须均可溶生成物中无气体、沉淀或水Fe2(SO4)3 + H2O3622.除去下列物质中的少量杂质(1)Na2CO3固体中混有NaHCO3,方法是加热, 反应的化学方程是 。 (2)NaCl溶液中混有Na2CO3,方法是滴加适量稀盐酸,反应的化学方程式是 。(3)妈妈在洗碗筷时,经常在水中加入一种物质,很快就能将“油乎乎”的菜盘洗得干干净净。妈妈在水中加入的物质可能是( )
A.汽油 B.烧碱 C.纯碱 D.食盐水C4.A是一种白色难溶于水的钙盐,由三种元素组成,其相对分子质量为100。(1)用化学式表示:A ________,B ________
(2)写出A与盐酸反应的化学方程式:
______________________________________
(3)D中一定含有的溶质是 ,
可能含有的溶质是 。CaCO3CO2CaOCaCO3Na2CO3或Ca(OH)2NaOHCaCO3CaO(4)为进一步确定D溶液中可能存在的组成,还需设计实验并填写下表:(可不填满,也可补充)Na2CO3Ca(OH)2稀盐酸碳酸钠溶液若有气泡产生,D溶液中存在Na2CO3若溶液变浑浊,D溶液中存在Ca(OH)2若上述两实验均无明显现象,Na2CO3和Ca(OH)2都不存在分别进行上述两实验Na2CO3和Ca(OH)2都不存在5.已知可溶性钡盐有毒,而在医院里做胃镜透视时,要用BaSO4造影,俗称“钡餐”,吃下BaSO4无毒是因为( )。但如果无意中误服了BaCO3则会引起中毒,这是因为(用化学方程式表示,下同)( ),误服后, 应立即用泻盐MgSO4解毒,这是因为( )。BaSO4不溶于水,也不与酸反应常见盐的保健功能
1.高锰酸钾(又称PP粉):具有强氧化性,能杀死病菌,常用以消毒。其中,它的深紫色溶液(约0.3%~0.5%)杀菌力最强,多用于浴缸、便具、痰盂的消毒;紫红色溶液(约0.05%)可用以清洗伤口,浸洗足癣,也可用以对瓜果、蔬菜及餐具的消毒;浅红色溶液(0.01%以下)可用以漱口,有除臭消炎防龋作用。2.硫酸亚铁:亚铁离子是血红蛋白的重要成分,硫酸亚铁可用于治疗缺铁性贫血。许多补血糖浆中均含有硫酸亚铁。
3.氯化钙:人体内的钙,是保证骨骼硬度、促进骨骼生长的主要成分。口服或注射氯化钙,可防治佝偻病、软骨病。与维生素D合用能更好地促进钙的吸收和储存。4.氯化铁:手指一旦被划破后常会血流不止,若将氯化铁粉末撒入伤口,很快就能使流血凝固,且无痛感。原因在于它是一种重金属盐,能使血红蛋白变性。
5.硫酸锌:锌是人体内重要的微量元素,与生物体内七十多种酶的功能活性密切相关。锌摄取不足时,会产生体、智发育障碍、胃肠功能紊乱、偏头痛、夜盲、异食癖等。服用硫酸锌糖浆或片剂即可快速补充体内的锌元素。6.碳酸钙:是自然界中大理石、石灰石、白垩的主要成分,实验室常用它做制取二氧化碳的原料:
CaCO3+2HCl CaCl2+H2O+CO2↑
碳酸钙除了可做补钙剂,还是牙膏内的摩擦剂,通常由纯碱和熟石灰反应制得,反应的化学方程式为
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH。 汉白玉7.亚硝酸钠(NaNO2) ——小心亚硝酸钠成为“杀手”
亚硝酸钠亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。是致癌物质,其不仅存在于午餐肉中,在香肠、火腿等一些腌腊制品中都非常常见(主要作为一种增色剂、防腐剂使用,使肉颜色红润);尤其是煮过的剩菜中也存有亚硝酸钠。虽然亚硝酸钠是剧毒物质,但只要严格控制其食用量,对人体不会产生太大危害。 人体不能摄入过量的亚硝酸钠,否则0.3克~
0.5克便能中毒,3克便能致死。中毒后症状为心率加速,嗜睡,烦躁不安,呼吸急促,恶心呕吐,腹痛腹泻等,重者甚至昏迷、昏厥,常死于呼吸衰竭。 ???专家提醒,为避免亚硝酸钠对人体的危害,
平时要尽量少吃含有亚硝酸钠的食物。8.硫酸钡
天然BaSO4又称重晶石,由于其中含有CaCO3等杂质.天然BaSO4用于生产涂料或高级纸张,可用作白色颜料 ,并可作为油漆,油墨,塑料,橡胶的原料及填充剂。化工领域用它生产BaCl2及其他含钡化合物。
沉淀BaSO4较为纯净,在医学上,主要用作检查肠胃的内服药剂,进行钡餐透视。重晶石
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
