几种重要的盐(第二课时)
图片预览






文档简介
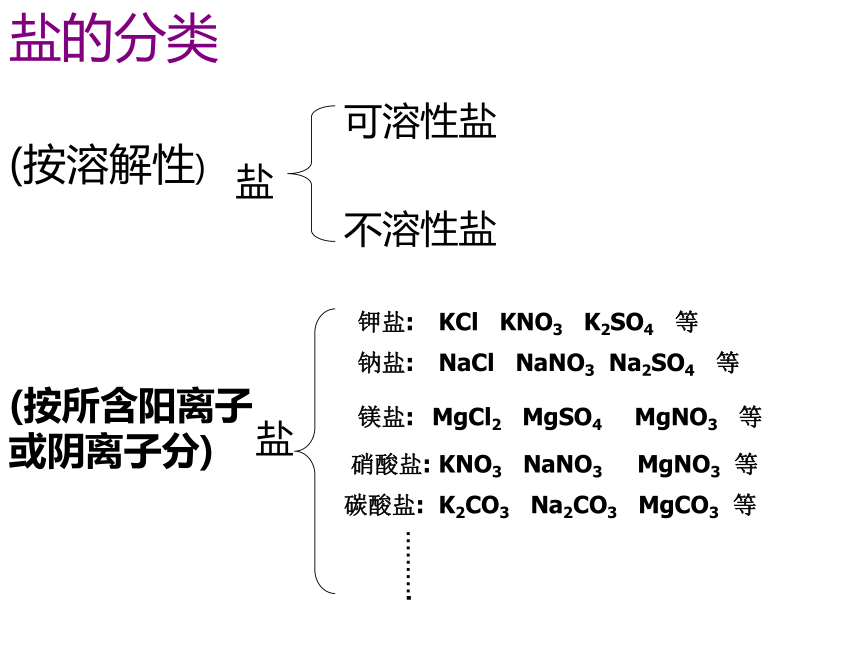
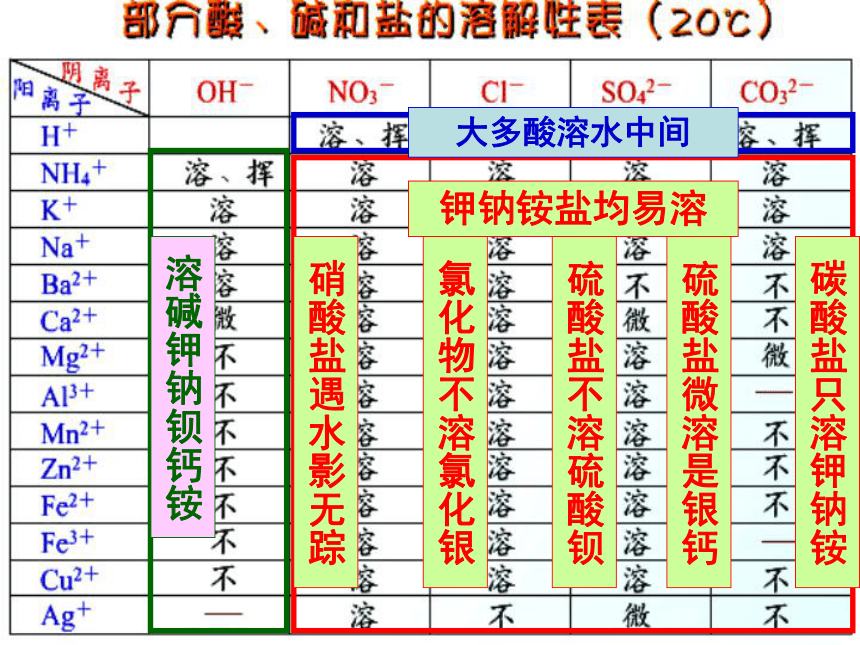
课件30张PPT。第4节 几种重要的盐(第二课时)盐的分类(按溶解性)盐可溶性盐不溶性盐(按所含阳离子或阴离子分)盐钾盐:KCl KNO3 K2SO4 等钠盐:镁盐:硝酸盐:碳酸盐:……….NaCl NaNO3 Na2SO4 等MgCl2 MgSO4 MgNO3 等KNO3 NaNO3 MgNO3 等K2CO3 Na2CO3 MgCO3 等溶碱钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙记忆规律: 可溶性盐:钾盐(含K+)、钠盐(含Na+)大部分碳酸盐如CaCO3、BaCO3、MgCO3等铵盐(含NH4+)、硝酸盐(含NO3-)硫酸钡BaSO4、 氯化银AgCI不可溶性盐:不溶性碱:如Fe(OH)3、Cu(OH)2、Mg(OH)2等可溶性碱:KOH 、NaOH 、Ba(OH)2
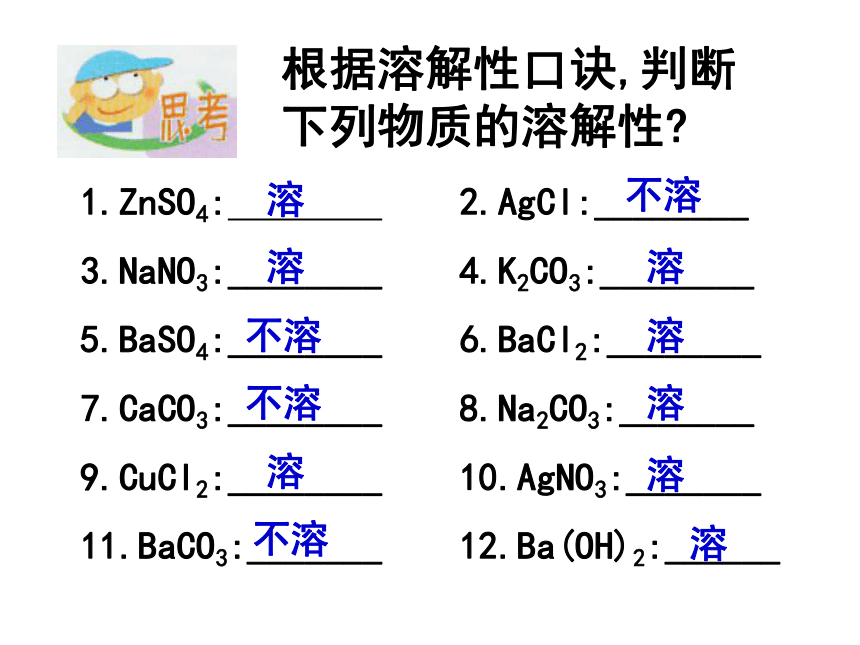
Ca(OH)2 、NH3.H2O根据溶解性口诀,判断下列物质的溶解性?1.ZnSO4: 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
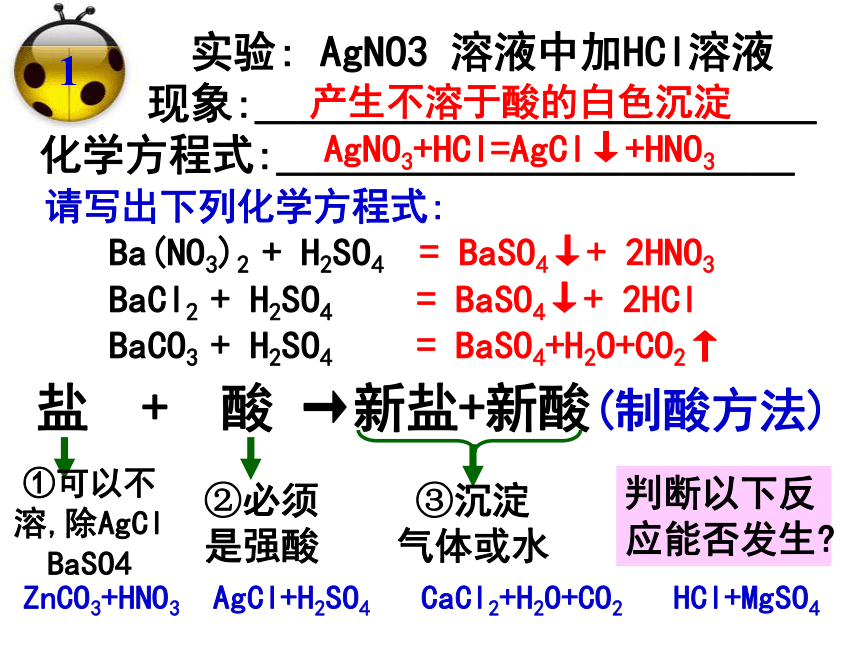
11.BaCO3:_______ 12.Ba(OH)2:______溶溶溶溶溶溶溶溶不溶不溶不溶不溶盐 + 酸 →新盐+新酸(制酸方法) 实验: AgNO3 溶液中加HCl溶液
现象:_____________
化学方程式:____________产生不溶于酸的白色沉淀AgNO3+HCl=AgCl↓+HNO31= BaSO4↓+ 2HNO3= BaSO4+H2O+CO2↑请写出下列化学方程式:= BaSO4↓+ 2HCl①可以不溶,除AgCl
BaSO4②必须是强酸③沉淀
气体或水判断以下反应能否发生?ZnCO3+HNO3 AgCl+H2SO4 CaCl2+H2O+CO2 HCl+MgSO4 实验: FeCl3溶液中加NaOH溶液, 现象:___________
化学方程式:____________产生红褐色絮状沉淀FeCl3+3NaOH=Fe(OH)3↓+3NaCl盐+碱→新盐+新碱(制碱的方法)2Ba(OH)2+Mg(NO3)2
Na2CO3 + Ca(OH)2
CuCl2 + 2KOH请写出下列化学方程式:= 2KCl + Cu(OH)2↓= CaCO3↓ + 2NaOH= Ba(NO3)2+Mg(OH)2↓均可溶沉淀.气体.水判断以下反应能否发生:Ca(OH)2+CuCO3 Na2SO4+KOH Mg(OH)2+FeCl3 K2CO3+Ba(OH)23Ba(NO3)2+ZnSO4=
Ba(NO3)2+Na2CO3=
BaCl2+Na2CO3 =
BaCl2+ZnSO4 =
BaCl2+2AgNO3 =
Na2CO3+2AgNO3=动手实验:CaCO3+FeCl3Zn(NO3)2+BaSO4↓2NaNO3+BaCO3↓2NaCl+BaCO3↓ZnCl2+BaSO4↓Ba(NO3)2+2AgCl↓2NaNO3+Ag2CO3↓≠不溶于酸白色沉淀不溶于酸白色沉淀不溶于酸白色沉淀溶于酸的白色沉淀溶于酸的白色沉淀溶于酸的白色沉淀盐 + 盐→ 新盐 + 新盐均可溶沉淀.气体.水判断以下反应能否发生?CuSO4+Mg(NO3)2 BaCO3+NaSO4
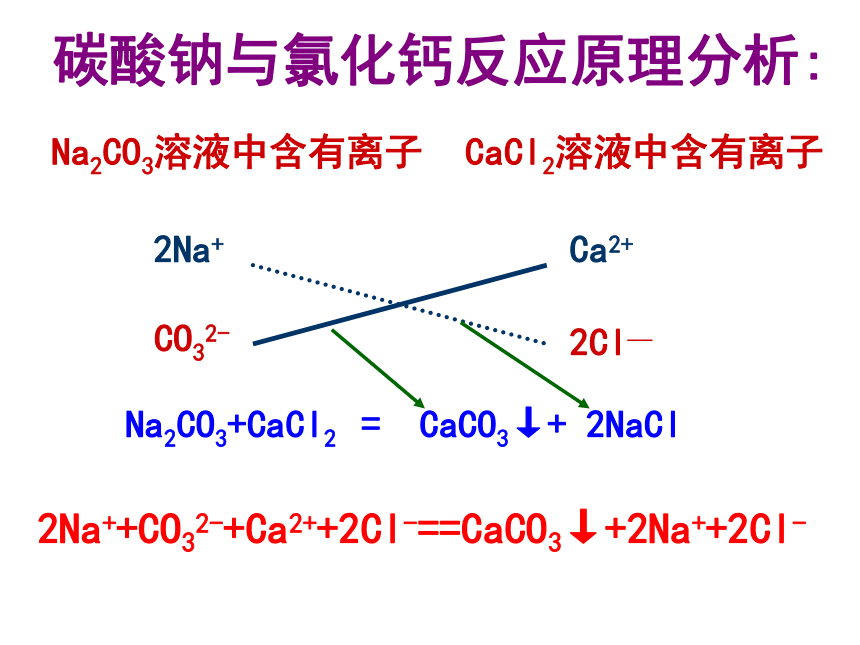
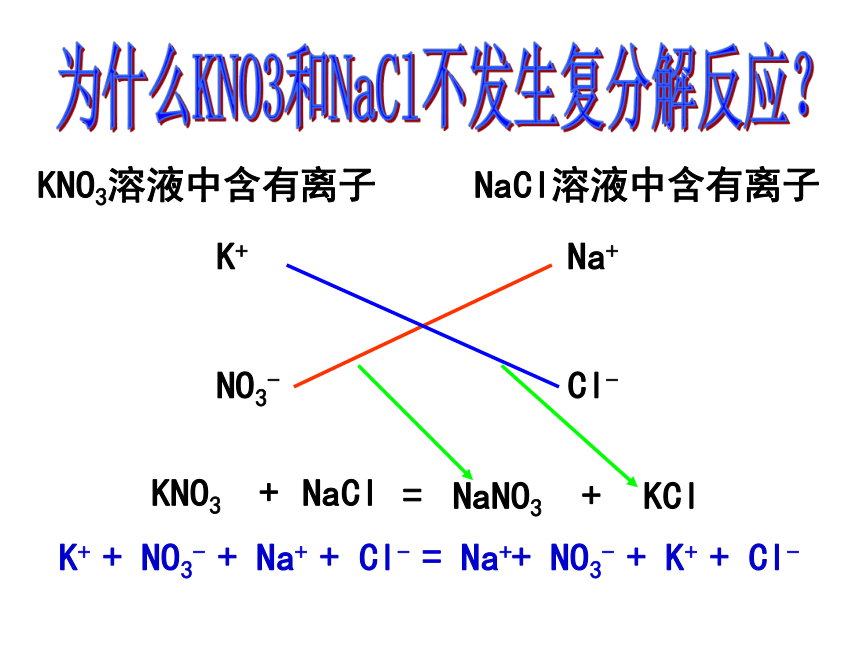
NH4Cl+Na2CO3 AgCl+Fe(NO3)22..复分解反应(1).[实验]在盛有Na2CO3溶液的试管里加入CaCl2溶液,可发现:________白色沉淀 Na2CO3+CaCl2 = CaCO3↓ +2NaCl Na2CO3溶液和CaCl2溶液反应生成两种新的盐: CaCO3和NaCl。这个反应的原理是怎样的? 盐 + 盐 = 新盐 + 新盐碳酸钠与氯化钙反应原理分析:Na2CO3溶液中含有离子2Na+CO32-CaCl2溶液中含有离子Ca2+2Cl—Na2CO3+CaCl2 = CaCO3↓+ 2NaCl2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-你能找出这个反应类型有什么特点?这种反应类型的特点是:两种化合物互相交换成分生成新的化合物。 (2) 定义:由于化合物互相交换成分生成新化合物的反应叫复分解反应。这种反应类型叫复分解反应。Na2CO3+CaCl2 = CaCO3↓+ 2NaCl为什么KNO3和NaCl不发生复分解反应?KNO3溶液中含有离子K+NO3- NaCl溶液中含有离子Na+Cl-K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl- (3)复分解反应的条件:生成物中有沉淀或气体或水。2NaOH + H2SO4 = Na2SO4 + 2H2O Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH2HCl + CaCO3 = CaCl2 + H2O + CO2↑下列4个反应是复分解反应吗?看看它们的生成物有什么规律?NaOH+BaCl2= Ba(OH)2+NaCl这个反应是不能进行。复分解反应及发生条件 AB + CD = AD + CB(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间(2)反应进行的环境:大多数在水溶液中进行生成沉
淀或气
体或水盐可以不溶
酸应是强酸碱可以不溶金氧可以不溶 两者均可溶 两者均可溶复分解反应口诀:
复分解,两头顾;
先顾头,后顾尾;
顾头要看溶解性,
盐碱盐盐均可溶;
可以反应再顾尾,
产生气体沉淀水;
交换离子写反应,
气体沉淀标符号。 下列物质能发生化学反应吗?为什么?1、CuO+Ba(OH)2= Cu(OH)2 ↓ +BaO
2、SO2+HNO3=NO2 + H2SO3
3、2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓
4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl因为---1:碱不能与金属氧化物反应。2:酸不能与非金属氧化物反应。3:Fe(OH)3难溶下列物质能发生化学反应吗?为什么?5、Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑
6、 Ba(OH)2+H2SO4= BaSO4 ↓ +2H2O
7、NaOH+BaCl2= Ba(OH)2+NaCl
8、2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2因为---7和8:不符合复分解反应的条件。复分解反应两种化合物相互交换成分,
生成另外两种化合物的化学反应置换反应一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应AB + CD = AD + CBA + BC = B + AC四大基本反应类型复分解反应置换反应AB + CD = AD + CBA + BC = B + AC分解反应化合反应A = B + CA + B = C1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 5、CaO + H2O =Ca(OH)2 2、Zn + H2SO4 = ZnSO4 + H2↑ 7、 CaCO3 高温 CaO + CO2 ↑ 1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 判断下列反应分别属于哪种基本反应类型?复分解反应置换反应分解反应化合反应复分解反应复分解反应复分解反应下列方程式属中和反应的有______;属复分解的有_________;属置换反应的有________. 1、BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
2、Fe2O3 + 3 H2SO4 = Fe2(SO4)3 +3 H2O
3、Fe + H2SO4 == FeSO4 + H2 ↑
4、Na2CO3 + H2SO4 =Na2SO4 + CO2 ↑+ H2O
5、Ca(OH)2 + H2SO4 == CaSO4 + 2H2O
6、Na2CO3+ Ca(OH)2= CaCO3↓+H2O
7、BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
8、(NH4)2SO4+Ca(OH)2==CaSO4+2NH3 ↑ +H2O512456783 中和反应是否是复分解反应?(4)酸碱盐之间的反应一般是复分解反应。 复分解反应不一定是中和反应,而中和反应一定是复分解反应,即中和反应是复分解反应中的一种。 根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?3.盐的制取(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。 1、酸+金属=盐+氢气 (2)制取盐的途径:7、盐+盐=新盐+新盐8、金属+盐=新金属+新盐(下节学习) 6、碱+酸性氧化物=盐+水 5、碱+盐=新碱+新盐 4、酸+盐=新酸+新盐3、酸+碱=盐+水2、酸+金属氧化物=盐+水下列各组溶液中,不用其他试剂,只用组内溶液互相混合的方法就能鉴别的一组是 ( )A. Na2SO4、BaCl2、KNO3、NaClB. CuSO4、H2SO4、BaCl2、HClC. NaOH、Na2SO4、FeCl3、BaCl2D. NaCl、AgNO3、NaNO3、HClB 【做一做】现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠。为了确定它们各是哪一种,进行一系列实验,其中观察到如下现象:(1) B跟C两溶液混合,产生白色沉淀;(2) B跟D两溶液混合,产生白色沉淀;(3) B跟E两溶液混合,产生气泡;(4) C溶液能使红色石蕊试纸变蓝。分析上述实验现象,推断出A、B、C、D、E的化学式:A ______ B ________ C ________ D ______ E ____NaClNa2CO3Ca(OH)2CaCl2HClB+C的化学反应方程式: Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )
A.反应物的溶解性
B.生成物中有无气体.沉淀和水
C.反应物中有无酸碱盐
D.金属活动性强弱2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?3.下列各组在溶液中能大量共存的是( )
A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2
C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaClD难以形成沉淀.气体或水D4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( )
A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠5.下列各组物质的溶液,不能发生复分解反应是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4? C.AgNO3和BaCl2 D.KCl和CuSO46.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。CDK2CO3MgCl2.CuSO4.
AgCl.BaSO4BaSO4不溶于水,也不与酸反应式BaCO3+2HCl==BaCl2+H2O+CO2↑BaCl2 + MgSO4 ==== BaSO4↓ + MgCl28.有一包固体粉末,可能由CaCO3.Na2SO4.KNO3.CuSO4.
BaCl2中的一种或几种组成,做实验得以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色. (2)该白色沉淀不溶于稀硝酸.
从实验可判断出,该粉末中一定含有______,一定不含有______。9.用化学方法区别NaOH.H2SO4.NaCl.Na2SO4.NaNO3五瓶
无色液体?Na2SO4
BaCl2CaCO3.CuSO410.在一条鱼虾绝迹的小河边,有四座工厂:甲.乙.丙.丁,他们排放的废液里,每厂只有碳酸钠.氯化铁.氢氧化钙.盐酸的一种,某中学环保小组对实现调查的情况如图,甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生,请推测这四座工厂废液里的污染物. Ca(OH)2FeCl3HClNa2CO3
Ca(OH)2 、NH3.H2O根据溶解性口诀,判断下列物质的溶解性?1.ZnSO4: 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ba(OH)2:______溶溶溶溶溶溶溶溶不溶不溶不溶不溶盐 + 酸 →新盐+新酸(制酸方法) 实验: AgNO3 溶液中加HCl溶液
现象:_____________
化学方程式:____________产生不溶于酸的白色沉淀AgNO3+HCl=AgCl↓+HNO31= BaSO4↓+ 2HNO3= BaSO4+H2O+CO2↑请写出下列化学方程式:= BaSO4↓+ 2HCl①可以不溶,除AgCl
BaSO4②必须是强酸③沉淀
气体或水判断以下反应能否发生?ZnCO3+HNO3 AgCl+H2SO4 CaCl2+H2O+CO2 HCl+MgSO4 实验: FeCl3溶液中加NaOH溶液, 现象:___________
化学方程式:____________产生红褐色絮状沉淀FeCl3+3NaOH=Fe(OH)3↓+3NaCl盐+碱→新盐+新碱(制碱的方法)2Ba(OH)2+Mg(NO3)2
Na2CO3 + Ca(OH)2
CuCl2 + 2KOH请写出下列化学方程式:= 2KCl + Cu(OH)2↓= CaCO3↓ + 2NaOH= Ba(NO3)2+Mg(OH)2↓均可溶沉淀.气体.水判断以下反应能否发生:Ca(OH)2+CuCO3 Na2SO4+KOH Mg(OH)2+FeCl3 K2CO3+Ba(OH)23Ba(NO3)2+ZnSO4=
Ba(NO3)2+Na2CO3=
BaCl2+Na2CO3 =
BaCl2+ZnSO4 =
BaCl2+2AgNO3 =
Na2CO3+2AgNO3=动手实验:CaCO3+FeCl3Zn(NO3)2+BaSO4↓2NaNO3+BaCO3↓2NaCl+BaCO3↓ZnCl2+BaSO4↓Ba(NO3)2+2AgCl↓2NaNO3+Ag2CO3↓≠不溶于酸白色沉淀不溶于酸白色沉淀不溶于酸白色沉淀溶于酸的白色沉淀溶于酸的白色沉淀溶于酸的白色沉淀盐 + 盐→ 新盐 + 新盐均可溶沉淀.气体.水判断以下反应能否发生?CuSO4+Mg(NO3)2 BaCO3+NaSO4
NH4Cl+Na2CO3 AgCl+Fe(NO3)22..复分解反应(1).[实验]在盛有Na2CO3溶液的试管里加入CaCl2溶液,可发现:________白色沉淀 Na2CO3+CaCl2 = CaCO3↓ +2NaCl Na2CO3溶液和CaCl2溶液反应生成两种新的盐: CaCO3和NaCl。这个反应的原理是怎样的? 盐 + 盐 = 新盐 + 新盐碳酸钠与氯化钙反应原理分析:Na2CO3溶液中含有离子2Na+CO32-CaCl2溶液中含有离子Ca2+2Cl—Na2CO3+CaCl2 = CaCO3↓+ 2NaCl2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-你能找出这个反应类型有什么特点?这种反应类型的特点是:两种化合物互相交换成分生成新的化合物。 (2) 定义:由于化合物互相交换成分生成新化合物的反应叫复分解反应。这种反应类型叫复分解反应。Na2CO3+CaCl2 = CaCO3↓+ 2NaCl为什么KNO3和NaCl不发生复分解反应?KNO3溶液中含有离子K+NO3- NaCl溶液中含有离子Na+Cl-K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl- (3)复分解反应的条件:生成物中有沉淀或气体或水。2NaOH + H2SO4 = Na2SO4 + 2H2O Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH2HCl + CaCO3 = CaCl2 + H2O + CO2↑下列4个反应是复分解反应吗?看看它们的生成物有什么规律?NaOH+BaCl2= Ba(OH)2+NaCl这个反应是不能进行。复分解反应及发生条件 AB + CD = AD + CB(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间(2)反应进行的环境:大多数在水溶液中进行生成沉
淀或气
体或水盐可以不溶
酸应是强酸碱可以不溶金氧可以不溶 两者均可溶 两者均可溶复分解反应口诀:
复分解,两头顾;
先顾头,后顾尾;
顾头要看溶解性,
盐碱盐盐均可溶;
可以反应再顾尾,
产生气体沉淀水;
交换离子写反应,
气体沉淀标符号。 下列物质能发生化学反应吗?为什么?1、CuO+Ba(OH)2= Cu(OH)2 ↓ +BaO
2、SO2+HNO3=NO2 + H2SO3
3、2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓
4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl因为---1:碱不能与金属氧化物反应。2:酸不能与非金属氧化物反应。3:Fe(OH)3难溶下列物质能发生化学反应吗?为什么?5、Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑
6、 Ba(OH)2+H2SO4= BaSO4 ↓ +2H2O
7、NaOH+BaCl2= Ba(OH)2+NaCl
8、2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2因为---7和8:不符合复分解反应的条件。复分解反应两种化合物相互交换成分,
生成另外两种化合物的化学反应置换反应一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应AB + CD = AD + CBA + BC = B + AC四大基本反应类型复分解反应置换反应AB + CD = AD + CBA + BC = B + AC分解反应化合反应A = B + CA + B = C1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 5、CaO + H2O =Ca(OH)2 2、Zn + H2SO4 = ZnSO4 + H2↑ 7、 CaCO3 高温 CaO + CO2 ↑ 1、Na2CO3 + 2HCl = 2NaCl +H2O +CO2↑ 3、BaCl2 + H2SO4 = BaSO4↓ + 2HCl 4、Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 6、NaOH + HCl = NaCl + H2O 判断下列反应分别属于哪种基本反应类型?复分解反应置换反应分解反应化合反应复分解反应复分解反应复分解反应下列方程式属中和反应的有______;属复分解的有_________;属置换反应的有________. 1、BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
2、Fe2O3 + 3 H2SO4 = Fe2(SO4)3 +3 H2O
3、Fe + H2SO4 == FeSO4 + H2 ↑
4、Na2CO3 + H2SO4 =Na2SO4 + CO2 ↑+ H2O
5、Ca(OH)2 + H2SO4 == CaSO4 + 2H2O
6、Na2CO3+ Ca(OH)2= CaCO3↓+H2O
7、BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
8、(NH4)2SO4+Ca(OH)2==CaSO4+2NH3 ↑ +H2O512456783 中和反应是否是复分解反应?(4)酸碱盐之间的反应一般是复分解反应。 复分解反应不一定是中和反应,而中和反应一定是复分解反应,即中和反应是复分解反应中的一种。 根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?3.盐的制取(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。 1、酸+金属=盐+氢气 (2)制取盐的途径:7、盐+盐=新盐+新盐8、金属+盐=新金属+新盐(下节学习) 6、碱+酸性氧化物=盐+水 5、碱+盐=新碱+新盐 4、酸+盐=新酸+新盐3、酸+碱=盐+水2、酸+金属氧化物=盐+水下列各组溶液中,不用其他试剂,只用组内溶液互相混合的方法就能鉴别的一组是 ( )A. Na2SO4、BaCl2、KNO3、NaClB. CuSO4、H2SO4、BaCl2、HClC. NaOH、Na2SO4、FeCl3、BaCl2D. NaCl、AgNO3、NaNO3、HClB 【做一做】现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠。为了确定它们各是哪一种,进行一系列实验,其中观察到如下现象:(1) B跟C两溶液混合,产生白色沉淀;(2) B跟D两溶液混合,产生白色沉淀;(3) B跟E两溶液混合,产生气泡;(4) C溶液能使红色石蕊试纸变蓝。分析上述实验现象,推断出A、B、C、D、E的化学式:A ______ B ________ C ________ D ______ E ____NaClNa2CO3Ca(OH)2CaCl2HClB+C的化学反应方程式: Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )
A.反应物的溶解性
B.生成物中有无气体.沉淀和水
C.反应物中有无酸碱盐
D.金属活动性强弱2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?3.下列各组在溶液中能大量共存的是( )
A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2
C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaClD难以形成沉淀.气体或水D4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( )
A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠5.下列各组物质的溶液,不能发生复分解反应是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4? C.AgNO3和BaCl2 D.KCl和CuSO46.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。CDK2CO3MgCl2.CuSO4.
AgCl.BaSO4BaSO4不溶于水,也不与酸反应式BaCO3+2HCl==BaCl2+H2O+CO2↑BaCl2 + MgSO4 ==== BaSO4↓ + MgCl28.有一包固体粉末,可能由CaCO3.Na2SO4.KNO3.CuSO4.
BaCl2中的一种或几种组成,做实验得以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色. (2)该白色沉淀不溶于稀硝酸.
从实验可判断出,该粉末中一定含有______,一定不含有______。9.用化学方法区别NaOH.H2SO4.NaCl.Na2SO4.NaNO3五瓶
无色液体?Na2SO4
BaCl2CaCO3.CuSO410.在一条鱼虾绝迹的小河边,有四座工厂:甲.乙.丙.丁,他们排放的废液里,每厂只有碳酸钠.氯化铁.氢氧化钙.盐酸的一种,某中学环保小组对实现调查的情况如图,甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生,请推测这四座工厂废液里的污染物. Ca(OH)2FeCl3HClNa2CO3
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
