物质转化的规律(第一课时)
图片预览




文档简介
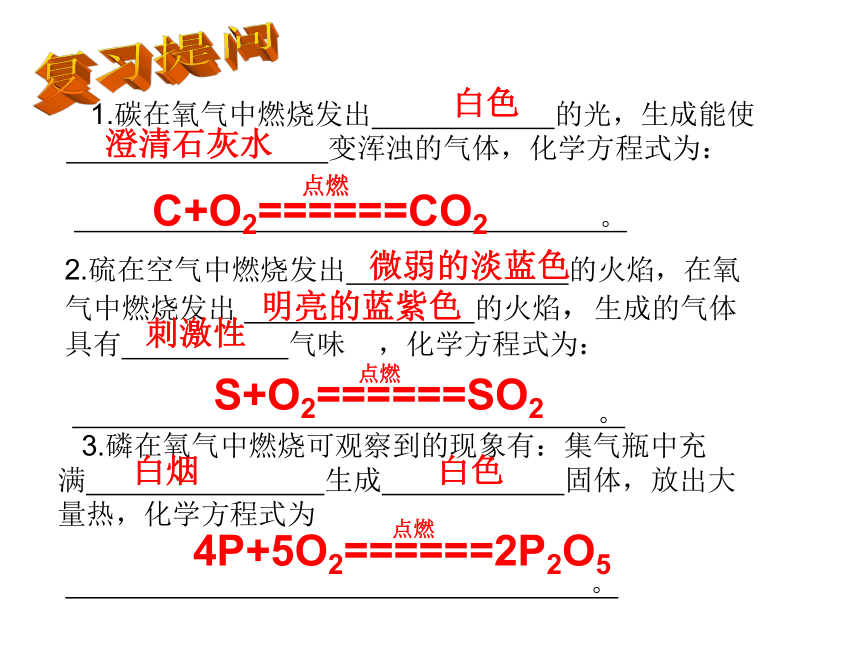
课件18张PPT。第2节:物质转化的规律(第一课时)复习提问 1.碳在氧气中燃烧发出 的光,生成能使
变浑浊的气体,化学方程式为:
。2.硫在空气中燃烧发出 的火焰,在氧气中燃烧发出 的火焰,生成的气体
具有 气味 ,化学方程式为:
。 3.磷在氧气中燃烧可观察到的现象有:集气瓶中充
满 生成 固体,放出大量热,化学方程式为
。白色澄清石灰水C+O2======CO2点燃微弱的淡蓝色明亮的蓝紫色刺激性S+O2======SO2点燃白烟白色4P+5O2======2P2O5点燃一、非金属单质与其化合物的转化硫磺磷碳1.转化规律:非金属单质在氧气中燃烧可生成非金属氧化物
一、非金属单质与其化合物的转化1.转化规律:非金属单质在氧气中燃烧可生成非金属氧化物2.转化规律的应用(1)燃料燃烧①氢气在空气或氧气中燃烧(或爆炸)都生成水②碳在空气燃烧,O2充足时生成CO2,不足时生成CO.C+O2(充足)===CO2点燃C+O2(不充足)===CO
点燃2H2+O2======2H2O 点燃一、非金属单质与其化合物的转化1.转化规律:非金属单质在氧气中燃烧可生成非金属氧化物2.转化规律的应用(1)燃料燃烧(2)用于除去气体中的O2.例如:白炽灯泡内加入少量磷,可除去灯泡
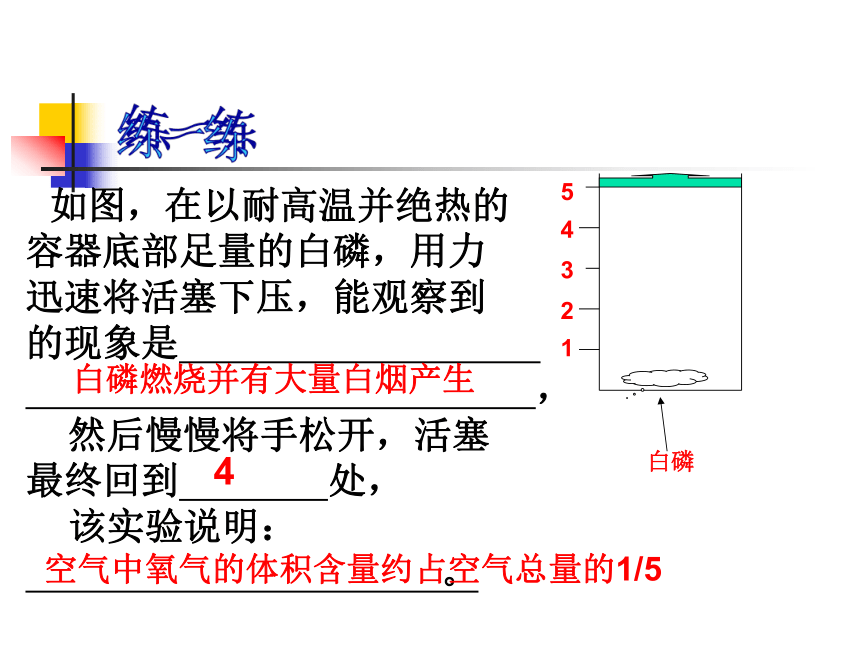
内的O2,防止钨丝氧化熔断。(3)常用于验证空气中氧气 的体积分数12345白磷练一练 如图,在以耐高温并绝热的
容器底部足量的白磷,用力
迅速将活塞下压,能观察到
的现象是
,
然后慢慢将手松开,活塞
最终回到 处,
该实验说明:
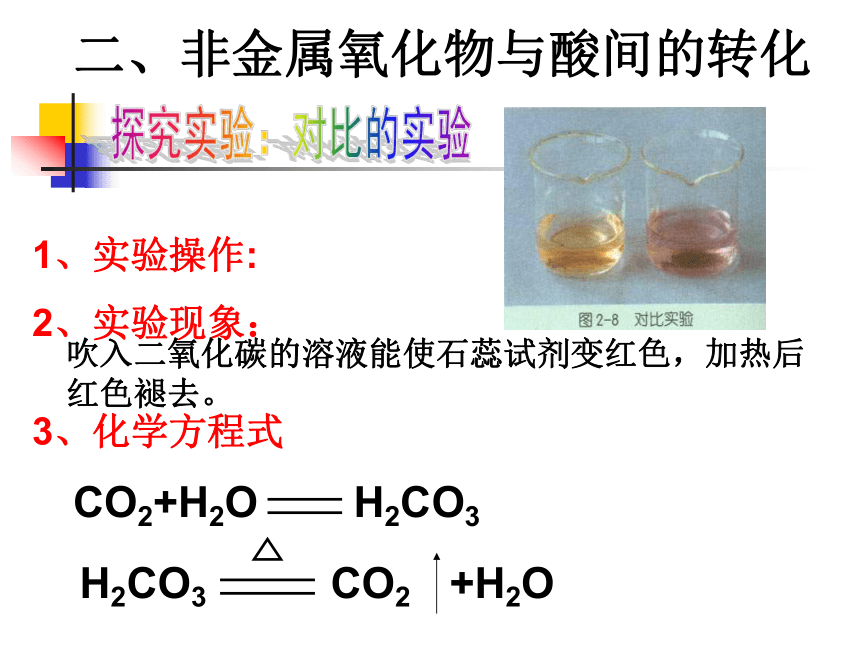
。白磷燃烧并有大量白烟产生4空气中氧气的体积含量约占空气总量的1/5探究实验:对比的实验吹入二氧化碳的溶液能使石蕊试剂变红色,加热后红色褪去。二、非金属氧化物与酸间的转化大部分的非金属氧化物可溶于水,生成对应的酸;酸非金属氧化物转化规律:非金属氧化物与水反应生成酸注意:二氧化硅不能与水化合生成硅酸。练习1:现在我国的常用能源煤和石油中都含有硫,在燃烧时生成SO2,导致大气污染而降酸雨。请写出有关的化学方程式练习练习2:正常情况下人体的血液的pH
为7.35~7.45,但在通风不良的场所里
时间过长,吸入含较多二氧化碳的空
气,将使血液里二氧化碳含量增多,血
液的pH会( )
A.增大 B.降低
C.不变 D.无法确定B讨论: 正常的降水是碱性、中性还是酸性的?
为什么?酸活动 将稀硫酸分别倒入盛有CuO、Cu(OH)2和
CuCO3 的试管
现象:
化学方程式:
不溶于水的CuO、Cu(OH)2和CuCO3 慢慢消失,生成蓝色溶液CuO+H2SO4==CuSO4+H2O
Cu(OH)2+H2SO4==CuSO4+H2O
CuCO3 +H2SO4==CuSO4+H2O+CO2
三、酸与盐之间的转化规律盐酸的通性酸练习1.写出以盐酸和有关物质为原料制取
氯化锌的化学方程式(1)酸+金属氧化物==盐+水依据:酸的有关通性(2)酸+碱==盐+水(3)酸+某些金属==盐+水(4)酸+某些盐==新盐+新酸Ca(OH)2H2OO2小结课堂练习1.碳和部分碳的化合物间转化关系如图所示.(1)物质X的化学式为 。
(2)在物质的分类中,CO属于 。(填标号)
A.酸 B.碱 C.盐 D.氧化物
(3)从图中任选一种物质,它的一种用途 。
(4)写出图中转化关系中属于化合反应的一个化学方程式 。
。2.A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的关系如图所示,相互之间连线表示能发生化学反应。A、C、E均为氧化物,A是人体呼出的主要气体;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D。
(1)A的化学式是 ,D的化学式是 ;
(2)B除了制取A之外的另一种用途是 ;
(3)C和E反应的化学方程式为 ,该反应的基本类型是 。3.模拟酸雨形成的流程如下图所示。硫在单质气体A中燃烧发出蓝紫色火焰,生成刺激性气味的气体B;通常情况下C为无色液体,B、C、D是氧化物;E、F和X都是酸,G是白色沉淀。试填空。
(1)E的化学式为: 。
(2)反应①的化学方程式为: 。
(3)反应④的化学方程式为: 。
(4)反应⑥的化学方程式为: ▲
。
再 见
变浑浊的气体,化学方程式为:
。2.硫在空气中燃烧发出 的火焰,在氧气中燃烧发出 的火焰,生成的气体
具有 气味 ,化学方程式为:
。 3.磷在氧气中燃烧可观察到的现象有:集气瓶中充
满 生成 固体,放出大量热,化学方程式为
。白色澄清石灰水C+O2======CO2点燃微弱的淡蓝色明亮的蓝紫色刺激性S+O2======SO2点燃白烟白色4P+5O2======2P2O5点燃一、非金属单质与其化合物的转化硫磺磷碳1.转化规律:非金属单质在氧气中燃烧可生成非金属氧化物
一、非金属单质与其化合物的转化1.转化规律:非金属单质在氧气中燃烧可生成非金属氧化物2.转化规律的应用(1)燃料燃烧①氢气在空气或氧气中燃烧(或爆炸)都生成水②碳在空气燃烧,O2充足时生成CO2,不足时生成CO.C+O2(充足)===CO2点燃C+O2(不充足)===CO
点燃2H2+O2======2H2O 点燃一、非金属单质与其化合物的转化1.转化规律:非金属单质在氧气中燃烧可生成非金属氧化物2.转化规律的应用(1)燃料燃烧(2)用于除去气体中的O2.例如:白炽灯泡内加入少量磷,可除去灯泡
内的O2,防止钨丝氧化熔断。(3)常用于验证空气中氧气 的体积分数12345白磷练一练 如图,在以耐高温并绝热的
容器底部足量的白磷,用力
迅速将活塞下压,能观察到
的现象是
,
然后慢慢将手松开,活塞
最终回到 处,
该实验说明:
。白磷燃烧并有大量白烟产生4空气中氧气的体积含量约占空气总量的1/5探究实验:对比的实验吹入二氧化碳的溶液能使石蕊试剂变红色,加热后红色褪去。二、非金属氧化物与酸间的转化大部分的非金属氧化物可溶于水,生成对应的酸;酸非金属氧化物转化规律:非金属氧化物与水反应生成酸注意:二氧化硅不能与水化合生成硅酸。练习1:现在我国的常用能源煤和石油中都含有硫,在燃烧时生成SO2,导致大气污染而降酸雨。请写出有关的化学方程式练习练习2:正常情况下人体的血液的pH
为7.35~7.45,但在通风不良的场所里
时间过长,吸入含较多二氧化碳的空
气,将使血液里二氧化碳含量增多,血
液的pH会( )
A.增大 B.降低
C.不变 D.无法确定B讨论: 正常的降水是碱性、中性还是酸性的?
为什么?酸活动 将稀硫酸分别倒入盛有CuO、Cu(OH)2和
CuCO3 的试管
现象:
化学方程式:
不溶于水的CuO、Cu(OH)2和CuCO3 慢慢消失,生成蓝色溶液CuO+H2SO4==CuSO4+H2O
Cu(OH)2+H2SO4==CuSO4+H2O
CuCO3 +H2SO4==CuSO4+H2O+CO2
三、酸与盐之间的转化规律盐酸的通性酸练习1.写出以盐酸和有关物质为原料制取
氯化锌的化学方程式(1)酸+金属氧化物==盐+水依据:酸的有关通性(2)酸+碱==盐+水(3)酸+某些金属==盐+水(4)酸+某些盐==新盐+新酸Ca(OH)2H2OO2小结课堂练习1.碳和部分碳的化合物间转化关系如图所示.(1)物质X的化学式为 。
(2)在物质的分类中,CO属于 。(填标号)
A.酸 B.碱 C.盐 D.氧化物
(3)从图中任选一种物质,它的一种用途 。
(4)写出图中转化关系中属于化合反应的一个化学方程式 。
。2.A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的关系如图所示,相互之间连线表示能发生化学反应。A、C、E均为氧化物,A是人体呼出的主要气体;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D。
(1)A的化学式是 ,D的化学式是 ;
(2)B除了制取A之外的另一种用途是 ;
(3)C和E反应的化学方程式为 ,该反应的基本类型是 。3.模拟酸雨形成的流程如下图所示。硫在单质气体A中燃烧发出蓝紫色火焰,生成刺激性气味的气体B;通常情况下C为无色液体,B、C、D是氧化物;E、F和X都是酸,G是白色沉淀。试填空。
(1)E的化学式为: 。
(2)反应①的化学方程式为: 。
(3)反应④的化学方程式为: 。
(4)反应⑥的化学方程式为: ▲
。
再 见
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
