课题1 生活中常见的盐 复分解反应的实质及应用 (共25张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐 复分解反应的实质及应用 (共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 773.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-26 16:58:51 | ||
图片预览






文档简介
(共26张PPT)
复分解反应的实质及应用
我们怎么解决这样的问题?
1、某化工厂排出的废水中含有少量氢氧化钠和硫酸钠,我们如何处理,让废水只含有氯化钠呢?
2、海水晒盐得到的食盐中还含有
硫酸钠,氯化镁,氯化钙
等可溶性杂质,我们如
何处理,才能得到纯净
的氯化钠呢?
A
+
C
=
B
A
B
D
C
D
+
酸、碱、盐、氧化物
︸
由两种化合物互相交换成分 生成另外两种化合物的反应叫
做
复分解反应
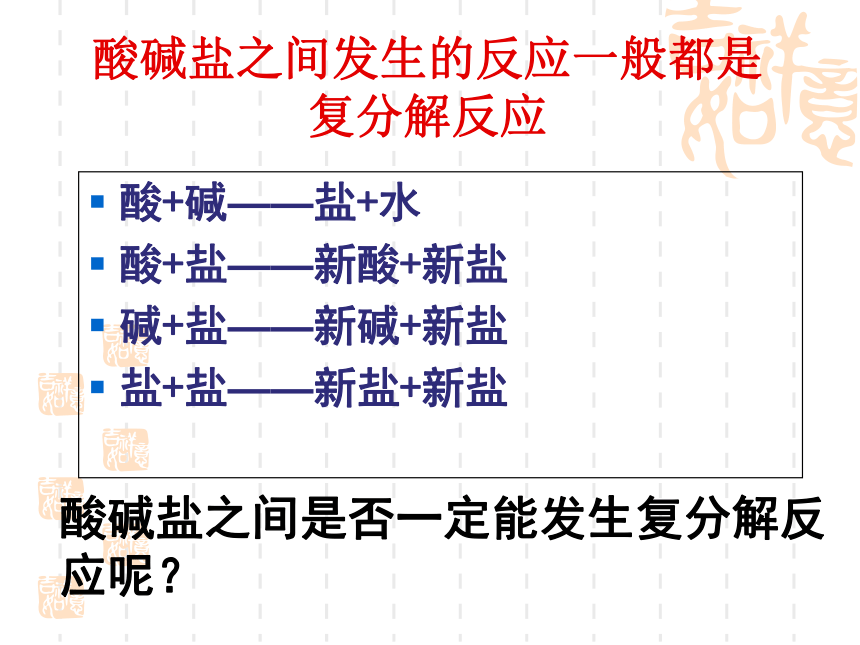
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸碱盐之间发生的反应一般都是
复分解反应
酸碱盐之间是否一定能发生复分解反应呢?
复分解反应要发生,需
要具备一定的的条件:
有 沉淀、气体或水生成
对于这三个条件我们进行分析总结:
1、有水生成:
2、有气体生成:
3、有沉淀生成:
符合这样的条件为什么就能发生复分解反应呢?下面让我们从微观角度来看一下这些反应吧!
酸+碱——盐+水
碳酸盐+酸(碳酸氢盐+酸)
产生碱的沉淀 或 盐的沉淀
co2
NH3
铵盐+碱
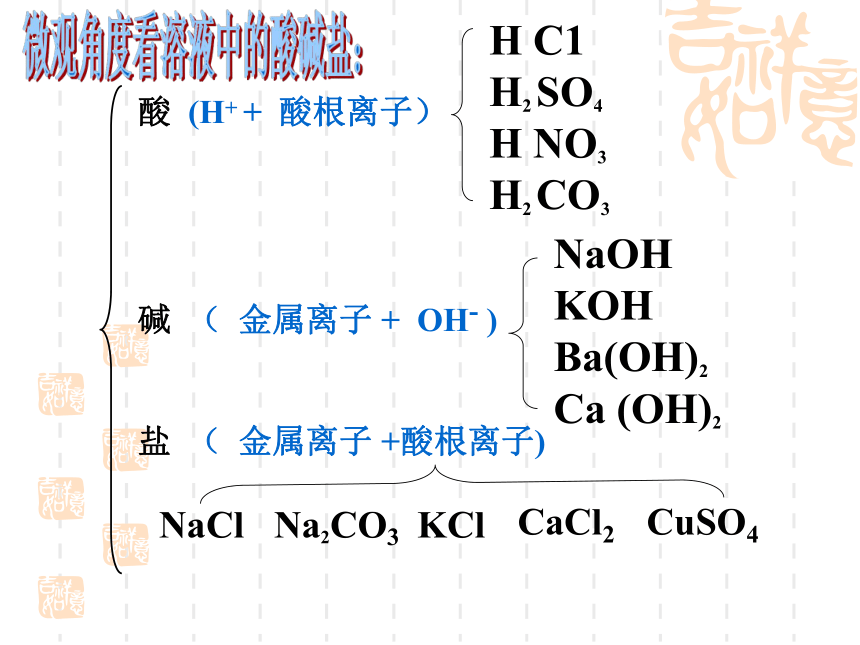
酸 (H+ + 酸根离子)
碱 ( 金属离子 + OH- )
盐 ( 金属离子 +酸根离子)
H C1
H2 SO4
H NO3 H2 CO3
NaOH
KOH
Ba(OH)2
Ca (OH)2
NaCl
Na2CO3
KCl
CaCl2
CuSO4
由此我们知道:
酸碱盐中的两种物质在溶液中混合,实际上是它们的离子与水分
子的混合
Na+
OH-
H+
NO3-
H2O
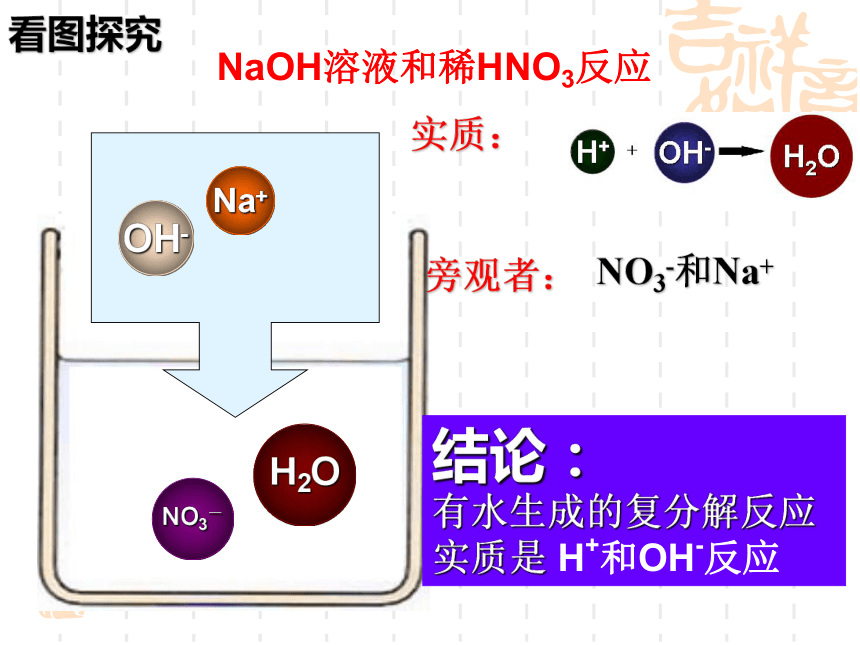
NaOH溶液和稀HNO3反应
看图探究
结论:
有水生成的复分解反应实质是 H+和OH-反应
实质:
旁观者:
NO3-和Na+
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+
反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
对于复分解反应三个条件我们进行微观总结:
1、有水生成:
2、有气体生成:
3、有沉淀生成:
H+ + OH- → H2O
H+ + CO32- ( H+ + HCO3- )
碱的沉淀 Mg2+、 Al3+ 、Fe3+、 Cu2+等和OH-反应生成不溶性碱的沉淀
co2
NH3
NH4++ OH-
盐的沉淀: Ag+ + Cl- →AgCl Ba2+ + SO42- →BaSO4
Ca2+ 、Ba2+等和CO32-生成不溶性的碳酸盐的沉淀
H+
OH-
CO32-
HCO3-
NH4+
Ba2+
Ca2+
SO42-
Mg2+
Cu2+
Al3+
Fe3+
Ag+
Cl-
OH- NO3- Cl- SO42- CO32-
H+ 溶
NH4+ 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 不溶
Ca2+ 溶
Mg2+ 溶
Al3+ 溶
Zn2+ 溶
Ag+ 溶 不溶
Fe3+ 溶
Cu2+ 溶
由此看来,酸碱盐之间发生的复分解反应,实质上是离子间的互换反应,两种离子之间如果能结合成难溶性的碱或盐、不稳定的酸或碱(分解放出气体)、或难电离的水,反应就能发生,反之,反应就不能发生。
例1、下列各组物质,能共同存在于水溶液中的是( )
A. H2SO4 Na2CO3 KOH B.MgCl2 CuSO4 NaNO3
C.AgNO3 BaCl2 K2SO4 D.HCl K2CO3 NaNO3
例2、下列各组离子能在同一种溶液中大量共存的是( )
A.H+、Na+、Cl-、CO32- B.NH4+、Cl-、K+、OH-
C.Na+、K+、Cu2+、Cl- D.Ag+、H+、NO3-、Cl-
B
C
甲化工厂排出的废水中含有少量氢氧化钠和硫酸钠,与乙化工厂排出的废水混合后,测得溶液的PH=7,且只含有氯化钠一种溶质。
请填空:1、乙化工厂的废水中含有的物质是:_______________(填化学式)
2、写出反应的化学方程式:__________ ______________________________.
HCl BaCl2
NaOH+HCl=NaCl+H2O Na2SO4+BaCl2=BaSO4↓+2NaCl
海水晒盐得到的食盐中还含有硫酸钠,氯化镁,氯化钙等可溶性杂质,我们如何处理,才能得到纯净的氯化钠呢?按顺序写出所加试剂及反应的方程式。
下列离子能在PH<7的溶液中大量共存,并形成
无色溶液的是( )
A、Cu2+、SO42-、Na+、OH-
B、K+、Na+、CO32-、Cl-
C、K+、Fe3+、NO3-、SO42-
D、Na+、Cl-、K+、NO3-
D
2、下列各组中的物质的溶液混合后没有反应现象发生的是( ) A、CuSO4 Na2CO3 稀硫酸
B、NaOH Ba(NO3)2 稀盐酸
C、MgSO4 NaCl Ca(OH)2
D、BaCl2 KNO3 AgNO3
B
3、下列各组的物质中,加水充分溶解后过滤,滤纸上肯定有两种不溶物的是( )
A、Ca(NO3)2 CaCl2 Na2CO3
B、CuSO4 Cu(NO3)2 Ba(OH)2
C、NaOH KCl Ba(NO3)2
D、FeCl3 KOH BaCl2
B
4、(2011青岛中考)在“氢氧化钠的化学性质”实验探究课上,同学们做了氢氧化钠溶液与稀硫酸、氯化铜溶液之间反应的实验。为对本课产生的废液进行绿色排放,同学对废液的成分进行探究和处理。
请填空:甲同学取少量废液样品,观察到样品澄清并呈浅蓝色。由此猜想,溶液中可能存在的离子为 。
H+
复习指导 P121 10
P138 7、8
谢谢大家
复分解反应的实质及应用
我们怎么解决这样的问题?
1、某化工厂排出的废水中含有少量氢氧化钠和硫酸钠,我们如何处理,让废水只含有氯化钠呢?
2、海水晒盐得到的食盐中还含有
硫酸钠,氯化镁,氯化钙
等可溶性杂质,我们如
何处理,才能得到纯净
的氯化钠呢?
A
+
C
=
B
A
B
D
C
D
+
酸、碱、盐、氧化物
︸
由两种化合物互相交换成分 生成另外两种化合物的反应叫
做
复分解反应
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸碱盐之间发生的反应一般都是
复分解反应
酸碱盐之间是否一定能发生复分解反应呢?
复分解反应要发生,需
要具备一定的的条件:
有 沉淀、气体或水生成
对于这三个条件我们进行分析总结:
1、有水生成:
2、有气体生成:
3、有沉淀生成:
符合这样的条件为什么就能发生复分解反应呢?下面让我们从微观角度来看一下这些反应吧!
酸+碱——盐+水
碳酸盐+酸(碳酸氢盐+酸)
产生碱的沉淀 或 盐的沉淀
co2
NH3
铵盐+碱
酸 (H+ + 酸根离子)
碱 ( 金属离子 + OH- )
盐 ( 金属离子 +酸根离子)
H C1
H2 SO4
H NO3 H2 CO3
NaOH
KOH
Ba(OH)2
Ca (OH)2
NaCl
Na2CO3
KCl
CaCl2
CuSO4
由此我们知道:
酸碱盐中的两种物质在溶液中混合,实际上是它们的离子与水分
子的混合
Na+
OH-
H+
NO3-
H2O
NaOH溶液和稀HNO3反应
看图探究
结论:
有水生成的复分解反应实质是 H+和OH-反应
实质:
旁观者:
NO3-和Na+
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+
反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
对于复分解反应三个条件我们进行微观总结:
1、有水生成:
2、有气体生成:
3、有沉淀生成:
H+ + OH- → H2O
H+ + CO32- ( H+ + HCO3- )
碱的沉淀 Mg2+、 Al3+ 、Fe3+、 Cu2+等和OH-反应生成不溶性碱的沉淀
co2
NH3
NH4++ OH-
盐的沉淀: Ag+ + Cl- →AgCl Ba2+ + SO42- →BaSO4
Ca2+ 、Ba2+等和CO32-生成不溶性的碳酸盐的沉淀
H+
OH-
CO32-
HCO3-
NH4+
Ba2+
Ca2+
SO42-
Mg2+
Cu2+
Al3+
Fe3+
Ag+
Cl-
OH- NO3- Cl- SO42- CO32-
H+ 溶
NH4+ 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 不溶
Ca2+ 溶
Mg2+ 溶
Al3+ 溶
Zn2+ 溶
Ag+ 溶 不溶
Fe3+ 溶
Cu2+ 溶
由此看来,酸碱盐之间发生的复分解反应,实质上是离子间的互换反应,两种离子之间如果能结合成难溶性的碱或盐、不稳定的酸或碱(分解放出气体)、或难电离的水,反应就能发生,反之,反应就不能发生。
例1、下列各组物质,能共同存在于水溶液中的是( )
A. H2SO4 Na2CO3 KOH B.MgCl2 CuSO4 NaNO3
C.AgNO3 BaCl2 K2SO4 D.HCl K2CO3 NaNO3
例2、下列各组离子能在同一种溶液中大量共存的是( )
A.H+、Na+、Cl-、CO32- B.NH4+、Cl-、K+、OH-
C.Na+、K+、Cu2+、Cl- D.Ag+、H+、NO3-、Cl-
B
C
甲化工厂排出的废水中含有少量氢氧化钠和硫酸钠,与乙化工厂排出的废水混合后,测得溶液的PH=7,且只含有氯化钠一种溶质。
请填空:1、乙化工厂的废水中含有的物质是:_______________(填化学式)
2、写出反应的化学方程式:__________ ______________________________.
HCl BaCl2
NaOH+HCl=NaCl+H2O Na2SO4+BaCl2=BaSO4↓+2NaCl
海水晒盐得到的食盐中还含有硫酸钠,氯化镁,氯化钙等可溶性杂质,我们如何处理,才能得到纯净的氯化钠呢?按顺序写出所加试剂及反应的方程式。
下列离子能在PH<7的溶液中大量共存,并形成
无色溶液的是( )
A、Cu2+、SO42-、Na+、OH-
B、K+、Na+、CO32-、Cl-
C、K+、Fe3+、NO3-、SO42-
D、Na+、Cl-、K+、NO3-
D
2、下列各组中的物质的溶液混合后没有反应现象发生的是( ) A、CuSO4 Na2CO3 稀硫酸
B、NaOH Ba(NO3)2 稀盐酸
C、MgSO4 NaCl Ca(OH)2
D、BaCl2 KNO3 AgNO3
B
3、下列各组的物质中,加水充分溶解后过滤,滤纸上肯定有两种不溶物的是( )
A、Ca(NO3)2 CaCl2 Na2CO3
B、CuSO4 Cu(NO3)2 Ba(OH)2
C、NaOH KCl Ba(NO3)2
D、FeCl3 KOH BaCl2
B
4、(2011青岛中考)在“氢氧化钠的化学性质”实验探究课上,同学们做了氢氧化钠溶液与稀硫酸、氯化铜溶液之间反应的实验。为对本课产生的废液进行绿色排放,同学对废液的成分进行探究和处理。
请填空:甲同学取少量废液样品,观察到样品澄清并呈浅蓝色。由此猜想,溶液中可能存在的离子为 。
H+
复习指导 P121 10
P138 7、8
谢谢大家
同课章节目录
