第二节物质转化的规律(第二课时)
图片预览









文档简介
课件31张PPT。第二节 物质转化的规律第二课时自然界中有现成的铁吗? 赤铁矿石
(主要成分Fe2O3)方铅矿(主要成分PbS)孔雀石[主要成分Cu2(OH)2CO3 ]思考:如何得到金属单质?三、金属的冶炼1、定义: 把金属从化合态变成游离态叫金属
的冶炼。2、常用方法:碳等还原剂与金属氧化物在高
温下反应,碳能夺取金属氧化
物的氧,得到游离态的金属。 自然界中少数金属是以游离态(即单质)的形式存在,大多数金属是以化合态(化合物)的形式存在。⑴ 反应物的颜色和状态 ⑵ 生成物的颜色和状态⑶ 石灰水的变化探究一⑴加热一段时间后,发现试管内出现:
_____________________________⑵澄清石灰水变:____________,
说明_____________________________。⑶木炭跟氧化铜反应,生成了____和______。⑷化学方程式:红色物质变浑浊产生的气体是二氧化碳铜二氧化碳C + 2CuO ==== 2Cu + CO2↑高温实验结束时,为什么先移去盛
石灰水的烧杯,后移去酒精灯?思考防止烧杯中的石灰水倒流入
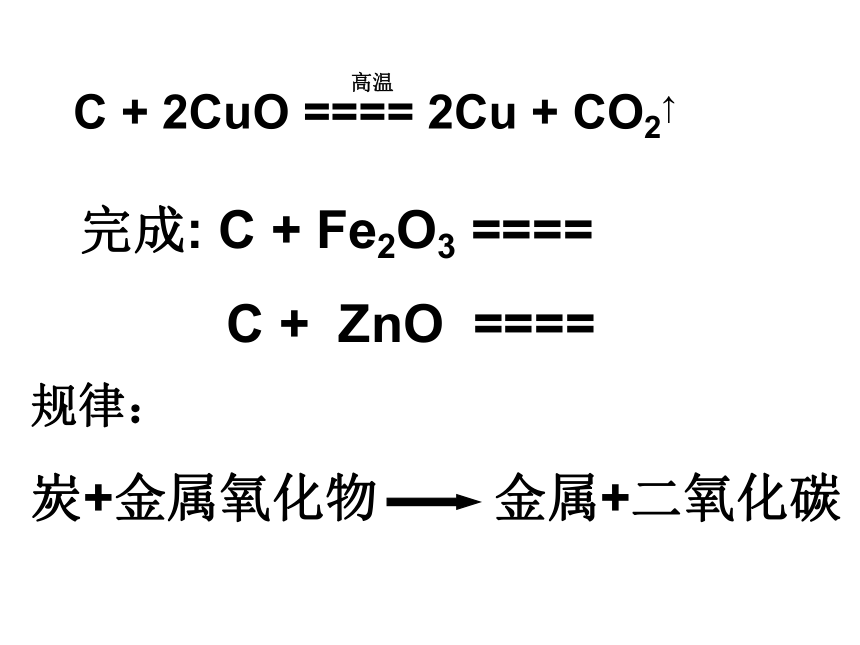
热的试管,使试管破裂 C + 2CuO ==== 2Cu + CO2↑完成: C + Fe2O3 ====
C + ZnO ====高温规律:
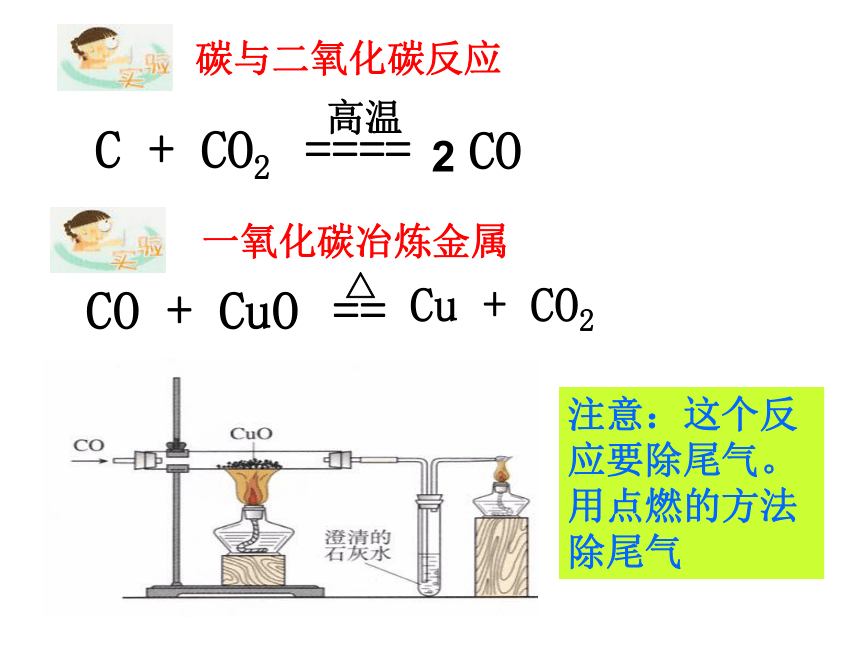
炭+金属氧化物 金属+二氧化碳碳与二氧化碳反应 2CO注意:这个反应要除尾气。用点燃的方法除尾气一氧化碳还原氧化铜CO有毒,反应后的尾气应该如何处理?燃烧法气囊收集法1、先通一氧化碳以排尽空气防止爆炸。2、第二只酒精灯应该先点燃,确保一氧化碳不污染空气。完成:一氧化碳具有炭一样的性质
CO + CuO ——
CO + Fe2O3 ——
CO + Fe3O4 —— △ 高温高温规律:
一氧化碳+金属氧化物 金属+二氧化碳除了C、CO可以还原金属氧化物外,氢气也可以还原金属氧化物。氢气还原氧化铜1、观察孔雀石(主要成份为碱式 碳酸铜)的颜色:___________。
2、孔雀石在加热时有什么变化?___。
3、化学方程式: 绿色固体变黑,
试管壁上有水珠,石灰水变浑浊绿色固体4、通入氢气后,过一会给氧化铜加热。试管中的变化:____________________。试管口有什么生成?____________________。5、反应完成后停止加热,继续通入氢气,直到试管冷却。化学方程式:黑色粉末变红色水珠生成实验:氢气还原氧化铜思考:装置的注意点?1.试管口?
2.铁夹?
3.导管?
4.酒精灯的火焰?思考盛放氧化铜的试管口为什么需略向下倾斜?(2)为什么要先通一会儿氢气,再加热氧化铜?(3)实验停止以后,为什么还要继续通入氢气,
直到试管冷却为止?防止反应生成的水倒流防止氢气与空气混合加热时,试管爆炸防止灼热的铜被空气中的氧气重新氧化成氧化铜(口诀:氢、灯、灯、氢)完成: H2 + CuO ——
3H2 + Fe2O3 ——
3H2 + WO3 ——规律:
氢气 + 金属氧化物 金属 + 水Cu +H2O2Fe +3H2OW +3H2O 化 合 态 金 属
游 离 态 金 属1.氢气2. 炭3.一氧化碳 思考:要将赤铁矿(主要成分为 Fe2O3)冶炼成生铁(主要成分为铁),你有哪些方法?哪种方法制得的铁最纯?请写出化学方程式。3C + 2Fe2O3 ====4Fe +3CO2↑
3CO + Fe2O3 ====2Fe +3CO2↑
3H2 + Fe2O3 ====2Fe +3H2O↑高温高温高温还原剂:具有从含氧化合物里夺取氧的能力,即具有还原性. 还原反应:含氧化合物里的氧被夺取的反应。氧化剂:具有失去氧的能力,即具有氧化性.氧化反应:物质得到氧的反应。3C + 2Fe2O3 ====4Fe +3CO2↑
3CO + Fe2O3 ====2Fe +3CO2↑
3H2 + Fe2O3 ====2Fe +3H2O↑高温高温高温用得失氧分析:△
H2 + CuO ==== H2O + Cu
得氧 被氧化 氧化反应失氧 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性)用得失电子分析:△
H2 + CuO ==== H2O + Cu
失电子 被氧化 氧化反应得电子 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性)
H2 + CuO ==== H2O + Cu
用化合价分析:化合价升高 被氧化 氧化反应化合价降低 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性)C + 2CuO ==== 2Cu + CO2↑高温3C + 2Fe2O3 ====4Fe +3CO2↑
3CO + Fe2O3 ====2Fe +3CO2↑
3H2 + Fe2O3 ====2Fe +3H2O↑高温高温高温Fe+CuSO4=FeSO4+Cu指出氧化剂、还原剂?哪种物质被氧化?金属冶炼的原理:与还原剂共热C、H2、CO1、还原法2、置换法活泼金属比盐中金属活泼总结:思考: 我国是生产钢铁的大国,那么工业是如何把赤铁矿冶炼成金属铁的呢?钢铁是怎样炼成?置换法比还原法优越,因为置换法操作简便,安全,节约原料。铁矿石的冶炼是一个复杂的过程,但它的主要反应原理是在高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。一氧化碳还原氧化铁 在硬质玻璃管里加入少量红棕色的氧化铁粉未,通入一氧化碳,然后加热。观察发生的现象:______
化学方程式:(这个反应是炼铁的原理)红棕色变成黑色
石灰水变浑浊注意:这个反应要除尾气。用点燃的方法除尾气黑色变红色,生成能使石灰水变浑浊的气体黑色变红色,试管口有水珠产生黑色变红色,生成能使石灰水变浑浊的气体红色变黑色,生成能使石灰水变浑浊的气体1.图14所示的是有关物质的相互转化关系,其中E是一种金属氧化物,F是单质,丙是一种有毒气体,G的溶液呈黄色,部分反应条件已略去。 (1)甲起的是 作用;
(2)乙可能是 (写一种即可);
(3)反应③的化学方程式为 ;
(4)反应④在生产、生活中的应用是 。 催化 甲烷(CH4) 除铁锈(或生产FeCl3等,合理即可) 23.(12分)为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究
【对固体猜想】
猜想I:全部是金属铜;
猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;
猜想Ⅳ:除铜外,还含有氧化铜、 。
【进行实验】实验流程见下图:木炭 (1)步骤②包括溶解、 两步操作,它们共同用到的玻璃仪器是烧杯、 。
(2)C的化学式为 ,D的化学式为 ,由此推出固体B中含有 (写化学式),步骤④发生反应的化学方程式为 。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为 ,说明样品中含有 ,则证明猜想 成立;如果溶液A无色,则证明猜想 成立。过滤 玻璃棒 CO2 CuO C和Cu CuSO4 氧化铜 IV Ⅲ
(主要成分Fe2O3)方铅矿(主要成分PbS)孔雀石[主要成分Cu2(OH)2CO3 ]思考:如何得到金属单质?三、金属的冶炼1、定义: 把金属从化合态变成游离态叫金属
的冶炼。2、常用方法:碳等还原剂与金属氧化物在高
温下反应,碳能夺取金属氧化
物的氧,得到游离态的金属。 自然界中少数金属是以游离态(即单质)的形式存在,大多数金属是以化合态(化合物)的形式存在。⑴ 反应物的颜色和状态 ⑵ 生成物的颜色和状态⑶ 石灰水的变化探究一⑴加热一段时间后,发现试管内出现:
_____________________________⑵澄清石灰水变:____________,
说明_____________________________。⑶木炭跟氧化铜反应,生成了____和______。⑷化学方程式:红色物质变浑浊产生的气体是二氧化碳铜二氧化碳C + 2CuO ==== 2Cu + CO2↑高温实验结束时,为什么先移去盛
石灰水的烧杯,后移去酒精灯?思考防止烧杯中的石灰水倒流入
热的试管,使试管破裂 C + 2CuO ==== 2Cu + CO2↑完成: C + Fe2O3 ====
C + ZnO ====高温规律:
炭+金属氧化物 金属+二氧化碳碳与二氧化碳反应 2CO注意:这个反应要除尾气。用点燃的方法除尾气一氧化碳还原氧化铜CO有毒,反应后的尾气应该如何处理?燃烧法气囊收集法1、先通一氧化碳以排尽空气防止爆炸。2、第二只酒精灯应该先点燃,确保一氧化碳不污染空气。完成:一氧化碳具有炭一样的性质
CO + CuO ——
CO + Fe2O3 ——
CO + Fe3O4 —— △ 高温高温规律:
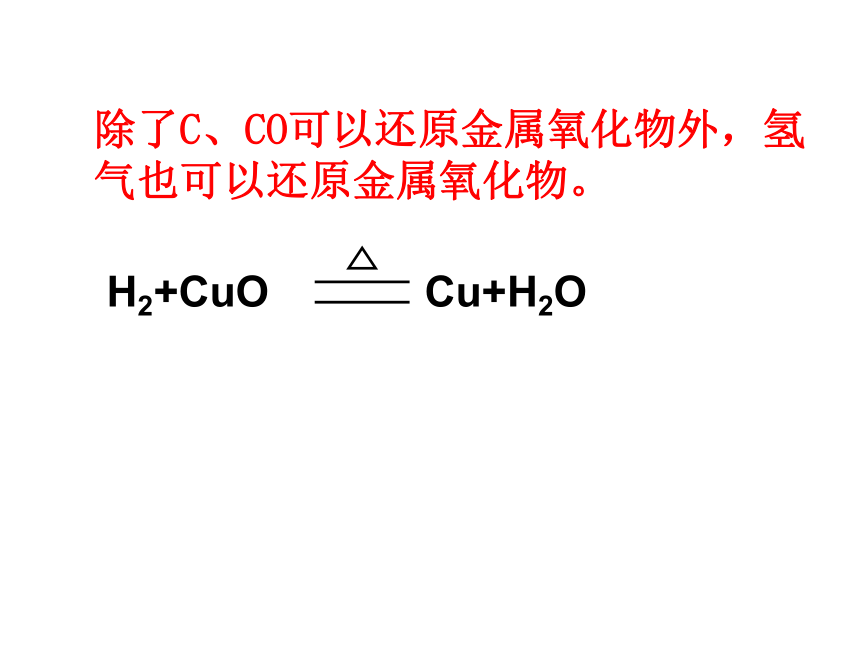
一氧化碳+金属氧化物 金属+二氧化碳除了C、CO可以还原金属氧化物外,氢气也可以还原金属氧化物。氢气还原氧化铜1、观察孔雀石(主要成份为碱式 碳酸铜)的颜色:___________。
2、孔雀石在加热时有什么变化?___。
3、化学方程式: 绿色固体变黑,
试管壁上有水珠,石灰水变浑浊绿色固体4、通入氢气后,过一会给氧化铜加热。试管中的变化:____________________。试管口有什么生成?____________________。5、反应完成后停止加热,继续通入氢气,直到试管冷却。化学方程式:黑色粉末变红色水珠生成实验:氢气还原氧化铜思考:装置的注意点?1.试管口?
2.铁夹?
3.导管?
4.酒精灯的火焰?思考盛放氧化铜的试管口为什么需略向下倾斜?(2)为什么要先通一会儿氢气,再加热氧化铜?(3)实验停止以后,为什么还要继续通入氢气,
直到试管冷却为止?防止反应生成的水倒流防止氢气与空气混合加热时,试管爆炸防止灼热的铜被空气中的氧气重新氧化成氧化铜(口诀:氢、灯、灯、氢)完成: H2 + CuO ——
3H2 + Fe2O3 ——
3H2 + WO3 ——规律:
氢气 + 金属氧化物 金属 + 水Cu +H2O2Fe +3H2OW +3H2O 化 合 态 金 属
游 离 态 金 属1.氢气2. 炭3.一氧化碳 思考:要将赤铁矿(主要成分为 Fe2O3)冶炼成生铁(主要成分为铁),你有哪些方法?哪种方法制得的铁最纯?请写出化学方程式。3C + 2Fe2O3 ====4Fe +3CO2↑
3CO + Fe2O3 ====2Fe +3CO2↑
3H2 + Fe2O3 ====2Fe +3H2O↑高温高温高温还原剂:具有从含氧化合物里夺取氧的能力,即具有还原性. 还原反应:含氧化合物里的氧被夺取的反应。氧化剂:具有失去氧的能力,即具有氧化性.氧化反应:物质得到氧的反应。3C + 2Fe2O3 ====4Fe +3CO2↑
3CO + Fe2O3 ====2Fe +3CO2↑
3H2 + Fe2O3 ====2Fe +3H2O↑高温高温高温用得失氧分析:△
H2 + CuO ==== H2O + Cu
得氧 被氧化 氧化反应失氧 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性)用得失电子分析:△
H2 + CuO ==== H2O + Cu
失电子 被氧化 氧化反应得电子 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性)
H2 + CuO ==== H2O + Cu
用化合价分析:化合价升高 被氧化 氧化反应化合价降低 被还原 还原反应 还原剂
(还原性) 氧化剂
(氧化性)C + 2CuO ==== 2Cu + CO2↑高温3C + 2Fe2O3 ====4Fe +3CO2↑
3CO + Fe2O3 ====2Fe +3CO2↑
3H2 + Fe2O3 ====2Fe +3H2O↑高温高温高温Fe+CuSO4=FeSO4+Cu指出氧化剂、还原剂?哪种物质被氧化?金属冶炼的原理:与还原剂共热C、H2、CO1、还原法2、置换法活泼金属比盐中金属活泼总结:思考: 我国是生产钢铁的大国,那么工业是如何把赤铁矿冶炼成金属铁的呢?钢铁是怎样炼成?置换法比还原法优越,因为置换法操作简便,安全,节约原料。铁矿石的冶炼是一个复杂的过程,但它的主要反应原理是在高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。一氧化碳还原氧化铁 在硬质玻璃管里加入少量红棕色的氧化铁粉未,通入一氧化碳,然后加热。观察发生的现象:______
化学方程式:(这个反应是炼铁的原理)红棕色变成黑色
石灰水变浑浊注意:这个反应要除尾气。用点燃的方法除尾气黑色变红色,生成能使石灰水变浑浊的气体黑色变红色,试管口有水珠产生黑色变红色,生成能使石灰水变浑浊的气体红色变黑色,生成能使石灰水变浑浊的气体1.图14所示的是有关物质的相互转化关系,其中E是一种金属氧化物,F是单质,丙是一种有毒气体,G的溶液呈黄色,部分反应条件已略去。 (1)甲起的是 作用;
(2)乙可能是 (写一种即可);
(3)反应③的化学方程式为 ;
(4)反应④在生产、生活中的应用是 。 催化 甲烷(CH4) 除铁锈(或生产FeCl3等,合理即可) 23.(12分)为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究
【对固体猜想】
猜想I:全部是金属铜;
猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;
猜想Ⅳ:除铜外,还含有氧化铜、 。
【进行实验】实验流程见下图:木炭 (1)步骤②包括溶解、 两步操作,它们共同用到的玻璃仪器是烧杯、 。
(2)C的化学式为 ,D的化学式为 ,由此推出固体B中含有 (写化学式),步骤④发生反应的化学方程式为 。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为 ,说明样品中含有 ,则证明猜想 成立;如果溶液A无色,则证明猜想 成立。过滤 玻璃棒 CO2 CuO C和Cu CuSO4 氧化铜 IV Ⅲ
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
