第一章酸碱盐第二节重要的酸复习
图片预览









文档简介
课件30张PPT。重要的酸复习一、盐酸(HCl)的物理性质1.盐酸(HCl)是氯化氢的水溶液。常用的浓盐酸中溶质的质量分数为37% ~ 38%,密度为1·19克/厘米3。2·纯净的盐酸是无色透明的液体,工业用盐酸因含有FeCl3等杂质而常呈黄色。3·打开浓盐酸的试剂瓶,会挥发出有刺激性气味的气体,在瓶口有白雾形成,因此浓盐酸具有挥发性。[思考]打开浓盐酸瓶塞,瓶口看到了白雾,白雾是如何形成的?如果浓盐酸敞口放置,会发生什么变化? 答:打开浓盐酸瓶塞时,瓶口看到的白雾是盐酸的小液滴,它是挥发出来的氯化氢气体跟空气中的水蒸气接触而形成的。
如果浓盐酸敞口放置,由于浓盐酸具有挥发性,因而会导致溶液质量和溶液中溶质的质量分数都减小。 二、硫酸的物理性质1、纯硫酸是无色、粘稠、油状的液体 纯硫酸是无色粘稠油状液体, 难挥发,密度较大,约为1.84g/cm3 ,可与水互溶。常用的浓硫酸质量分数是98%.2 、浓硫酸易溶于水,溶解时放出大量的热 在稀释浓硫酸时,必须把浓硫酸慢慢地沿玻璃棒或容器壁倒入水里,并不时地搅拌,切不可把水倒进浓硫酸里。三.浓硫酸具有吸水性 浓硫酸如果敞口放置,会发生什么变化?根据这一性质,它在实验室有什么用途? 浓硫酸如果敞口放置,由于它具有吸水性,会吸收空气中的水分,会导致溶液的质量增加,而溶液的溶质质量分数减小.根据这一性质,在实验室中,浓硫酸可用作干燥剂。浓硫酸能干燥:H2、O2、SO2、Cl2、HCl、CO2 等不与浓硫酸发生反应的气体四.浓硫酸具有脱水性. 注意:
浓硫酸具有很强的腐蚀性,实验时应十分小心. 如果皮肤或衣服上不小心沾了浓硫酸,怎样处理? 如果在实验时,浓硫酸不慎溅到皮肤上,先用干布擦去,然后用大量水冲洗,最后用小苏打溶液冲洗,严重时立即送医院.思考分析:
浓硫酸的脱水性与吸水性相同吗?吸水性:是浓硫酸直接与水分子作用。脱水性:是浓硫酸夺取有机物中氢、氧
元素(2:1),生成水。关于硝酸:1.浓硝酸和浓盐酸一样具有挥发性.2.浓硝酸具有腐蚀性.3.浓硝酸见光分解,故实验室中浓硝酸应盛放在棕色瓶子内.酸的通性:
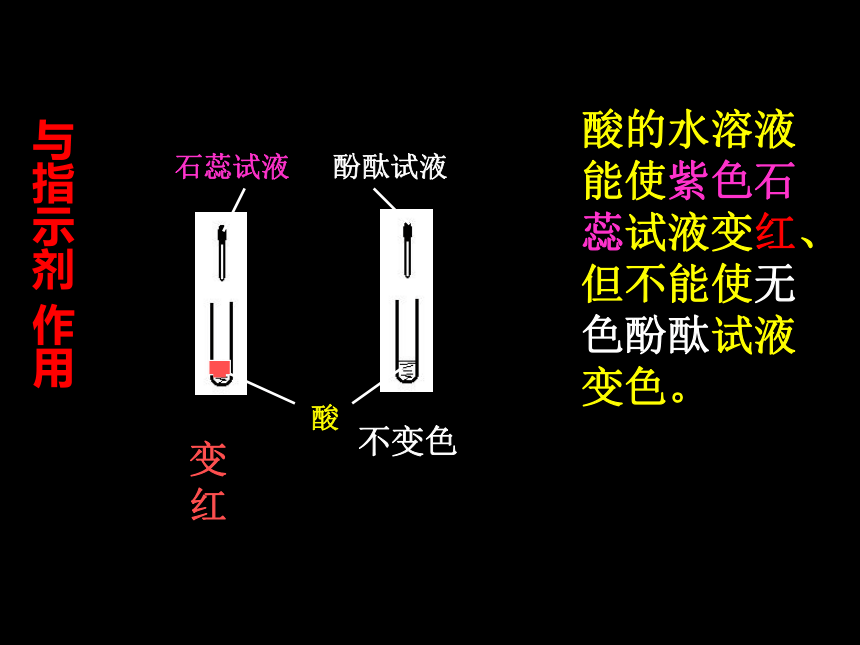
(1)酸溶液能跟酸碱指示剂反应
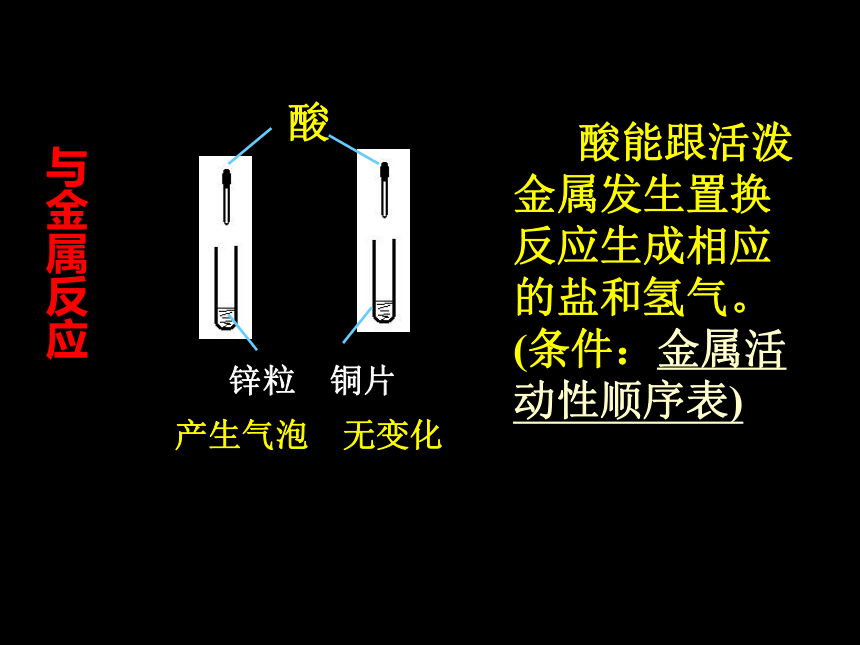
(2)酸+活泼金属→ 盐+氢气
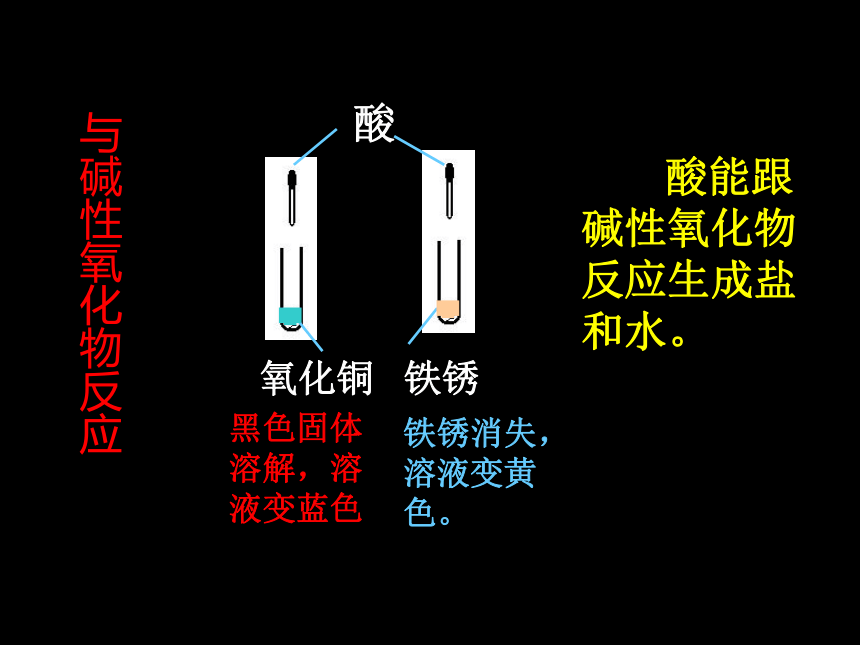
(3)酸+碱性氧化物→ 盐+水
(4)酸+碱→ 盐+水
(5)酸+盐→ 另一种酸+另一种盐石蕊试液 酚酞试液酸变红不变色 酸的水溶液能使紫色石蕊试液变红、但不能使无色酚酞试液变色。与指示剂 作用锌粒 铜片产生气泡 无变化 酸能跟活泼金属发生置换反应生成相应的盐和氢气。(条件:金属活动性顺序表)与金属反应氧化铜 铁锈 酸能跟碱性氧化物反应生成盐和水。黑色固体溶解,溶液变蓝色铁锈消失,溶液变黄色。与碱性氧化物反应酸氢氧化铜 氢氧化铁得到蓝 色溶液 得到黄色溶液 酸能与碱发生中和反应生成盐和水与碱反应酸碳酸钠溶液产生能使澄清的石灰水变浑浊的气体酸能和某些盐发生复分解反应生成新酸和新盐与盐反应酸的通性
1.酸能使紫色石蕊试液变红, 使无色酚酞试 液不变色.
2.酸能与某些活泼金属发生置换反应,生成相应的盐和氢气.
3.酸能与碱性氧化物反应,生成 盐和水
4.酸能与碱发生中和反应,生成盐和水
5.酸能与某些盐发生 复分解 反应,生成新酸和新盐 酸的用途:
(1)制氢气(与活泼金属反应)
(2)金属表面除锈(与碱性氧化物反应)
(3)制醋酸(与盐反应)
(4)浓硫酸 用作干燥剂(吸水性)
(5)治理盐碱地(中和反应)
(6)其它用途: 制农药、化肥、石油工业、化工生产、尖端科学等。氯化钡溶液 稀硝酸 酸 产生白色沉淀 沉淀不溶解 H2SO4+BaCl2=BaSO4↓+2HCl 硫酸和盐酸的鉴别 酸硝酸银溶液产生白色沉淀稀硝酸 沉淀不溶解HCl+AgNO3=AgCl↓+HNO31、用浓硫酸作某些气体的干燥剂,是因为浓硫酸具有( )
A.脱水性 B.酸性
C.吸水性 D.强腐蚀性C 2、在空气中打开试剂瓶瓶塞时,瓶口有白雾生成的是 ( )AA.浓盐酸 B.浓硫酸
C.酒精 D.蒸馏水3、稀硫酸和稀盐酸有相似的化学性质,这主要取决于( )
A、都能与指示剂作用
B、都能与碱中和
C、都能电离出氢离子
D、都能电离出酸根离子 C判断下列能否发生置换反应?写出有关化学方程式。
1. Mg+HCl 2. Cu+HCl
3. Al+H2SO4 4. Zn+HNO3
6. Fe+H2SO4Mg+2HCl=MgCl2+H2↑铜在氢后不反应2Al+3H2SO4 =
Al2(SO4)3 + H2↑硝酸有强氧化性,不是置换反应Fe+H2SO4=FeSO4+H2↑1、金属跟酸能否发生反应,是根据金属活动性顺序来判断;
2、单质铁和盐酸、稀硫酸发生置换反应,生成亚铁盐;
3、金属跟氧化性很强的酸(如:HNO3 、浓 H2SO4)反应时,一般不生成氢气。我会总结练一练判断下列反应能否发生,能反应的写出化学方程式,不能的说出简明理由。
(1)HNO3+KOH (2)H2SO4+Ba(NO3)2
(3)HCl+KNO3 (4)H2SO4+Na2CO3=KNO3+H2O=BaSO4↓+2HNO3不反应=Na2SO4+H2O+CO2↑1、物质的制取:练习一、根据酸的化学性质,写出用四种不同方法制备ZnCl2、MgSO4的化学方程式。
练习二、写出实验室制取氢气、二氧化碳的化学方程式。 Zn + 2HCl = ZnCl2 + H2 ↑
ZnO + 2HCl = ZnCl2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
ZnCO3 + 2HCl = ZnCl2 + H2O + CO2 ↑2、物质的检验:练一练如何验证生石灰中是否含有未分解的石灰石?答:取少量待测样品,滴入适量稀盐酸,将生成的气体通入澄清石灰水中,澄清石灰水若变浑浊,即证明该生石灰中含有石灰石。如何检验溶液里是否存在Cl-和SO42-? 答:取少量待测样品,滴入足量硝酸钡溶液和稀硝酸,若有不溶于稀硝酸的白色沉淀生成,则溶液里存在SO42-;将沉淀过滤,取少量滤液,滴入适量硝酸银溶液和稀硝酸,若有不溶于稀硝酸的白色沉淀生成,则溶液里存在Cl-。想一想:可不可以先检验Cl-?3、物质的除杂: 选择合适的试剂,除去方括号内的杂质,并写出化学方程式:
Cu[Zn]
HNO3[HCl]
NaCl[NaOH]
Cu[CuO]
HCl[H2SO4] Zn+H2SO4=ZnSO4+H2↑HCl+AgNO3=AgCl↓+HNO3NaOH+HCl=NaCl+H2OCuO+H2SO4=CuSO4+H2OH2SO4+BaCl2=BaSO4↓+2HCl我会总结解答除杂类题型的注意事项:“不增”:不增加新的杂质。“不减”:不能把主要成分反应掉。“易分离”:生成物中最好有容易
分离的沉淀或气体或水等物质。金属活动性顺序K Ca Na Mg Al Zn Fe Sn Pb
(H) Cu Hg Ag Pt Au意义:在金属活动性顺序中,越排在前面的金属,活动性越强,在水溶液中越容易失去电子变成离子.应用:排在氢前面的金属能置换出酸中的氢.复分解反应
由两种化合物互相交换成分,生成另外两种化合物的反应。
条件:生成物中有气体、沉淀或水。
如果浓盐酸敞口放置,由于浓盐酸具有挥发性,因而会导致溶液质量和溶液中溶质的质量分数都减小。 二、硫酸的物理性质1、纯硫酸是无色、粘稠、油状的液体 纯硫酸是无色粘稠油状液体, 难挥发,密度较大,约为1.84g/cm3 ,可与水互溶。常用的浓硫酸质量分数是98%.2 、浓硫酸易溶于水,溶解时放出大量的热 在稀释浓硫酸时,必须把浓硫酸慢慢地沿玻璃棒或容器壁倒入水里,并不时地搅拌,切不可把水倒进浓硫酸里。三.浓硫酸具有吸水性 浓硫酸如果敞口放置,会发生什么变化?根据这一性质,它在实验室有什么用途? 浓硫酸如果敞口放置,由于它具有吸水性,会吸收空气中的水分,会导致溶液的质量增加,而溶液的溶质质量分数减小.根据这一性质,在实验室中,浓硫酸可用作干燥剂。浓硫酸能干燥:H2、O2、SO2、Cl2、HCl、CO2 等不与浓硫酸发生反应的气体四.浓硫酸具有脱水性. 注意:
浓硫酸具有很强的腐蚀性,实验时应十分小心. 如果皮肤或衣服上不小心沾了浓硫酸,怎样处理? 如果在实验时,浓硫酸不慎溅到皮肤上,先用干布擦去,然后用大量水冲洗,最后用小苏打溶液冲洗,严重时立即送医院.思考分析:
浓硫酸的脱水性与吸水性相同吗?吸水性:是浓硫酸直接与水分子作用。脱水性:是浓硫酸夺取有机物中氢、氧
元素(2:1),生成水。关于硝酸:1.浓硝酸和浓盐酸一样具有挥发性.2.浓硝酸具有腐蚀性.3.浓硝酸见光分解,故实验室中浓硝酸应盛放在棕色瓶子内.酸的通性:
(1)酸溶液能跟酸碱指示剂反应
(2)酸+活泼金属→ 盐+氢气
(3)酸+碱性氧化物→ 盐+水
(4)酸+碱→ 盐+水
(5)酸+盐→ 另一种酸+另一种盐石蕊试液 酚酞试液酸变红不变色 酸的水溶液能使紫色石蕊试液变红、但不能使无色酚酞试液变色。与指示剂 作用锌粒 铜片产生气泡 无变化 酸能跟活泼金属发生置换反应生成相应的盐和氢气。(条件:金属活动性顺序表)与金属反应氧化铜 铁锈 酸能跟碱性氧化物反应生成盐和水。黑色固体溶解,溶液变蓝色铁锈消失,溶液变黄色。与碱性氧化物反应酸氢氧化铜 氢氧化铁得到蓝 色溶液 得到黄色溶液 酸能与碱发生中和反应生成盐和水与碱反应酸碳酸钠溶液产生能使澄清的石灰水变浑浊的气体酸能和某些盐发生复分解反应生成新酸和新盐与盐反应酸的通性
1.酸能使紫色石蕊试液变红, 使无色酚酞试 液不变色.
2.酸能与某些活泼金属发生置换反应,生成相应的盐和氢气.
3.酸能与碱性氧化物反应,生成 盐和水
4.酸能与碱发生中和反应,生成盐和水
5.酸能与某些盐发生 复分解 反应,生成新酸和新盐 酸的用途:
(1)制氢气(与活泼金属反应)
(2)金属表面除锈(与碱性氧化物反应)
(3)制醋酸(与盐反应)
(4)浓硫酸 用作干燥剂(吸水性)
(5)治理盐碱地(中和反应)
(6)其它用途: 制农药、化肥、石油工业、化工生产、尖端科学等。氯化钡溶液 稀硝酸 酸 产生白色沉淀 沉淀不溶解 H2SO4+BaCl2=BaSO4↓+2HCl 硫酸和盐酸的鉴别 酸硝酸银溶液产生白色沉淀稀硝酸 沉淀不溶解HCl+AgNO3=AgCl↓+HNO31、用浓硫酸作某些气体的干燥剂,是因为浓硫酸具有( )
A.脱水性 B.酸性
C.吸水性 D.强腐蚀性C 2、在空气中打开试剂瓶瓶塞时,瓶口有白雾生成的是 ( )AA.浓盐酸 B.浓硫酸
C.酒精 D.蒸馏水3、稀硫酸和稀盐酸有相似的化学性质,这主要取决于( )
A、都能与指示剂作用
B、都能与碱中和
C、都能电离出氢离子
D、都能电离出酸根离子 C判断下列能否发生置换反应?写出有关化学方程式。
1. Mg+HCl 2. Cu+HCl
3. Al+H2SO4 4. Zn+HNO3
6. Fe+H2SO4Mg+2HCl=MgCl2+H2↑铜在氢后不反应2Al+3H2SO4 =
Al2(SO4)3 + H2↑硝酸有强氧化性,不是置换反应Fe+H2SO4=FeSO4+H2↑1、金属跟酸能否发生反应,是根据金属活动性顺序来判断;
2、单质铁和盐酸、稀硫酸发生置换反应,生成亚铁盐;
3、金属跟氧化性很强的酸(如:HNO3 、浓 H2SO4)反应时,一般不生成氢气。我会总结练一练判断下列反应能否发生,能反应的写出化学方程式,不能的说出简明理由。
(1)HNO3+KOH (2)H2SO4+Ba(NO3)2
(3)HCl+KNO3 (4)H2SO4+Na2CO3=KNO3+H2O=BaSO4↓+2HNO3不反应=Na2SO4+H2O+CO2↑1、物质的制取:练习一、根据酸的化学性质,写出用四种不同方法制备ZnCl2、MgSO4的化学方程式。
练习二、写出实验室制取氢气、二氧化碳的化学方程式。 Zn + 2HCl = ZnCl2 + H2 ↑
ZnO + 2HCl = ZnCl2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
ZnCO3 + 2HCl = ZnCl2 + H2O + CO2 ↑2、物质的检验:练一练如何验证生石灰中是否含有未分解的石灰石?答:取少量待测样品,滴入适量稀盐酸,将生成的气体通入澄清石灰水中,澄清石灰水若变浑浊,即证明该生石灰中含有石灰石。如何检验溶液里是否存在Cl-和SO42-? 答:取少量待测样品,滴入足量硝酸钡溶液和稀硝酸,若有不溶于稀硝酸的白色沉淀生成,则溶液里存在SO42-;将沉淀过滤,取少量滤液,滴入适量硝酸银溶液和稀硝酸,若有不溶于稀硝酸的白色沉淀生成,则溶液里存在Cl-。想一想:可不可以先检验Cl-?3、物质的除杂: 选择合适的试剂,除去方括号内的杂质,并写出化学方程式:
Cu[Zn]
HNO3[HCl]
NaCl[NaOH]
Cu[CuO]
HCl[H2SO4] Zn+H2SO4=ZnSO4+H2↑HCl+AgNO3=AgCl↓+HNO3NaOH+HCl=NaCl+H2OCuO+H2SO4=CuSO4+H2OH2SO4+BaCl2=BaSO4↓+2HCl我会总结解答除杂类题型的注意事项:“不增”:不增加新的杂质。“不减”:不能把主要成分反应掉。“易分离”:生成物中最好有容易
分离的沉淀或气体或水等物质。金属活动性顺序K Ca Na Mg Al Zn Fe Sn Pb
(H) Cu Hg Ag Pt Au意义:在金属活动性顺序中,越排在前面的金属,活动性越强,在水溶液中越容易失去电子变成离子.应用:排在氢前面的金属能置换出酸中的氢.复分解反应
由两种化合物互相交换成分,生成另外两种化合物的反应。
条件:生成物中有气体、沉淀或水。
