第二节 等容变化和等压变化
文档属性
| 名称 | 第二节 等容变化和等压变化 |

|
|
| 格式 | zip | ||
| 文件大小 | 24.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2018-03-29 00:00:00 | ||
图片预览




文档简介
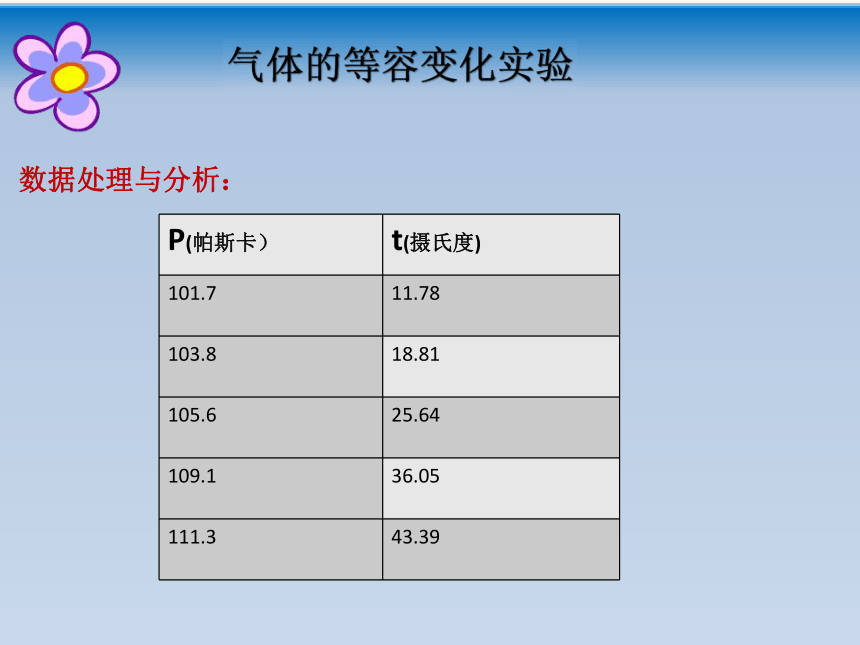
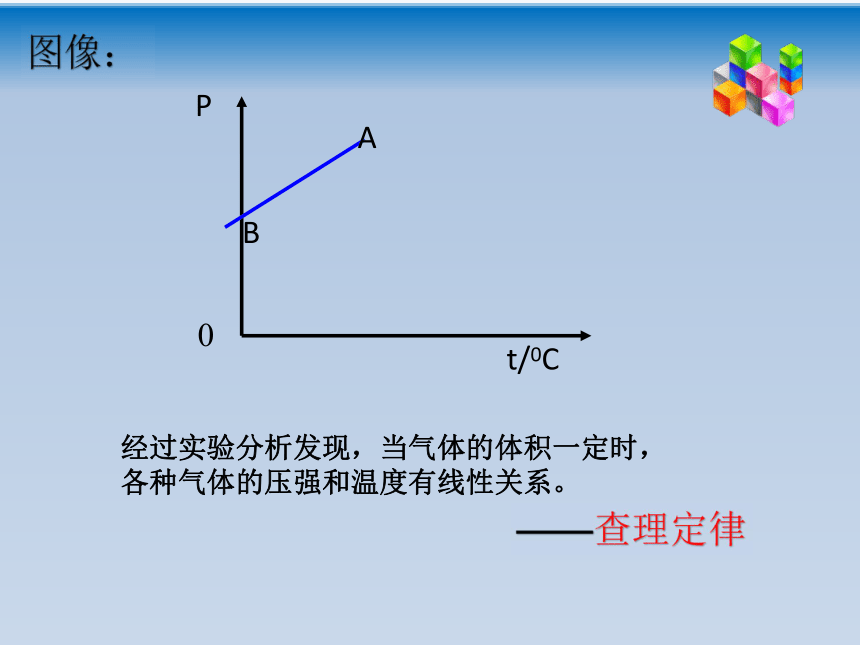
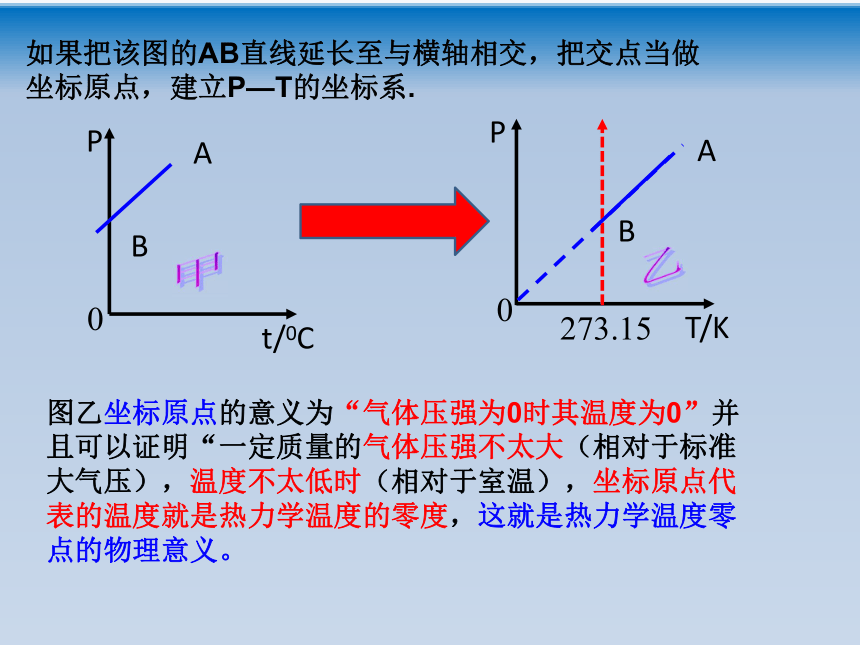
课件18张PPT。回顾: 文字表述:一定质量的某种气体,在温度不变的情况下,压强P与体积V成反比。玻意耳定律 表达式: PV=C (C为常量) 成立条件:一定质量的气体,温度不变。 适用范围:压强不太大,温度不太低。(相对于标准大气压、常温状况)控制体积不变或压强不变,其他两个状态参量之间有什么样的关系呢?第二节 气体的等容变化和 等压变化——查理定律、盖·吕萨克定律一、气体的等容变化一定质量的气体,在体积不变的情况下其压强随温度的变化叫做等容变化。思考:装有一定气体的玻璃瓶用涂油的橡胶塞塞紧,加热玻璃瓶,大家预测下会发生什么现象?瓶内气体受热膨胀,气体体积不变,温度升高,瓶内压强变大。气体的等容变化实验气体的等容变化实验数据处理与分析:经过实验分析发现,当气体的体积一定时,各种气体的压强和温度有线性关系。图像:——查理定律如果把该图的AB直线延长至与横轴相交,把交点当做坐标原点,建立P—T的坐标系.图乙坐标原点的意义为“气体压强为0时其温度为0”并且可以证明“一定质量的气体压强不太大(相对于标准大气压),温度不太低时(相对于室温),坐标原点代表的温度就是热力学温度的零度,这就是热力学温度零点的物理意义。注意:摄氏温度的00C时的压强不是0,而热力学温标的0k时的压强为0Pa。查理定律文字表述:一定质量的某种气体,在体积不变的情况下,压强p与热力学温度T成正比。
在P—T图中通过坐标原点的直线叫做等容线文字表述:一定质量的某种气体,在体积不变的情况下,压强 P与热力学温度T成正比。 表达式: 成立条件:一定质量的气体,体积不变。 适用范围:压强不太大,温度不太低。查理定律①查理定律是实验定律,由法国科学家查理通过实验发现的.
②在p/T=C中的C与气体的种类、质量、体积有关.
注意:p与热力学温度T成正比,不与摄氏温度成正比,但压强的变化?p与摄氏温度?t的变化成正比.
一定质量的气体在等容时,升高(或降低)相同的温度,所增加(或减小)的压强是相同的.
③解题时前后两状态压强的单位要相同,温度必须取国际单位制单位开尔文(K)注意事项:二、气体的等压变化一定质量的气体,在压强不变的情况下其体积随温度的变化叫做等压变化。气体的等压变化实验经过大量的实验研究得出:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比——盖—吕萨克定律在V—T图中通过坐标原点的直线叫做等压线二、气体的等压变化V=CT或盖—吕萨克定律文字表述:一定质量的某种气体,在压强不变的情况下,体积V 与热力学温度T成正比。 表达式: 成立条件:一定质量的气体,温度不变。 适用范围:压强不太大,温度不太低。V/T=C①盖·吕萨克定律是实验定律,由法国科学家盖·吕萨克通过实验发现的.
②在 V/T=C 中的C与气体的种类、质量、压强有关.
注意: V正比于T而不正比于t,但 ?V??t
③ 温度单位必须转化成热力学温度的单位;解题时前后两状态的体积单位要统一.(5)注意事项:-27301. 由查理定律可知,一定质量的理想气体在体积不变时,它的压强随温度变化关系如图中实线表示。把这个结论进行合理外推,便可得出图中t0= ℃;如果温度能降低到t0,那么气体的压强将减小到 Pa。2.一定质量的氢气在00C时的压强为9 ×104Pa,保持氢气体积不变,它在300C时的压强多大?分析:选一定质量的氢气为研究对象,状态变化是气体的等容变化,应用查理定律解题,须特注的是在应用查理定律解题,确定气体变化的初、末状态时要注意将温度的单位转换成热力学温度。本例提醒特注:在应用查理定律和盖·吕萨克定律解题前,确定气体变化的初、末状态时一定要将温度的单位转换成热力学温度。3、某种气体在状态A时压强2×105Pa,体积为1m3,温度为200K。(1)它在等温过程中由状态A变为状态B,状态B 的体积为2m3,求状态B 的压强.(2)随后,又由状态B 在等容过程中变为状态C ,状态C 的温度为300K,求状态C 的压强.解(1)气体由状态A 变为状态B 的过程遵从玻意耳定律.
由pAVA= PBVB, 得状态B的压强 PB=105Pa
(2)气体由状态B变为状态C的过程遵从查理定律.
由 pc=1.5×105Pa
在P—T图中通过坐标原点的直线叫做等容线文字表述:一定质量的某种气体,在体积不变的情况下,压强 P与热力学温度T成正比。 表达式: 成立条件:一定质量的气体,体积不变。 适用范围:压强不太大,温度不太低。查理定律①查理定律是实验定律,由法国科学家查理通过实验发现的.
②在p/T=C中的C与气体的种类、质量、体积有关.
注意:p与热力学温度T成正比,不与摄氏温度成正比,但压强的变化?p与摄氏温度?t的变化成正比.
一定质量的气体在等容时,升高(或降低)相同的温度,所增加(或减小)的压强是相同的.
③解题时前后两状态压强的单位要相同,温度必须取国际单位制单位开尔文(K)注意事项:二、气体的等压变化一定质量的气体,在压强不变的情况下其体积随温度的变化叫做等压变化。气体的等压变化实验经过大量的实验研究得出:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比——盖—吕萨克定律在V—T图中通过坐标原点的直线叫做等压线二、气体的等压变化V=CT或盖—吕萨克定律文字表述:一定质量的某种气体,在压强不变的情况下,体积V 与热力学温度T成正比。 表达式: 成立条件:一定质量的气体,温度不变。 适用范围:压强不太大,温度不太低。V/T=C①盖·吕萨克定律是实验定律,由法国科学家盖·吕萨克通过实验发现的.
②在 V/T=C 中的C与气体的种类、质量、压强有关.
注意: V正比于T而不正比于t,但 ?V??t
③ 温度单位必须转化成热力学温度的单位;解题时前后两状态的体积单位要统一.(5)注意事项:-27301. 由查理定律可知,一定质量的理想气体在体积不变时,它的压强随温度变化关系如图中实线表示。把这个结论进行合理外推,便可得出图中t0= ℃;如果温度能降低到t0,那么气体的压强将减小到 Pa。2.一定质量的氢气在00C时的压强为9 ×104Pa,保持氢气体积不变,它在300C时的压强多大?分析:选一定质量的氢气为研究对象,状态变化是气体的等容变化,应用查理定律解题,须特注的是在应用查理定律解题,确定气体变化的初、末状态时要注意将温度的单位转换成热力学温度。本例提醒特注:在应用查理定律和盖·吕萨克定律解题前,确定气体变化的初、末状态时一定要将温度的单位转换成热力学温度。3、某种气体在状态A时压强2×105Pa,体积为1m3,温度为200K。(1)它在等温过程中由状态A变为状态B,状态B 的体积为2m3,求状态B 的压强.(2)随后,又由状态B 在等容过程中变为状态C ,状态C 的温度为300K,求状态C 的压强.解(1)气体由状态A 变为状态B 的过程遵从玻意耳定律.
由pAVA= PBVB, 得状态B的压强 PB=105Pa
(2)气体由状态B变为状态C的过程遵从查理定律.
由 pc=1.5×105Pa
