高中化学人教版必修一第一章第1节物质的量浓度 误差分析
文档属性
| 名称 | 高中化学人教版必修一第一章第1节物质的量浓度 误差分析 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-31 22:11:36 | ||
图片预览






文档简介
课件22张PPT。物质的量浓度溶液配制中的问题讨论 1、物质的量浓度:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量。
单位: mol / L 符号:CB
物质的量浓度=
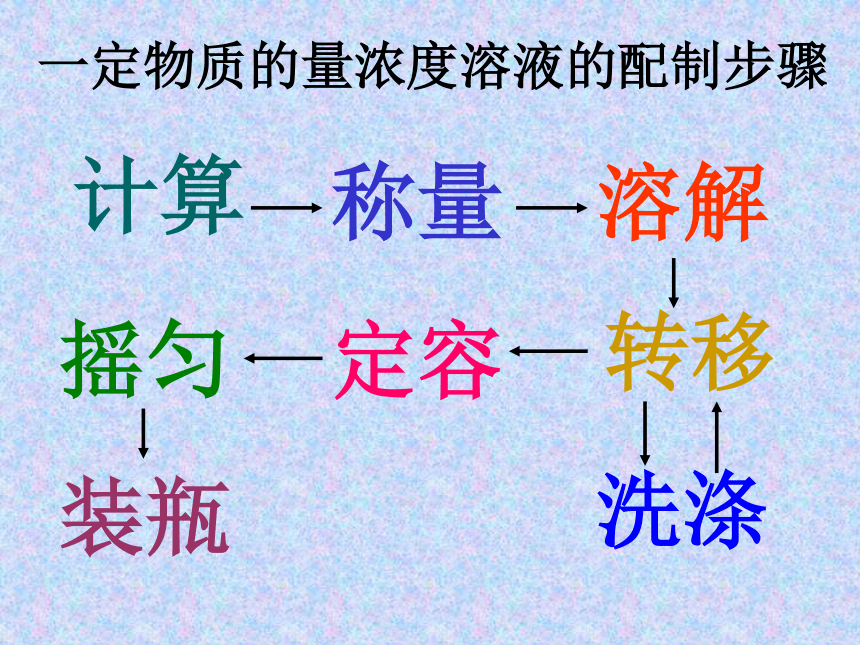
(mol/L)一定物质的量浓度溶液的配制步骤计算称量溶解转移洗涤定容摇匀装瓶思考与交流1、以硫酸为例,讨论不同浓度的溶液在性质上可能会出现什么差异呢?
2、将5mL浓硫酸稀释为20mL稀硫酸,得到的稀硫酸与原浓硫酸所含的H2SO4的物质的量相等吗?c(浓溶液) ·V(浓溶液) = c(稀溶液) ·V(稀溶液) 稀释浓溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即稀释前后,溶液中溶质的物质的量相等如何用浓硫酸配制一定物质的量浓度的稀硫酸溶液?
用20mol/L的浓硫酸配制250mL1mol/L的稀硫酸。用量筒量取_____mL浓硫酸,把 缓缓注入到 中,并用 不断搅拌,待溶
液 后,将溶液沿着玻璃棒移入_______
中,用少量蒸馏水洗涤___ 和______ 2~3次,将洗
涤液移入_____ 中,向容量瓶中注入蒸馏水至刻度线
_________ 时,改用______ 小心加水至溶液凹液
面最低点与刻度线相切,最后盖好瓶塞___ _,
将配好的溶液转移到_________ 中并贴好标签。
12.5浓硫酸小烧杯玻璃棒冷却250mL容量瓶_烧杯玻璃棒容量瓶2~3cm处胶头滴管反复倒转几次_细口试剂瓶配制一定物质的量浓度的溶液的误差分析 浓度误差的判断方法是将称量(或量取)
误差和定容误差纳入公式c=
= ,由m(B)和V判断误差。 Ⅰ V一定:n偏大,c偏 ;n偏小,c偏 。
Ⅱ n一定:V偏小,c偏 ;V偏大,c偏 。配制100mL 0.1 mol/L CuSO4 溶液计算:如果用五水硫酸铜晶体配制,计算结果应是1.6g,还是2.5g?m (CuSO4) =0.1L×0.1mol/L×160 g/mol = 1.6 g m (CuSO4.5H2O) =0.1L×0.1 mol/L×250 g/mol = 2.5g计算不正确对溶液浓度的影响:
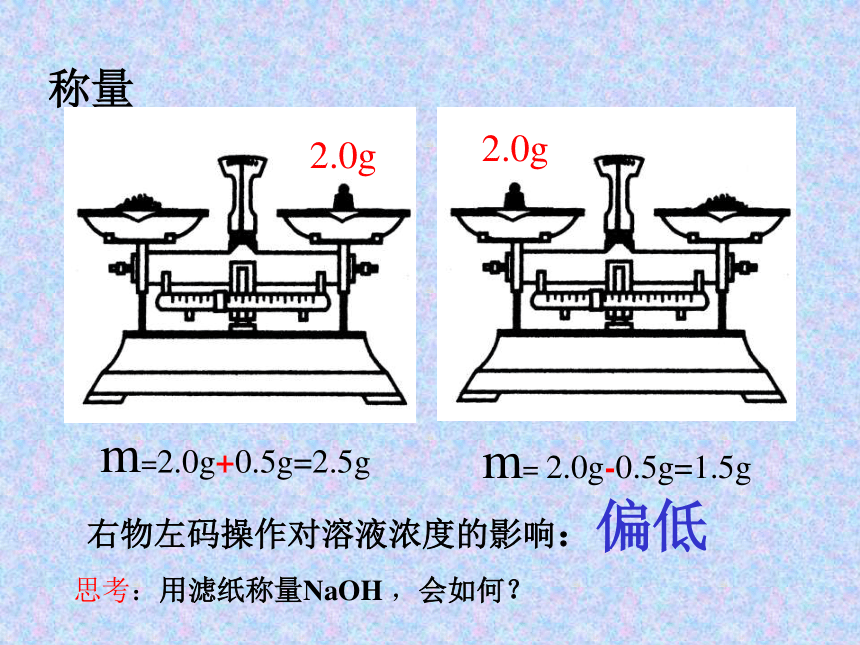
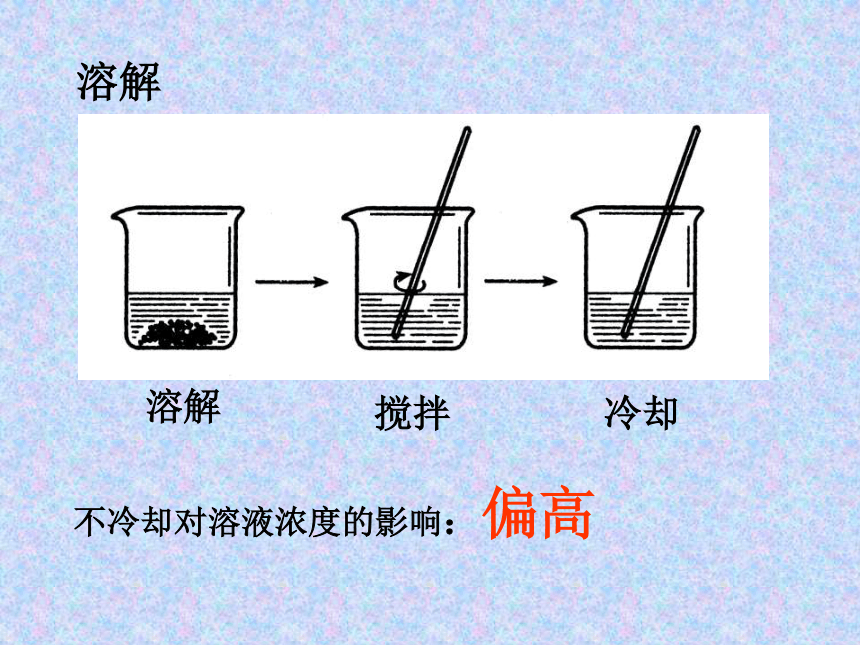
m减小则 偏低,m增大则 偏高 称量右物左码操作对溶液浓度的影响:偏低2.0g2.0gm=2.0g+0.5g=2.5gm= 2.0g-0.5g=1.5g思考:用滤纸称量NaOH ,会如何? 溶解不冷却对溶液浓度的影响:偏高溶解搅拌冷却 转移转移时少量液体流出对溶液浓度的影响:偏低未用蒸馏水洗涤烧杯和玻璃棒
对溶液浓度的影响:偏低 洗涤定容摇匀定容后没摇匀对溶液浓度的影响:定容摇匀后发现液面低于刻度线又加入适量水:偏低不均一装瓶容量瓶不能长时间放置溶液CuSO4
0.1mol.L-1. 在配制一定物质的量浓度溶液的实验中,下列操作对
所配得溶液无影响的是(写序号) ;会使所配溶
液的浓度偏大的是 ;会使所配溶液的浓度偏小的
是 。
(1)在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
(2)未将洗涤烧杯内壁的溶液转移入容量瓶;
(3)容量瓶中所配的溶液液面未到刻度线便停止加水;
(4)将配得的溶液从容量瓶转移到干燥、洁净的试剂
瓶中时,有少量溅出;
(5)将烧杯中溶液转移到容量瓶之前,容量瓶中有少量
蒸馏水;
(6)容量瓶中液面将达到刻度线时,俯视刻度线和液面。答:(4)(5); (3)(6); (1)(2)随堂检测一 2. 欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10.0烧杯少量冷却玻璃棒250随堂检测一 ③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, 。 2~3低2~3厘米胶头滴管低重新配制摇匀计算要正确称量要准确溶解要冷却转移要明确洗涤不省却定容要精确摇匀不忘却装瓶不推却祝同学们进步0.5mol/L的NaCl溶液250mL,所含的溶质的质量是多少克?物质的量是多少?溶质的微粒数分别是多少?
2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。
在VmLMgBr2溶液中含有m g的Mg2+,求Mg2+、MgBr2、Br-的物质的量浓度?
单位: mol / L 符号:CB
物质的量浓度=
(mol/L)一定物质的量浓度溶液的配制步骤计算称量溶解转移洗涤定容摇匀装瓶思考与交流1、以硫酸为例,讨论不同浓度的溶液在性质上可能会出现什么差异呢?
2、将5mL浓硫酸稀释为20mL稀硫酸,得到的稀硫酸与原浓硫酸所含的H2SO4的物质的量相等吗?c(浓溶液) ·V(浓溶液) = c(稀溶液) ·V(稀溶液) 稀释浓溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即稀释前后,溶液中溶质的物质的量相等如何用浓硫酸配制一定物质的量浓度的稀硫酸溶液?
用20mol/L的浓硫酸配制250mL1mol/L的稀硫酸。用量筒量取_____mL浓硫酸,把 缓缓注入到 中,并用 不断搅拌,待溶
液 后,将溶液沿着玻璃棒移入_______
中,用少量蒸馏水洗涤___ 和______ 2~3次,将洗
涤液移入_____ 中,向容量瓶中注入蒸馏水至刻度线
_________ 时,改用______ 小心加水至溶液凹液
面最低点与刻度线相切,最后盖好瓶塞___ _,
将配好的溶液转移到_________ 中并贴好标签。
12.5浓硫酸小烧杯玻璃棒冷却250mL容量瓶_烧杯玻璃棒容量瓶2~3cm处胶头滴管反复倒转几次_细口试剂瓶配制一定物质的量浓度的溶液的误差分析 浓度误差的判断方法是将称量(或量取)
误差和定容误差纳入公式c=
= ,由m(B)和V判断误差。 Ⅰ V一定:n偏大,c偏 ;n偏小,c偏 。
Ⅱ n一定:V偏小,c偏 ;V偏大,c偏 。配制100mL 0.1 mol/L CuSO4 溶液计算:如果用五水硫酸铜晶体配制,计算结果应是1.6g,还是2.5g?m (CuSO4) =0.1L×0.1mol/L×160 g/mol = 1.6 g m (CuSO4.5H2O) =0.1L×0.1 mol/L×250 g/mol = 2.5g计算不正确对溶液浓度的影响:
m减小则 偏低,m增大则 偏高 称量右物左码操作对溶液浓度的影响:偏低2.0g2.0gm=2.0g+0.5g=2.5gm= 2.0g-0.5g=1.5g思考:用滤纸称量NaOH ,会如何? 溶解不冷却对溶液浓度的影响:偏高溶解搅拌冷却 转移转移时少量液体流出对溶液浓度的影响:偏低未用蒸馏水洗涤烧杯和玻璃棒
对溶液浓度的影响:偏低 洗涤定容摇匀定容后没摇匀对溶液浓度的影响:定容摇匀后发现液面低于刻度线又加入适量水:偏低不均一装瓶容量瓶不能长时间放置溶液CuSO4
0.1mol.L-1. 在配制一定物质的量浓度溶液的实验中,下列操作对
所配得溶液无影响的是(写序号) ;会使所配溶
液的浓度偏大的是 ;会使所配溶液的浓度偏小的
是 。
(1)在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
(2)未将洗涤烧杯内壁的溶液转移入容量瓶;
(3)容量瓶中所配的溶液液面未到刻度线便停止加水;
(4)将配得的溶液从容量瓶转移到干燥、洁净的试剂
瓶中时,有少量溅出;
(5)将烧杯中溶液转移到容量瓶之前,容量瓶中有少量
蒸馏水;
(6)容量瓶中液面将达到刻度线时,俯视刻度线和液面。答:(4)(5); (3)(6); (1)(2)随堂检测一 2. 欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10.0烧杯少量冷却玻璃棒250随堂检测一 ③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, 。 2~3低2~3厘米胶头滴管低重新配制摇匀计算要正确称量要准确溶解要冷却转移要明确洗涤不省却定容要精确摇匀不忘却装瓶不推却祝同学们进步0.5mol/L的NaCl溶液250mL,所含的溶质的质量是多少克?物质的量是多少?溶质的微粒数分别是多少?
2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。
在VmLMgBr2溶液中含有m g的Mg2+,求Mg2+、MgBr2、Br-的物质的量浓度?
