第十一单元课题1 生活中常见的盐——复分解反应发生的条件(共24张PPT)
文档属性
| 名称 | 第十一单元课题1 生活中常见的盐——复分解反应发生的条件(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 487.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-03-31 17:03:42 | ||
图片预览








文档简介
课件24张PPT。复分解反应发生的条件复分解反应1、概念:两种化合物 ,生成另外 的反应。
2、反应特征可表示为:
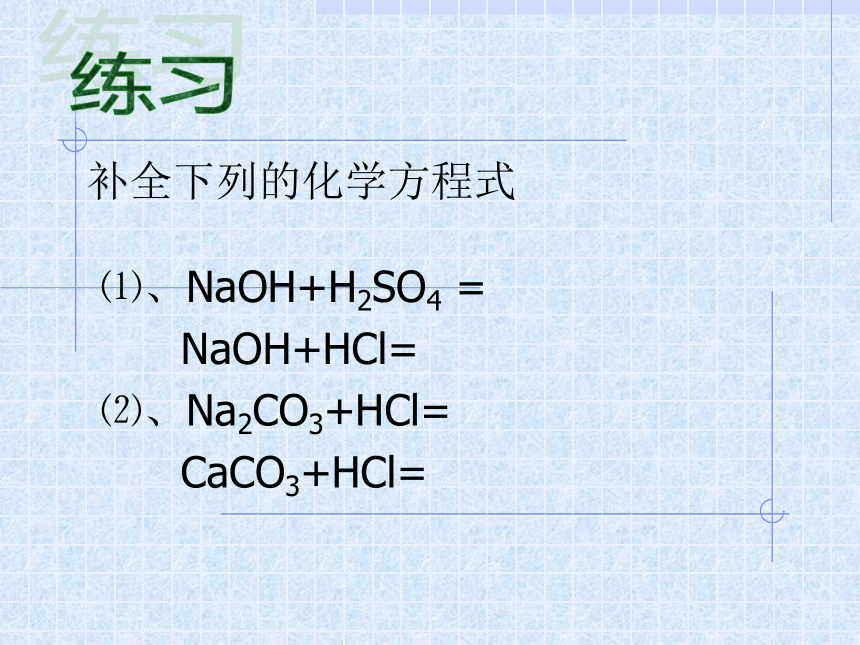
---知识回顾AB + CD = AD + CB互相交换成分两种化合物两交换,价不变练习补全下列的化学方程式⑴、NaOH+H2SO4 =
NaOH+HCl=
⑵、Na2CO3+HCl=
CaCO3+HCl=
⑴、2NaOH+H2SO4 =Na2SO4+2H2O
NaOH+HCl=NaCl+H2O
⑵、Na2CO3+2HCl=2NaCl +H2O+ CO2↑
CaCO3+2HCl=CaCl2 +H2O+CO2↑(酸+碱=盐+水)(盐+酸=新盐+新酸)实验11-3向两只分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
有蓝色絮状沉淀生成有白色沉淀生成CuSO4+2NaOH=
Na2SO4 +Cu(OH)2↓
CuSO4 +BaCl2=
BaSO4↓+CuCl2---知识新授CuSO4+2NaOH=Na2SO4 + Cu(OH)2↓CuSO4 +BaCl2= BaSO4↓ +CuCl2(盐(可溶)+碱(可溶) =新盐+新碱)(盐(可溶) +盐(可溶) =新盐+新盐)复分解反应发生条件:
酸碱盐之间并不是都能发生复分解反应,只有当
1、两种化合物相互交换成分
2、生成物中有 或有 或有 生成
复分解反应才可以发生。
沉淀气体水判断两种酸、碱、盐之间是否发生复分解反应:1、互相交换阳离子2、判断两种新物质中是否有水、 气体或沉淀3、若新物质中有水或者气体或者沉淀生成时,复分解反应可发生探究某些酸、碱、盐之间是否都能发生反应?阴离子阳离子碱酸盐附录I部分酸、碱、盐的溶解规律(室温)酸:初中范围内的酸全溶碱:钾、钠、钡、铵四碱溶,
Ca(OH)2微溶,其余全不溶。盐酸盐(Cl-):只有AgCl不溶;硫酸盐(SO42-):只有BaSO4不溶;碳酸盐(CO32-):除钾、钠、铵溶,MgCO3微溶,其余不溶。钾、钠、铵、硝酸盐都易溶;盐:能反应不能反应能反应能反应有水生成无水、气体或沉淀生成有气体CO2生成
有沉淀BaSO4生成2、设计实验证明你的判断。⑴、向试管中加入适量的NaOH溶液,再滴加几滴酚酞试剂,溶液由无色变为红色,向溶液中逐滴滴加稀硫酸,边滴加边振荡,观察溶液颜色变化。⑵、向试管中加入适量NaCl溶液,再逐滴滴加稀硫酸,边滴加边振荡,观察现象。⑶、向试管中加入适量K2CO3溶液,再加入适量稀硫酸,观察有无气泡产生。将生成的气体通入到装有澄清石灰水的试管中,观察澄清石灰水中现象。⑷、向试管中加入适量Ba(NO3)2溶液,再逐滴滴加稀硫酸,边滴加边振荡,观察到有无沉淀生成。3、反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2OK2CO3+H2SO4=K2SO4+H2O+ CO2↑Ba(NO3)2+H2SO4= BaSO4↓+2HNO3Na+OH-H+Cl-H2ONaOH+HCl=NaCl+H2O看图探究结论:
有水生成的复分解反应实质是 H+和OH-反应实质:旁观者:Cl-和Na+看图探究K+K+CO32-SO42-H+SO42-H+H2O
H2SO4+K2CO3=K2SO4+ CO2↑+H2O
结论:
有CO2生成的复分解反应实质是CO32-和H+反应CO2实质:旁观者:SO42-和K+看图探究Ba2+SO42-NO3-NO3-H+H+BaSO4Ba(NO3)2+H2SO4= BaSO4↓+2HNO3结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应实质:旁观者:NO3-和H+
1、根据复分解反应发生的条件,并利用附录I所提供的信息,判断下列物质间能否发生复分解反应,如能发生反应,写出反应的化学方程式。
⑴碳酸钠溶液和氯化钙溶液
⑵氢氧化钠溶液和氯化钾溶液
⑶氢氧化铝和盐酸
⑷碳酸钾溶液和盐酸
练一练⑴Na2CO3+CaCl2= CaCO3↓+2NaCl⑶Al(OH)3+3HCl=AlCl3+3H2O⑵不能发生反应⑷K2CO3+2HCl=2KCl+H2O+ CO2↑2、能在pH为1的溶液中大量共存,且溶液为无色透明的一组物质是( ) A.FeCl3、CuSO4、NaCl B.BaCl2、Na2SO4、NaOH C.CaCl2、Na2CO3、AgNO3 D.K2SO4、NaNO3、NaCl DSOCO15、食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为___________________。(提示:BaSO4、BaCO3难溶于水) NaCl、Na2CO3 内容小结学习本节课你学到了哪些内容?同学们交流。祝同学们:
快乐学习
健康成长
2、反应特征可表示为:
---知识回顾AB + CD = AD + CB互相交换成分两种化合物两交换,价不变练习补全下列的化学方程式⑴、NaOH+H2SO4 =
NaOH+HCl=
⑵、Na2CO3+HCl=
CaCO3+HCl=
⑴、2NaOH+H2SO4 =Na2SO4+2H2O
NaOH+HCl=NaCl+H2O
⑵、Na2CO3+2HCl=2NaCl +H2O+ CO2↑
CaCO3+2HCl=CaCl2 +H2O+CO2↑(酸+碱=盐+水)(盐+酸=新盐+新酸)实验11-3向两只分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
有蓝色絮状沉淀生成有白色沉淀生成CuSO4+2NaOH=
Na2SO4 +Cu(OH)2↓
CuSO4 +BaCl2=
BaSO4↓+CuCl2---知识新授CuSO4+2NaOH=Na2SO4 + Cu(OH)2↓CuSO4 +BaCl2= BaSO4↓ +CuCl2(盐(可溶)+碱(可溶) =新盐+新碱)(盐(可溶) +盐(可溶) =新盐+新盐)复分解反应发生条件:
酸碱盐之间并不是都能发生复分解反应,只有当
1、两种化合物相互交换成分
2、生成物中有 或有 或有 生成
复分解反应才可以发生。
沉淀气体水判断两种酸、碱、盐之间是否发生复分解反应:1、互相交换阳离子2、判断两种新物质中是否有水、 气体或沉淀3、若新物质中有水或者气体或者沉淀生成时,复分解反应可发生探究某些酸、碱、盐之间是否都能发生反应?阴离子阳离子碱酸盐附录I部分酸、碱、盐的溶解规律(室温)酸:初中范围内的酸全溶碱:钾、钠、钡、铵四碱溶,
Ca(OH)2微溶,其余全不溶。盐酸盐(Cl-):只有AgCl不溶;硫酸盐(SO42-):只有BaSO4不溶;碳酸盐(CO32-):除钾、钠、铵溶,MgCO3微溶,其余不溶。钾、钠、铵、硝酸盐都易溶;盐:能反应不能反应能反应能反应有水生成无水、气体或沉淀生成有气体CO2生成
有沉淀BaSO4生成2、设计实验证明你的判断。⑴、向试管中加入适量的NaOH溶液,再滴加几滴酚酞试剂,溶液由无色变为红色,向溶液中逐滴滴加稀硫酸,边滴加边振荡,观察溶液颜色变化。⑵、向试管中加入适量NaCl溶液,再逐滴滴加稀硫酸,边滴加边振荡,观察现象。⑶、向试管中加入适量K2CO3溶液,再加入适量稀硫酸,观察有无气泡产生。将生成的气体通入到装有澄清石灰水的试管中,观察澄清石灰水中现象。⑷、向试管中加入适量Ba(NO3)2溶液,再逐滴滴加稀硫酸,边滴加边振荡,观察到有无沉淀生成。3、反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2OK2CO3+H2SO4=K2SO4+H2O+ CO2↑Ba(NO3)2+H2SO4= BaSO4↓+2HNO3Na+OH-H+Cl-H2ONaOH+HCl=NaCl+H2O看图探究结论:
有水生成的复分解反应实质是 H+和OH-反应实质:旁观者:Cl-和Na+看图探究K+K+CO32-SO42-H+SO42-H+H2O
H2SO4+K2CO3=K2SO4+ CO2↑+H2O
结论:
有CO2生成的复分解反应实质是CO32-和H+反应CO2实质:旁观者:SO42-和K+看图探究Ba2+SO42-NO3-NO3-H+H+BaSO4Ba(NO3)2+H2SO4= BaSO4↓+2HNO3结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应实质:旁观者:NO3-和H+
1、根据复分解反应发生的条件,并利用附录I所提供的信息,判断下列物质间能否发生复分解反应,如能发生反应,写出反应的化学方程式。
⑴碳酸钠溶液和氯化钙溶液
⑵氢氧化钠溶液和氯化钾溶液
⑶氢氧化铝和盐酸
⑷碳酸钾溶液和盐酸
练一练⑴Na2CO3+CaCl2= CaCO3↓+2NaCl⑶Al(OH)3+3HCl=AlCl3+3H2O⑵不能发生反应⑷K2CO3+2HCl=2KCl+H2O+ CO2↑2、能在pH为1的溶液中大量共存,且溶液为无色透明的一组物质是( ) A.FeCl3、CuSO4、NaCl B.BaCl2、Na2SO4、NaOH C.CaCl2、Na2CO3、AgNO3 D.K2SO4、NaNO3、NaCl DSOCO15、食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为___________________。(提示:BaSO4、BaCO3难溶于水) NaCl、Na2CO3 内容小结学习本节课你学到了哪些内容?同学们交流。祝同学们:
快乐学习
健康成长
同课章节目录
