化学能与电能课件(共21张PPT)
文档属性
| 名称 | 化学能与电能课件(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 562.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-04-09 00:00:00 | ||
图片预览






文档简介
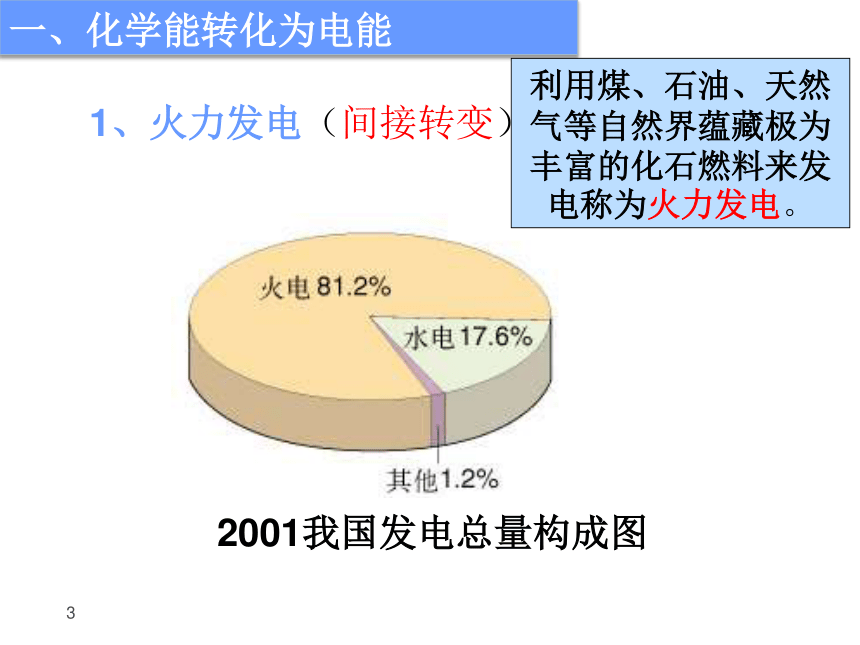
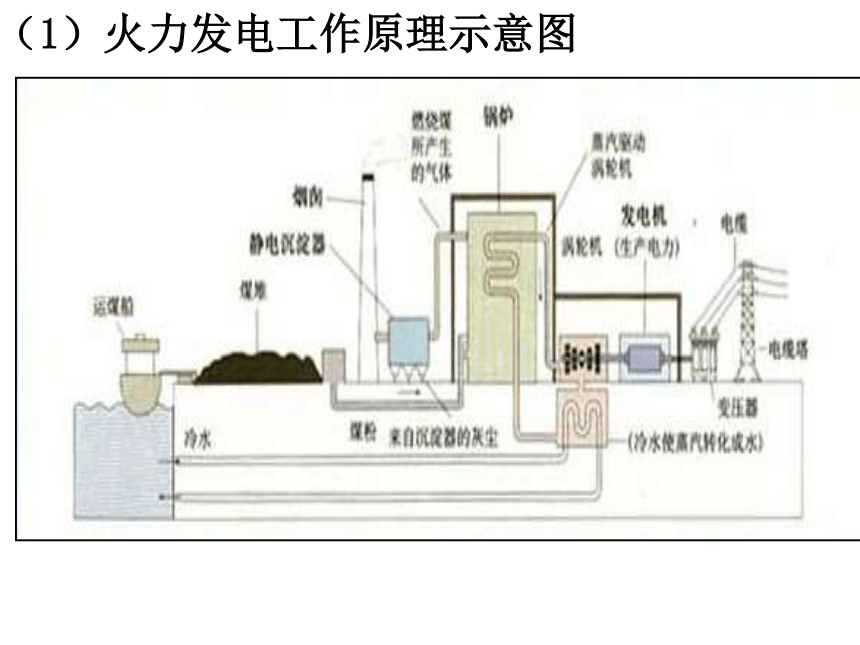
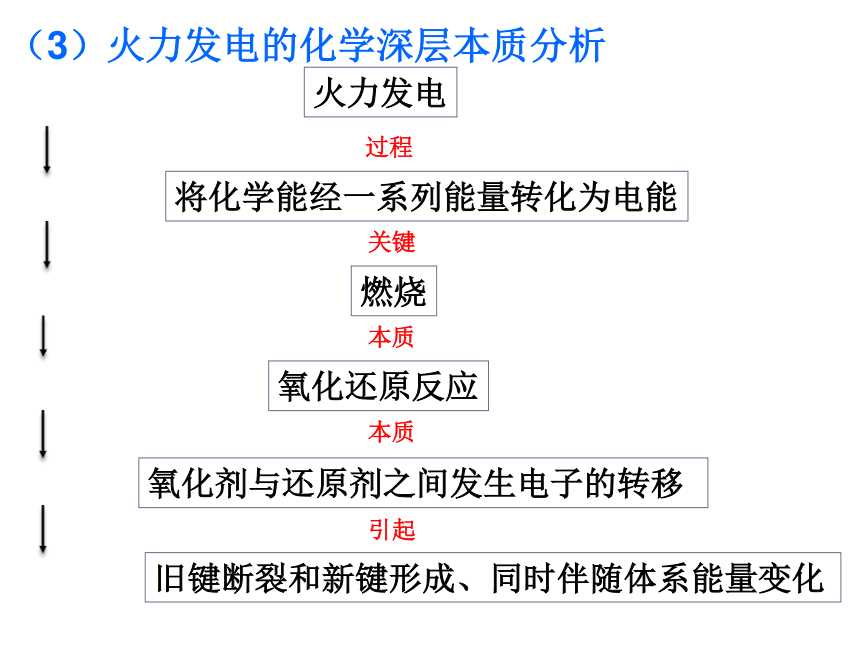
课件21张PPT。新课标人教版化学必修Ⅱ 第二章 第二节 化学能与电能2导入新课 上一节我们探讨的主要是化学能转化为热能问题,那么物质的化学能能否转化为电能,若能转化,又是如何转化的?3一、化学能转化为电能利用煤、石油、天然气等自然界蕴藏极为丰富的化石燃料来发电称为火力发电。2001我国发电总量构成图1、火力发电(间接转变)(1)火力发电工作原理示意图2018-10-46(2)火力发电的缺点:②产生烟尘和废气,造成空气污染;③SO2形成酸雨;④ CO2加剧温室效应;⑤煤炭储量有限,是非再生能源;①经多次转换,能量损耗大,燃料的利用率低。(3)火力发电的化学深层本质分析燃烧氧化还原反应氧化剂与还原剂之间发生电子的转移火力发电将化学能经一系列能量转化为电能旧键断裂和新键形成、同时伴随体系能量变化过程关键本质本质引起2018-10-48 质疑 氧化剂与还原剂直接接触进行反应时,化学能转化为热能,再进过一系列能量转换环节才能转化为电能,这样能源利用率低。可不可以使氧化还原反应释放的能量不通过热能而直接转变为电能呢?思考与交流 1.要使氧化还原反应释放的能量不通过热能而直接转变为电能,所要解决的第一问题是什么? 2.若将氧化反应与还原反应分开在不同区域进行,那么,怎样使电子从还原剂区域转移到氧化剂区域,同时形成电流? 3.怎样知道所架设的桥梁中有电子流过? 架设桥梁将氧化反应与还原反应分开在不同区域进行2018-10-4实验2-4:用锌片、铜片、稀硫酸、烧杯、电流表、导线等按要求完成实验。铜片上无气泡锌片上有气泡电流表指针偏转铜片上无气泡锌片上有气泡铜片上有气泡
锌片溶解:将化学能转化成电能的装置原电池2、原电池(1)定义(氧化反应)(还原反应) (Zn): Zn -2e- = Zn2+(Cu):2H++2e- = H2 ↑(铜片在这里起传导电子的作用)电极反应式:Zn+H2SO4=ZnSO4+H2↑原电池总反应:Zn-Cu-H2SO4原电池的工作原理:负极正极(2)原电池工作原理2018-10-414(3)原电池中电极的名称和电极反应负极:电子流出的一极—正极:电子流入的一极—电子与电流流向: 阴离子移向负极,阳离子移向正极, 外电路: 内电路:电流由正极流向负极。电流由负极流向正极。电子由负极流向正极,发生氧化反应发生还原反应2018-10-415 通过刚才的实验我们知道化学能在原电池装置中可以直接转化为电能,那么,符合什么条件的装置才能构成原电池呢?【实验探究原电 池的形成件】原电池的组成部分有哪些?【科学探究三】CuZn 稀硫酸导线电极容器(装电解质溶液)(-) (+)原电池的形成条件闭合回路实验探究:构成原电池的条件(4)构成原电池的条件 ②电极材料均插入电解质溶液中。③两极相连形成闭合电路。 ④能自发进行的氧化还原反应(首要条件)。①活泼性不同的两个电极(一般)负极:较活泼的金属正极:较不活泼的金属、非金属导体(石墨)、
金属氧化物等电解质溶液:酸、碱、盐溶液讨论以下装置是否能构成原电池判断下列各装置能否形成原电池反应?用导线连接或直接接触。3、原电池构成条件:“一液两极三连”。2、原电池反应原理:一般负极(较活泼金属)失电子 ,发生氧化反应,电子从负极流出,通过外电路,流入正极,氧化剂在正极表面得电子发生还原反应。1、原电池定义:把化学能直接转变为电能的装置。 本节小结:
锌片溶解:将化学能转化成电能的装置原电池2、原电池(1)定义(氧化反应)(还原反应) (Zn): Zn -2e- = Zn2+(Cu):2H++2e- = H2 ↑(铜片在这里起传导电子的作用)电极反应式:Zn+H2SO4=ZnSO4+H2↑原电池总反应:Zn-Cu-H2SO4原电池的工作原理:负极正极(2)原电池工作原理2018-10-414(3)原电池中电极的名称和电极反应负极:电子流出的一极—正极:电子流入的一极—电子与电流流向: 阴离子移向负极,阳离子移向正极, 外电路: 内电路:电流由正极流向负极。电流由负极流向正极。电子由负极流向正极,发生氧化反应发生还原反应2018-10-415 通过刚才的实验我们知道化学能在原电池装置中可以直接转化为电能,那么,符合什么条件的装置才能构成原电池呢?【实验探究原电 池的形成件】原电池的组成部分有哪些?【科学探究三】CuZn 稀硫酸导线电极容器(装电解质溶液)(-) (+)原电池的形成条件闭合回路实验探究:构成原电池的条件(4)构成原电池的条件 ②电极材料均插入电解质溶液中。③两极相连形成闭合电路。 ④能自发进行的氧化还原反应(首要条件)。①活泼性不同的两个电极(一般)负极:较活泼的金属正极:较不活泼的金属、非金属导体(石墨)、
金属氧化物等电解质溶液:酸、碱、盐溶液讨论以下装置是否能构成原电池判断下列各装置能否形成原电池反应?用导线连接或直接接触。3、原电池构成条件:“一液两极三连”。2、原电池反应原理:一般负极(较活泼金属)失电子 ,发生氧化反应,电子从负极流出,通过外电路,流入正极,氧化剂在正极表面得电子发生还原反应。1、原电池定义:把化学能直接转变为电能的装置。 本节小结:
