高中化学必修2课件:3.3生活中常见的两种有机物 (共39张PPT)
文档属性
| 名称 | 高中化学必修2课件:3.3生活中常见的两种有机物 (共39张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-04-11 00:00:00 | ||
图片预览







文档简介
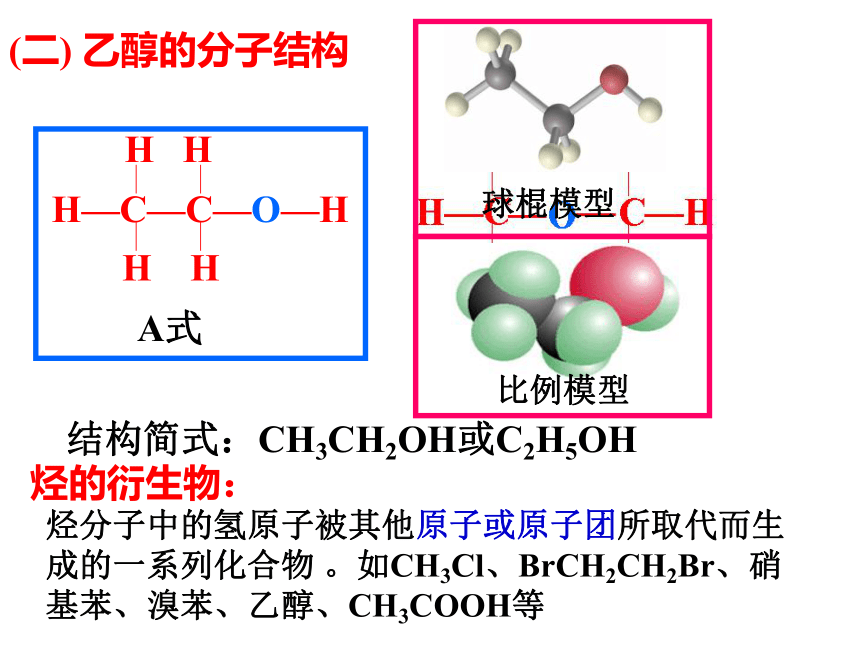
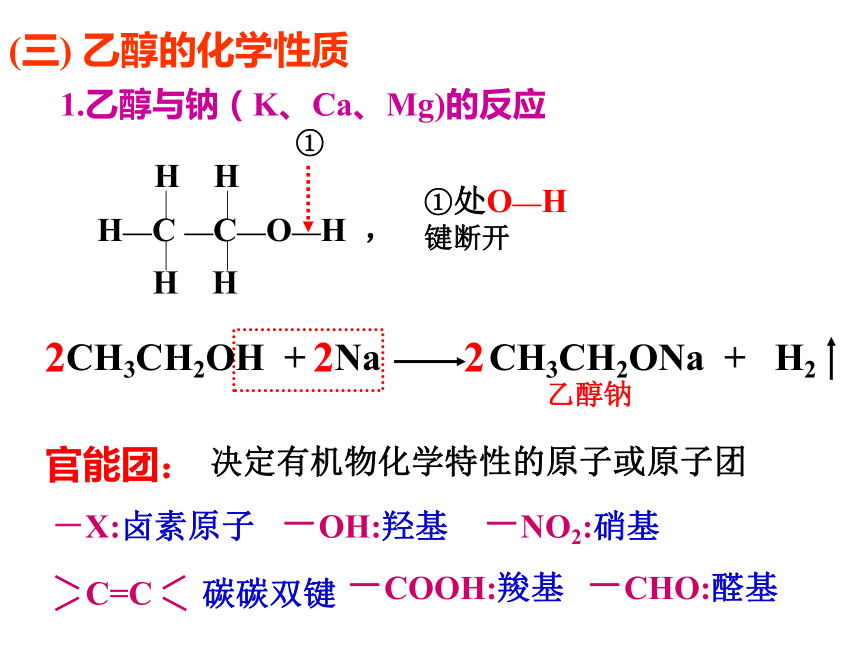
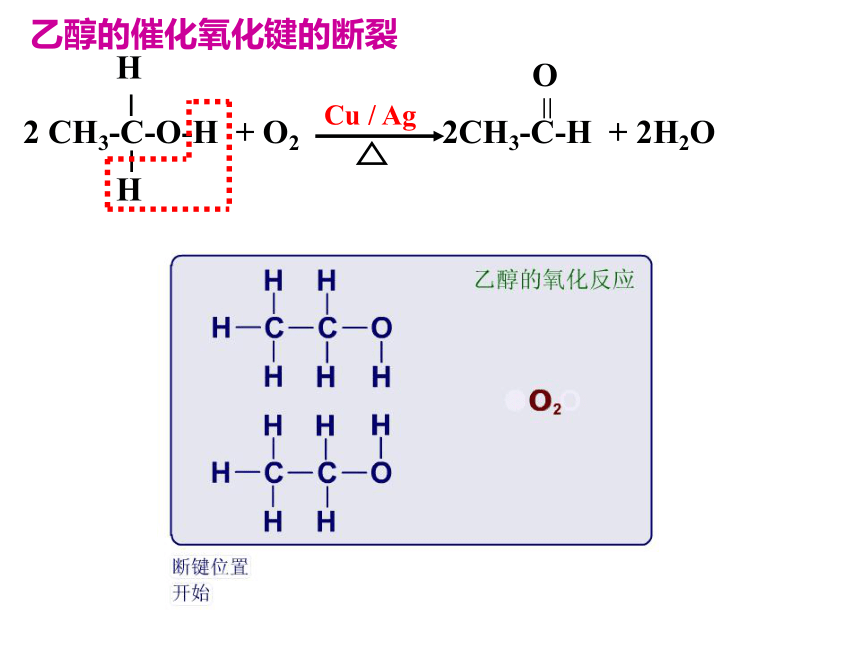
课件39张PPT。第一课时一、乙醇(一) 乙醇的物理性质学生活动——感悟乙醇物理性质 乙醇是一种无色透明、有特殊香味、易挥发、密度比水小、可与水任意比互溶、能溶解多种有机物和无机物的液体。A式结构简式:CH3CH2OH或C2H5OH(二) 乙醇的分子结构烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物 。如CH3Cl、BrCH2CH2Br、硝基苯、溴苯、乙醇、CH3COOH等(三) 乙醇的化学性质 1.乙醇与钠(K、Ca、Mg)的反应CH3CH2OH + Na2 2 2官能团: 决定有机物化学特性的原子或原子团 -X:卤素原子 -OH:羟基 -NO2:硝基 碳碳双键-COOH:羧基-CHO:醛基2.乙醇的氧化反应(1)乙醇燃烧 [实验3-3]乙醇的催化氧化铜丝(2)乙醇的催化氧化过程分析:乙 醛乙醇的催化氧化键的断裂另外,产生的乙醛能在催化剂的作用下可被氧化为乙酸(3)被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸氧化反应:
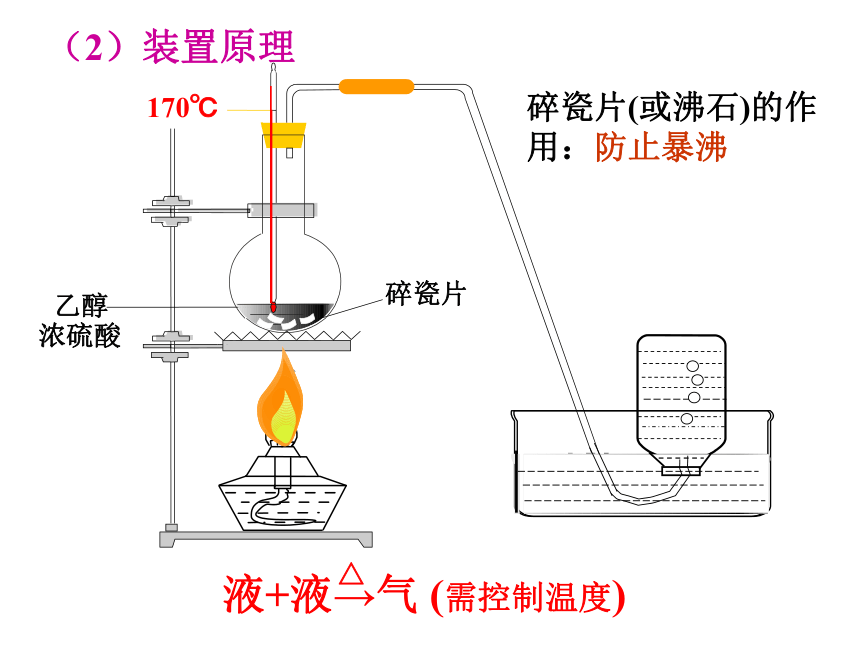
有机物分子中加入氧原子或失去氢原子的反应第二课时(1)反应原理:CH2=CH2 ?+ H2O将乙醇和浓硫酸迅速加热到170℃制取乙烯浓硫酸的作用:催化剂、脱水剂硫酸酒精三比一,加入碎瓷混一起,
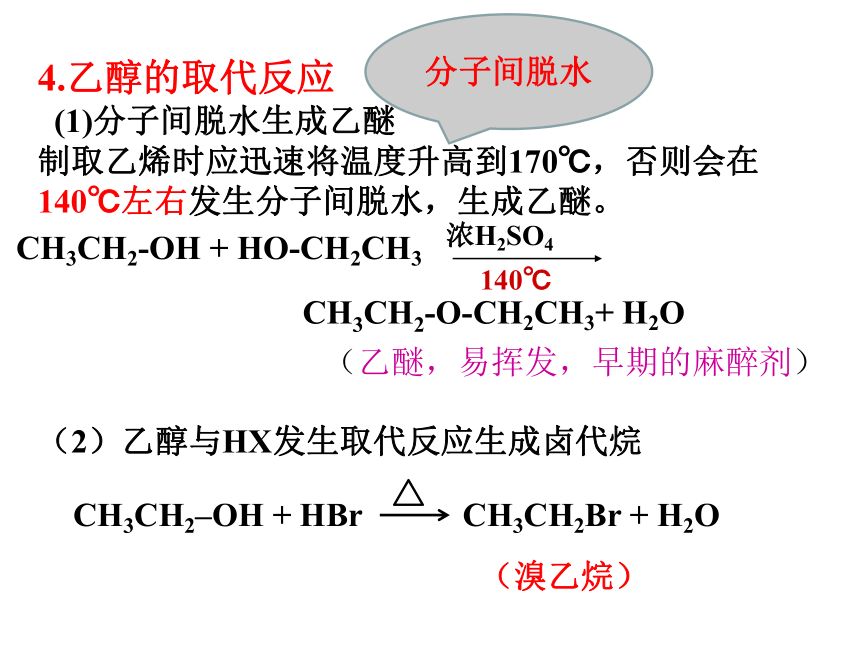
加热一百七十度,排水收集得乙烯。分子内脱水3.乙醇的消去反应定义:从一个有机物分子中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键)化合物的反应。 实验室通常采用乙醇的消去反应制取乙烯(2)装置原理碎瓷片(或沸石)的作用:防止暴沸4.乙醇的取代反应
(1)分子间脱水生成乙醚
制取乙烯时应迅速将温度升高到170℃,否则会在140℃左右发生分子间脱水,生成乙醚。CH3CH2-OH + HO-CH2CH3CH3CH2-O-CH2CH3+ H2O(乙醚,易挥发,早期的麻醉剂)分子间脱水(2)乙醇与HX发生取代反应生成卤代烷(溴乙烷)[总结] 化学性质 化学键断裂位置
与活泼金属的置换反应
燃烧
催化氧化
消去反应
与HX反应
分子间脱水在学习有机物的化学性质时,一定要抓住断键的位置。① ①②③④①③ ②④①②②(四).乙醇的工业制法1.乙烯水化法CH2=CH2 + H2O CH3CH2OH2.发酵法例如:淀粉 葡萄糖 乙醇酒化酶思考:如何检验乙醇中含有水?
工业上,如何获得无水乙醇?(五)乙醇的用途乙 醇饮 料溶剂医药燃料切莫贪杯第三课时[知识拓展]
醇:分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物。
例如:甲醇(CH3OH)、乙醇、苯甲醇( )等。乙二醇( )、丙三醇( )等多元醇。 醇 同分异构体数目
C3H7OH
C4H9OH2
42CH3CH2OH + O2 2CH3CHO + 2H2OCu或Ag△乙醛醛:烃基(或氢原子)与醛基(—CHO)相连而成的化合物。
如乙醛(CH3CHO)、甲醛(HCHO)、丙醛(CH3CH2CHO)、乙二醛(OHC—CHO)等。
官能团:醛基(—CHO)2CH3CHO + O2 2CH3COOH羧酸:烃基(或氢原子)与羧基(—COOH)相连而成的化合物。
官能团:羧基(—COOH)
例如:乙酸、甲酸(HCOOH)、丙酸(CH3CH2COOH)、乙二酸(HOOC—COOH,俗称草酸)等。醚:氧原子与两个烃基相连而成的化合物。
R1—O—R2,R1、R2可以相同,也可以不同。
例如:二甲醚(CH3OCH3,简称甲醚)、乙醚(C2H5OC2H5)等。第四课时二、乙酸[知识介绍] 在日常生活中,我们饮用的食醋,其主要成分就是乙酸,因此乙酸又叫醋酸,普通醋中含醋酸3%~5%,山西陈醋含醋酸7%。 传说古代山西省有个酿酒高手叫杜康。他儿子黑塔跟父亲也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿酒后把酒糟扔掉可惜,把酒糟浸泡水缸里。到了第二十一日的酉(yǒu)时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。故醋在古代又叫“苦酒”醋的来历?酉廿一日二、乙酸分子式是C2H4O2,结构式: (一)分子组成和结构结构简式:CH3COOH官能团:羧基球棍模型比例模型(二)物理性质 乙酸俗称醋酸。有强烈刺激性气味的无色液体,熔点16.6℃,低于16.6℃就凝结成冰状晶体,所以无水乙酸又称冰醋酸。乙酸易溶于水和酒精。(三)化学性质1、酸的通性:乙酸溶液与活泼金属(如Zn)
乙酸溶液与金属氧化物(如CuO)
乙酸溶液与碱(如NaOH)反应
乙酸溶液与盐(如Na2CO3)反应2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑思考:—O—H中的H活泼性:
—COOH >H—O—H>R—O—H[实验3-4]在一支试管中加入3ml乙醇,然后边震荡边慢慢加入2ml浓硫酸和2ml乙酸;按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示),观察现象。1. 即试剂的添加顺序:乙醇→浓硫酸→乙酸
2.加热要小心均匀的进行,防止液体剧烈沸腾,乙酸 和乙醇大量挥发,故可加入碎瓷片或沸石,防止暴沸。
3.导气管末端不要进入液体内,以防止液体倒吸。
注意事项:2、酯化反应定义:酸和醇起作用,生成酯和水的反应浓硫酸作用:乙酸乙酯催化剂、吸水剂饱和Na2CO3溶液的作用(三项)?a.溶解乙醇b.吸收乙酸c.降低乙酸乙酯的溶解度,酯化反应实质:同位素追踪法酯化反应也是取代反应探究酯化反应可能的脱水方式3.酸和醇的酯化反应C2H5O—NO2 + H2OCH3COOH + HOCH3硝酸乙酯乙酸甲酯第五课时三.酯3.物理性质
低级酯是有香味的液体,密度一般小于水,难溶于水,易溶于有机溶剂,4.存在及用途
存在:花草和水果中含有酯,如梨中有乙酸异戊酯,苹果和香蕉中有异戊酸异戊酯等
用途:见教材P765.化学性质实验证明:在酸(或碱)存在下,酯可以发生水解(1)酸性条件水解(2)碱性条件水解说明:当有碱存在时,碱与水解产生的酸发生中和
反应,使水解趋于完全能力训练
1.质量为m g的铜丝在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量仍为m g的是( )
A.一氧化碳 B.乙醇
C.硝酸 D.盐酸AB2.下列说法中,正确的是( )
A.除去乙醇中的微量水可加入金属钠,使其完全反应
B.获得无水乙醇的方法通常是先用生石灰吸水,然后再加热蒸馏的方法
C.获得无水乙醇的方法通常是先用浓硫酸吸水,然后再加热蒸馏的方法
D.检验乙醇中是否含有水可加入少量无水硫酸铜,如变蓝则含水BD3.乙醇、乙二醇( )、丙三醇( )分别
与足量金属钠反应,产生等量的氢气,则这三种醇的物质的量之比为( )
A.3∶2∶1 B.6∶3∶2
C.1∶1∶1 D.4∶3∶2B
有机物分子中加入氧原子或失去氢原子的反应第二课时(1)反应原理:CH2=CH2 ?+ H2O将乙醇和浓硫酸迅速加热到170℃制取乙烯浓硫酸的作用:催化剂、脱水剂硫酸酒精三比一,加入碎瓷混一起,
加热一百七十度,排水收集得乙烯。分子内脱水3.乙醇的消去反应定义:从一个有机物分子中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键)化合物的反应。 实验室通常采用乙醇的消去反应制取乙烯(2)装置原理碎瓷片(或沸石)的作用:防止暴沸4.乙醇的取代反应
(1)分子间脱水生成乙醚
制取乙烯时应迅速将温度升高到170℃,否则会在140℃左右发生分子间脱水,生成乙醚。CH3CH2-OH + HO-CH2CH3CH3CH2-O-CH2CH3+ H2O(乙醚,易挥发,早期的麻醉剂)分子间脱水(2)乙醇与HX发生取代反应生成卤代烷(溴乙烷)[总结] 化学性质 化学键断裂位置
与活泼金属的置换反应
燃烧
催化氧化
消去反应
与HX反应
分子间脱水在学习有机物的化学性质时,一定要抓住断键的位置。① ①②③④①③ ②④①②②(四).乙醇的工业制法1.乙烯水化法CH2=CH2 + H2O CH3CH2OH2.发酵法例如:淀粉 葡萄糖 乙醇酒化酶思考:如何检验乙醇中含有水?
工业上,如何获得无水乙醇?(五)乙醇的用途乙 醇饮 料溶剂医药燃料切莫贪杯第三课时[知识拓展]
醇:分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物。
例如:甲醇(CH3OH)、乙醇、苯甲醇( )等。乙二醇( )、丙三醇( )等多元醇。 醇 同分异构体数目
C3H7OH
C4H9OH2
42CH3CH2OH + O2 2CH3CHO + 2H2OCu或Ag△乙醛醛:烃基(或氢原子)与醛基(—CHO)相连而成的化合物。
如乙醛(CH3CHO)、甲醛(HCHO)、丙醛(CH3CH2CHO)、乙二醛(OHC—CHO)等。
官能团:醛基(—CHO)2CH3CHO + O2 2CH3COOH羧酸:烃基(或氢原子)与羧基(—COOH)相连而成的化合物。
官能团:羧基(—COOH)
例如:乙酸、甲酸(HCOOH)、丙酸(CH3CH2COOH)、乙二酸(HOOC—COOH,俗称草酸)等。醚:氧原子与两个烃基相连而成的化合物。
R1—O—R2,R1、R2可以相同,也可以不同。
例如:二甲醚(CH3OCH3,简称甲醚)、乙醚(C2H5OC2H5)等。第四课时二、乙酸[知识介绍] 在日常生活中,我们饮用的食醋,其主要成分就是乙酸,因此乙酸又叫醋酸,普通醋中含醋酸3%~5%,山西陈醋含醋酸7%。 传说古代山西省有个酿酒高手叫杜康。他儿子黑塔跟父亲也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿酒后把酒糟扔掉可惜,把酒糟浸泡水缸里。到了第二十一日的酉(yǒu)时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。故醋在古代又叫“苦酒”醋的来历?酉廿一日二、乙酸分子式是C2H4O2,结构式: (一)分子组成和结构结构简式:CH3COOH官能团:羧基球棍模型比例模型(二)物理性质 乙酸俗称醋酸。有强烈刺激性气味的无色液体,熔点16.6℃,低于16.6℃就凝结成冰状晶体,所以无水乙酸又称冰醋酸。乙酸易溶于水和酒精。(三)化学性质1、酸的通性:乙酸溶液与活泼金属(如Zn)
乙酸溶液与金属氧化物(如CuO)
乙酸溶液与碱(如NaOH)反应
乙酸溶液与盐(如Na2CO3)反应2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑思考:—O—H中的H活泼性:
—COOH >H—O—H>R—O—H[实验3-4]在一支试管中加入3ml乙醇,然后边震荡边慢慢加入2ml浓硫酸和2ml乙酸;按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示),观察现象。1. 即试剂的添加顺序:乙醇→浓硫酸→乙酸
2.加热要小心均匀的进行,防止液体剧烈沸腾,乙酸 和乙醇大量挥发,故可加入碎瓷片或沸石,防止暴沸。
3.导气管末端不要进入液体内,以防止液体倒吸。
注意事项:2、酯化反应定义:酸和醇起作用,生成酯和水的反应浓硫酸作用:乙酸乙酯催化剂、吸水剂饱和Na2CO3溶液的作用(三项)?a.溶解乙醇b.吸收乙酸c.降低乙酸乙酯的溶解度,酯化反应实质:同位素追踪法酯化反应也是取代反应探究酯化反应可能的脱水方式3.酸和醇的酯化反应C2H5O—NO2 + H2OCH3COOH + HOCH3硝酸乙酯乙酸甲酯第五课时三.酯3.物理性质
低级酯是有香味的液体,密度一般小于水,难溶于水,易溶于有机溶剂,4.存在及用途
存在:花草和水果中含有酯,如梨中有乙酸异戊酯,苹果和香蕉中有异戊酸异戊酯等
用途:见教材P765.化学性质实验证明:在酸(或碱)存在下,酯可以发生水解(1)酸性条件水解(2)碱性条件水解说明:当有碱存在时,碱与水解产生的酸发生中和
反应,使水解趋于完全能力训练
1.质量为m g的铜丝在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量仍为m g的是( )
A.一氧化碳 B.乙醇
C.硝酸 D.盐酸AB2.下列说法中,正确的是( )
A.除去乙醇中的微量水可加入金属钠,使其完全反应
B.获得无水乙醇的方法通常是先用生石灰吸水,然后再加热蒸馏的方法
C.获得无水乙醇的方法通常是先用浓硫酸吸水,然后再加热蒸馏的方法
D.检验乙醇中是否含有水可加入少量无水硫酸铜,如变蓝则含水BD3.乙醇、乙二醇( )、丙三醇( )分别
与足量金属钠反应,产生等量的氢气,则这三种醇的物质的量之比为( )
A.3∶2∶1 B.6∶3∶2
C.1∶1∶1 D.4∶3∶2B
