高中化学必修1 1.2.1物质的量的单位 课件 (共37张PPT)
文档属性
| 名称 | 高中化学必修1 1.2.1物质的量的单位 课件 (共37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 349.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-04-11 00:00:00 | ||
图片预览






文档简介
课件37张PPT。物质的量——看不见的世界也精彩一、物质的量(n)(mol)单位:摩尔(简称“摩”)定义:表示含有一定数目粒子的集合体。
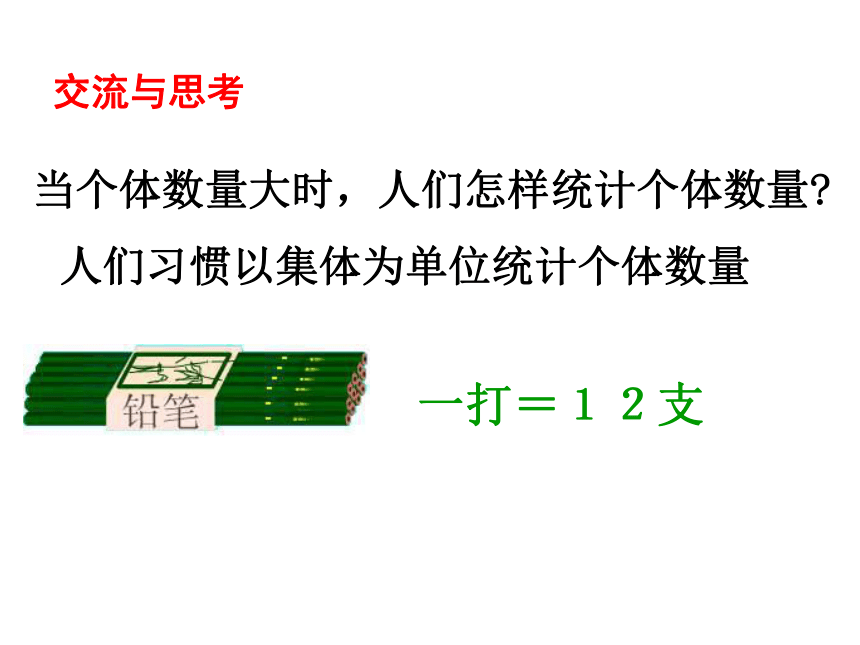
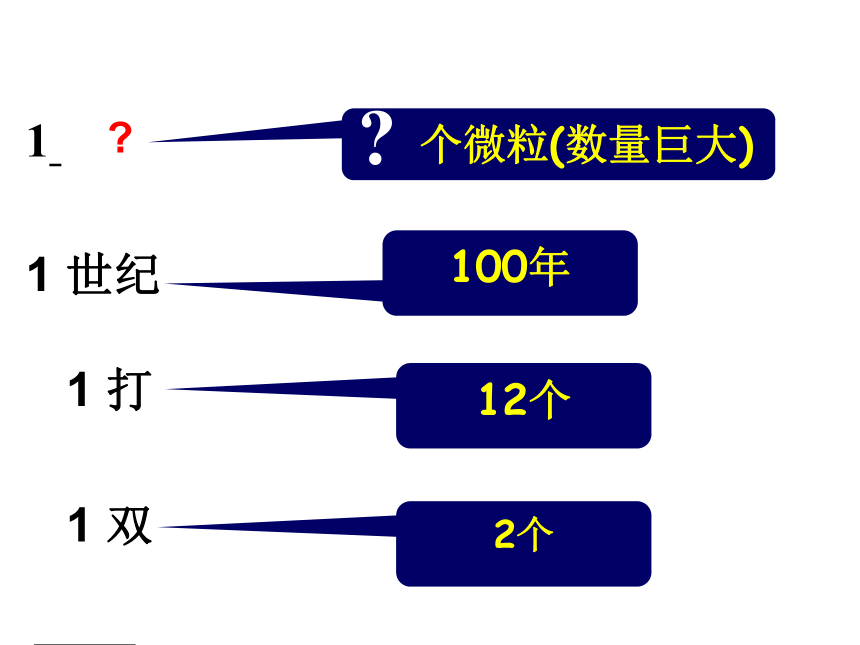
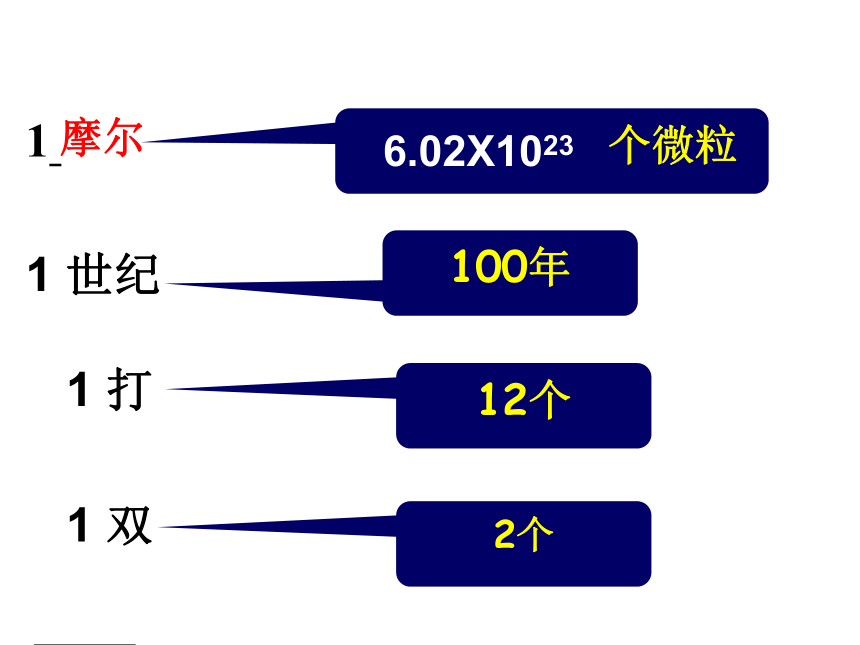
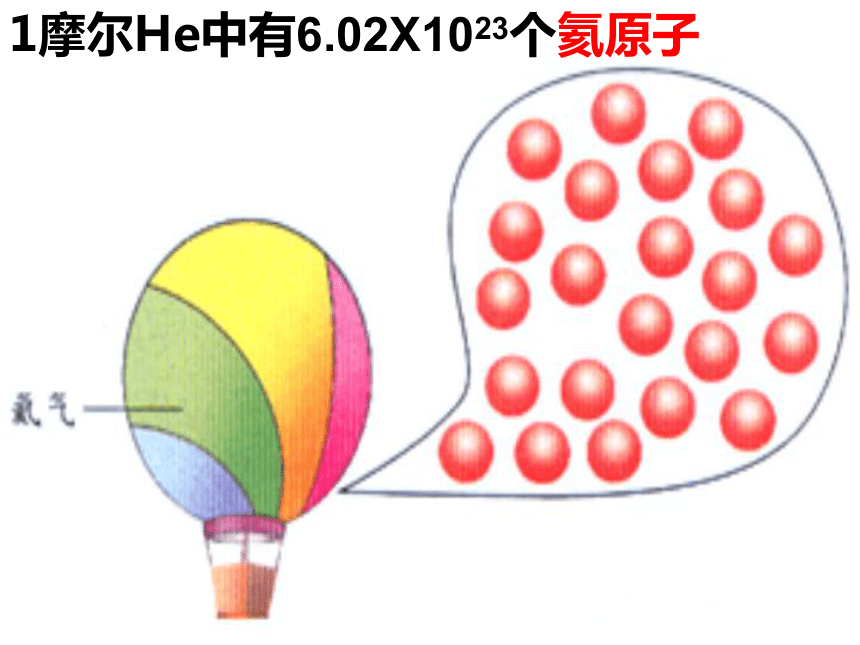
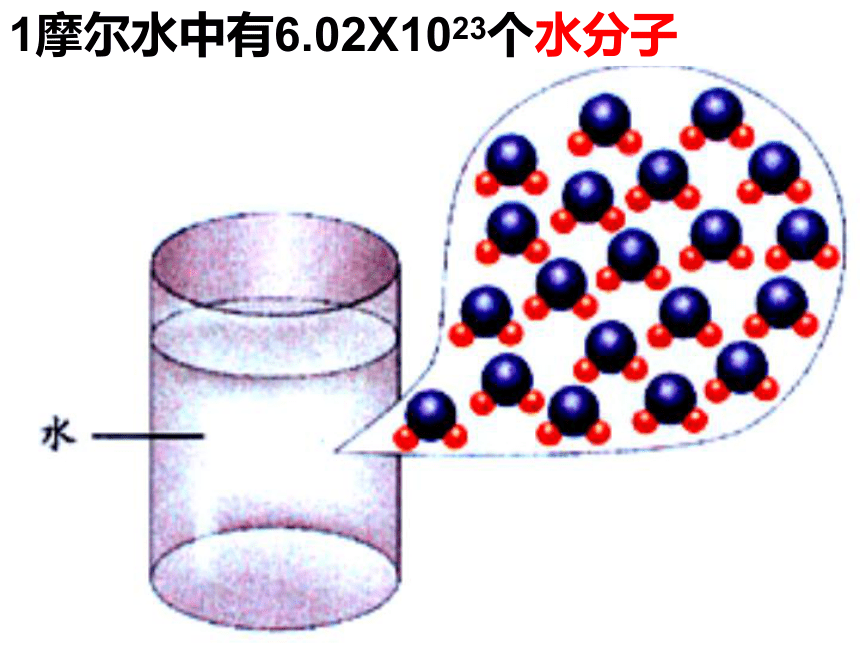
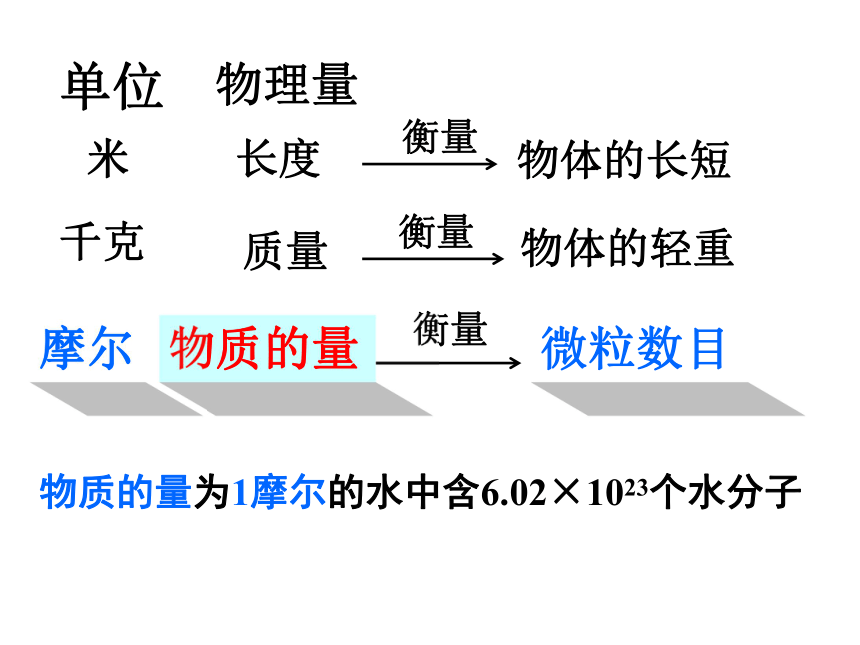
物质的量是一个 物理量国际单位制中七个基本物理量物质的量 摩尔 mol人们习惯以集体为单位统计个体数量一打=12支交流与思考当个体数量大时,人们怎样统计个体数量?2个12个100年 个微粒(数量巨大)1 双 1 打1 世纪1 ??2个12个100年 个微粒1 双 1 打1 世纪1 6.02X1023摩尔 1mol的任何粒子都含有约6.02×1023个微粒 长度 米 质量千克物体的轻重衡量单位物理量衡量物质的量摩尔微粒数目物质的量为1摩尔的水中含6.02×1023个水分子1mol C中约含有6.02×1023个碳原子
1mol H2O中约含有6.02×1023个水分子
1mol H+中约含有6.02×1023个氢离子
1mol H中约含有6.02×1023个氢原子
1mol O2中约含有6.02×1023个氧分子注意?使用摩尔时要指明具体粒子的种类,常用化学式表示。如1mol C、1mol O2 ,不能说1mol 氧,因为这时微粒是氧原子还是氧分子分辨不清! 意大利物理学家
阿伏伽德罗 把1mol任何粒子的粒子数叫做
阿伏伽德罗常数(NA)NA≈ 6.02×1023 mol-1 (6.02×1023)微粒数=1 molH2O2molH2O3molH2O3×(6.02×1023)2×(6.02×1023)物质的量×(6.02×1023)?1×二、“物质的量”与微粒数之间的换算1、已知物质的量(n),求微粒数(N)例:2mol N2含有 个氮分子.2×6.02×1023 或 2NA微粒数= 物质的量×(6.02×1023)2、已知微粒数(N),求物质的量(n)二、“物质的量”与微粒数间的换算例:6.02×1023个氦原子是_____mol He。3.01×1023个氦原子的物质的量是_______ 。10.5mol3.01 × 1023 2×6.02×1023120.5 ×6.02×10230.5练习1 摩尔He0.8 ×6.02×10231mol N2??2X6.02X10236.02X1023或 NA4.816X1023或 0.8NA
1.204X10240.8X6.02X10230.5或2NA假想把1mol H2O(直径为2×10-10m)一个挨一个的摆在地球赤道上(周长为4万公里),可以绕地球赤道300万周! 由此可见,摩尔只适用于微观,不适用于宏观。不能说“1摩尔铁钉”、“1摩尔汽车”。因“物质的量”所计量的对象是微观单元,而不是宏观物体。mol适用的范围:微观粒子
包括:原子、分子、离子、原子团、电子、质子、中子等。小结一、物质的量 表示物所质含微粒数目的物理量
符号: n
单位: 摩尔,mol, 简称 摩? 每摩尔物质约含有6.02×1023个对应的微粒。二、物质的量与微粒数之间的换算关系 n—物质的量, N—微粒个数 1.“物质的量”是指( )
A.物质的质量 B.物质的微观粒子数
C.物质的质量与微观粒子数
D.能把物质的质量同微观粒子数联系起来的一个基本物理量
2.下列说法中正确地是( )
A.1 mol氧 B.1 molH2SO4
C.1 mol米 D.1 mol面粉
3.在1 mol H2O中( )
A.含1 mol H B.含6.02×1023个氢原子
C.含6.02×1023个水分子 D.含3.01×1023个氧原子课堂练习DBC4.在0.5 molNa2SO4中,含有的Na+数约为( )
A. 3.01×1023 B. 6.02×1023 C. 0.5 D. 1
5.1 mol下列气体中所含原子数最多的是( )
A. H2 B. CO2 C. CH4 D. O2
6.下列说法中正确的是(NA代表阿伏加德罗常数)
A.1 molN2和1molCO所含的分子数都是NA
B.1 molH2和1molCO2所含的原子数都是NA
C. 1 molCO和1molCO2所含的氧原子数都是NA
D. 1 molH2SO4和1molH3PO4所含的原子数都是4NABCA 7、1个CH4中含有 个电子;
1mol CH4中含有 个电子。1010NA课内作业3.01×1023 个1.806×1024 个0.5mol3mol6.02×1023个1.5NA个0.5mol1mol6.02×1023个我知道了……
我还想知道……
分析1mol物质的质量数值上有什么规律交流与思考 12 27 32 18 1.993×10-23 g×6.02×1023 =12g相对分子
或原子质量
1mol物质
的质量1mol任何粒子或物质的质量以克为单位时,其数值等于该粒子的相对原子质量或相对分子质量。 4.485×10-23g×6.02×1023 =27g二、摩尔质量:1mol物质的质量
(用M表示)
单位:g/mol 或 g?mol-156g/mol27g/mol44g/mol18g/mol17g/mol96g/mol摩尔质量的数值=粒子的相对原子质量或相对分子质量即1摩尔氢气的质量=2g氢气的摩尔质量=2 g/mol摩尔质量在数值上等于相对原子或相对分子质量氢气(H2)的相对分子质量为2质量=1mol水2mol水3mol水3mol×18 g/mol2mol×18 g/mol物质的量×摩尔质量?水的摩尔质量(M)=18 g/molH2O的相对分子质量为181mol×18 g/mol学与问:①24.5gH2SO4的物质的量是多少?
②1.5mol Na2CO3的质量是多少?n(H2SO4)==0.25mol①②m(Na2CO3)=n(Na2CO3)×M(Na2CO3)
= 1.5mol × 106g·mol-1
= 159g 练习
CO2的式量为____,摩尔质量为_____g/mol;
1mol二氧化碳的质量为_____g;
4.4g二氧化碳的物质的量为_____mol;
2mol二氧化碳的质量为_____g.
8.8g二氧化碳相当于____mol. 444488C-12 O-16440.10.22.判断下列说法是否正确。
(1)1mol氮
(2)5mol原子氢
(3)OH-的摩尔质量是17g
(4)1molNH3的质量是17g/mol
(5)0.1mol水中含有6.02×1022个水分子
(6)1mol任何物质的质量就等于该物质的式量。
(7)物质的摩尔质量等于该物质的相对原子或相对分子质量。××××√××课时作业3 P9613.
(2)等质量的氧气和臭氧(O3),它们的物质的
量之比为________,所含分子数之比为
________,所含原子数之比为_______。
答案:(2)3∶2 3∶2 1∶1①1个H2SO4分子中含有 个H, 个S,
个O;
②6.02×1023个H2SO4分子中含有 molH,
个S, molO;
③1mol H2SO4分子中含有 个 H, 个 S,
个 O;
④3mol H2SO4分子中含有 个 H, 个 S,
个O。
2142NA42NA
NA
4NA
6NA3NA12NA
作业1、课内作业:
2、课外作业:课时作业371gNa2SO4中含有Na+和SO42-的物质的量各是多少?作业:71gNa2SO4中含有Na+和SO42-的物质的量各是多少?解:Na2SO4的相对分子质量为142,摩尔质量为 142g·mol-1n(Na2SO4)==0.5mol答: 71gNa2SO4中含有Na+的物质的量为1mol,SO42-的物质的量为0.5mol n(Na+) = 2n(Na2SO4) = 1mol
n(SO42-) = n(Na2SO4) = 0.5mol
物质的量是一个 物理量国际单位制中七个基本物理量物质的量 摩尔 mol人们习惯以集体为单位统计个体数量一打=12支交流与思考当个体数量大时,人们怎样统计个体数量?2个12个100年 个微粒(数量巨大)1 双 1 打1 世纪1 ??2个12个100年 个微粒1 双 1 打1 世纪1 6.02X1023摩尔 1mol的任何粒子都含有约6.02×1023个微粒 长度 米 质量千克物体的轻重衡量单位物理量衡量物质的量摩尔微粒数目物质的量为1摩尔的水中含6.02×1023个水分子1mol C中约含有6.02×1023个碳原子
1mol H2O中约含有6.02×1023个水分子
1mol H+中约含有6.02×1023个氢离子
1mol H中约含有6.02×1023个氢原子
1mol O2中约含有6.02×1023个氧分子注意?使用摩尔时要指明具体粒子的种类,常用化学式表示。如1mol C、1mol O2 ,不能说1mol 氧,因为这时微粒是氧原子还是氧分子分辨不清! 意大利物理学家
阿伏伽德罗 把1mol任何粒子的粒子数叫做
阿伏伽德罗常数(NA)NA≈ 6.02×1023 mol-1 (6.02×1023)微粒数=1 molH2O2molH2O3molH2O3×(6.02×1023)2×(6.02×1023)物质的量×(6.02×1023)?1×二、“物质的量”与微粒数之间的换算1、已知物质的量(n),求微粒数(N)例:2mol N2含有 个氮分子.2×6.02×1023 或 2NA微粒数= 物质的量×(6.02×1023)2、已知微粒数(N),求物质的量(n)二、“物质的量”与微粒数间的换算例:6.02×1023个氦原子是_____mol He。3.01×1023个氦原子的物质的量是_______ 。10.5mol3.01 × 1023 2×6.02×1023120.5 ×6.02×10230.5练习1 摩尔He0.8 ×6.02×10231mol N2??2X6.02X10236.02X1023或 NA4.816X1023或 0.8NA
1.204X10240.8X6.02X10230.5或2NA假想把1mol H2O(直径为2×10-10m)一个挨一个的摆在地球赤道上(周长为4万公里),可以绕地球赤道300万周! 由此可见,摩尔只适用于微观,不适用于宏观。不能说“1摩尔铁钉”、“1摩尔汽车”。因“物质的量”所计量的对象是微观单元,而不是宏观物体。mol适用的范围:微观粒子
包括:原子、分子、离子、原子团、电子、质子、中子等。小结一、物质的量 表示物所质含微粒数目的物理量
符号: n
单位: 摩尔,mol, 简称 摩? 每摩尔物质约含有6.02×1023个对应的微粒。二、物质的量与微粒数之间的换算关系 n—物质的量, N—微粒个数 1.“物质的量”是指( )
A.物质的质量 B.物质的微观粒子数
C.物质的质量与微观粒子数
D.能把物质的质量同微观粒子数联系起来的一个基本物理量
2.下列说法中正确地是( )
A.1 mol氧 B.1 molH2SO4
C.1 mol米 D.1 mol面粉
3.在1 mol H2O中( )
A.含1 mol H B.含6.02×1023个氢原子
C.含6.02×1023个水分子 D.含3.01×1023个氧原子课堂练习DBC4.在0.5 molNa2SO4中,含有的Na+数约为( )
A. 3.01×1023 B. 6.02×1023 C. 0.5 D. 1
5.1 mol下列气体中所含原子数最多的是( )
A. H2 B. CO2 C. CH4 D. O2
6.下列说法中正确的是(NA代表阿伏加德罗常数)
A.1 molN2和1molCO所含的分子数都是NA
B.1 molH2和1molCO2所含的原子数都是NA
C. 1 molCO和1molCO2所含的氧原子数都是NA
D. 1 molH2SO4和1molH3PO4所含的原子数都是4NABCA 7、1个CH4中含有 个电子;
1mol CH4中含有 个电子。1010NA课内作业3.01×1023 个1.806×1024 个0.5mol3mol6.02×1023个1.5NA个0.5mol1mol6.02×1023个我知道了……
我还想知道……
分析1mol物质的质量数值上有什么规律交流与思考 12 27 32 18 1.993×10-23 g×6.02×1023 =12g相对分子
或原子质量
1mol物质
的质量1mol任何粒子或物质的质量以克为单位时,其数值等于该粒子的相对原子质量或相对分子质量。 4.485×10-23g×6.02×1023 =27g二、摩尔质量:1mol物质的质量
(用M表示)
单位:g/mol 或 g?mol-156g/mol27g/mol44g/mol18g/mol17g/mol96g/mol摩尔质量的数值=粒子的相对原子质量或相对分子质量即1摩尔氢气的质量=2g氢气的摩尔质量=2 g/mol摩尔质量在数值上等于相对原子或相对分子质量氢气(H2)的相对分子质量为2质量=1mol水2mol水3mol水3mol×18 g/mol2mol×18 g/mol物质的量×摩尔质量?水的摩尔质量(M)=18 g/molH2O的相对分子质量为181mol×18 g/mol学与问:①24.5gH2SO4的物质的量是多少?
②1.5mol Na2CO3的质量是多少?n(H2SO4)==0.25mol①②m(Na2CO3)=n(Na2CO3)×M(Na2CO3)
= 1.5mol × 106g·mol-1
= 159g 练习
CO2的式量为____,摩尔质量为_____g/mol;
1mol二氧化碳的质量为_____g;
4.4g二氧化碳的物质的量为_____mol;
2mol二氧化碳的质量为_____g.
8.8g二氧化碳相当于____mol. 444488C-12 O-16440.10.22.判断下列说法是否正确。
(1)1mol氮
(2)5mol原子氢
(3)OH-的摩尔质量是17g
(4)1molNH3的质量是17g/mol
(5)0.1mol水中含有6.02×1022个水分子
(6)1mol任何物质的质量就等于该物质的式量。
(7)物质的摩尔质量等于该物质的相对原子或相对分子质量。××××√××课时作业3 P9613.
(2)等质量的氧气和臭氧(O3),它们的物质的
量之比为________,所含分子数之比为
________,所含原子数之比为_______。
答案:(2)3∶2 3∶2 1∶1①1个H2SO4分子中含有 个H, 个S,
个O;
②6.02×1023个H2SO4分子中含有 molH,
个S, molO;
③1mol H2SO4分子中含有 个 H, 个 S,
个 O;
④3mol H2SO4分子中含有 个 H, 个 S,
个O。
2142NA42NA
NA
4NA
6NA3NA12NA
作业1、课内作业:
2、课外作业:课时作业371gNa2SO4中含有Na+和SO42-的物质的量各是多少?作业:71gNa2SO4中含有Na+和SO42-的物质的量各是多少?解:Na2SO4的相对分子质量为142,摩尔质量为 142g·mol-1n(Na2SO4)==0.5mol答: 71gNa2SO4中含有Na+的物质的量为1mol,SO42-的物质的量为0.5mol n(Na+) = 2n(Na2SO4) = 1mol
n(SO42-) = n(Na2SO4) = 0.5mol
