课题3溶液的浓度课件 (共52张PPT)
图片预览








文档简介
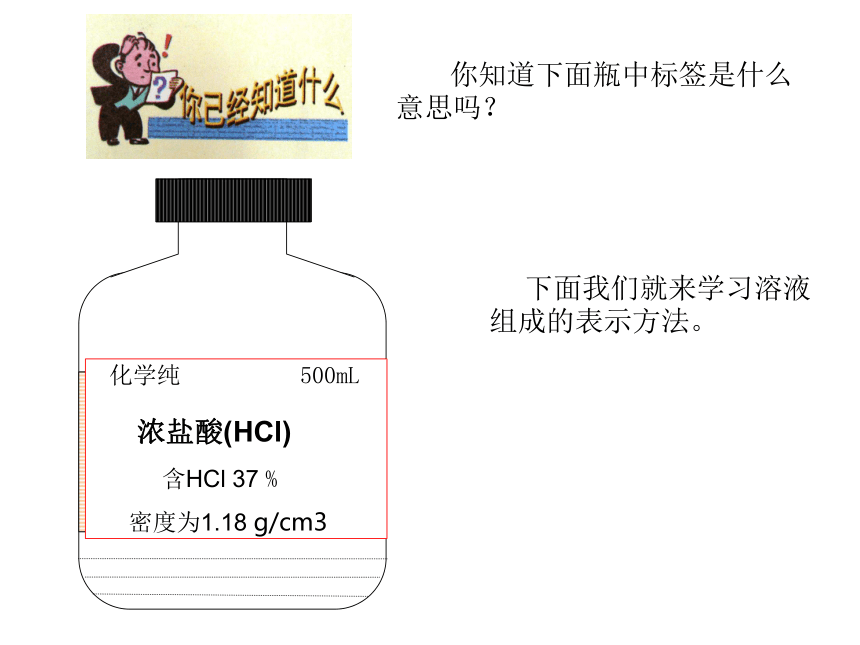
课件52张PPT。课题3 溶液的浓度 你知道下面瓶中标签是什么意思吗?化学纯 500mL
浓盐酸(HCl)
含HCl 37 %
密度为1.18 g/cm3
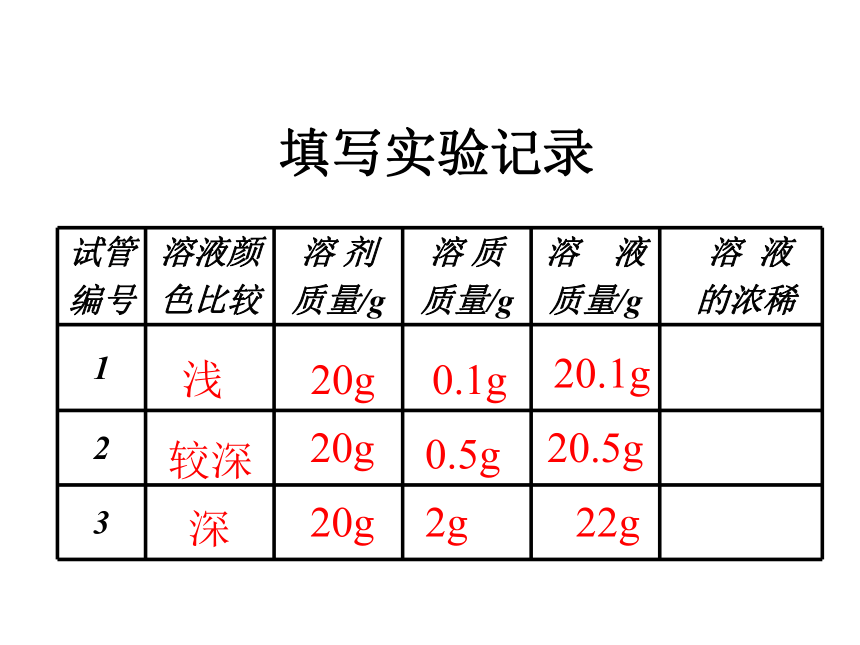
下面我们就来学习溶液组成的表示方法。颜色:淡蓝 蓝色 深蓝实验9-7浅较深深20g20g20g0.1g0.5g2g20.1g20.5g 22g填写实验记录5分析实验结论 ①对于有色溶液,我们可以根据颜色深浅来判断溶液是
浓还是浅;但是这种分法比较粗略,不能准确地表明一定
量溶液里究竟含有多少溶质。
②在实际应用中,常常要准确知道一定量溶液里含有多
少溶质,即溶液的浓度(浓稀程度)
一:溶质质量分数1、定义:是溶质质量和溶液质量之比 。2、公式:溶质质量溶液质量X100% 溶质质量分数=溶质的质量 =溶液质量 ×溶质质量分数注意:
①溶质的质量:形成溶液的那部分溶质,没有溶入溶液溶质的不计。
②溶液的质量=溶质的质量+溶剂的质量。
(必须分清溶质、溶剂与溶液)。
③计算时上下质量单位要统一。
④不要忘记X100%,最后得到百分数。
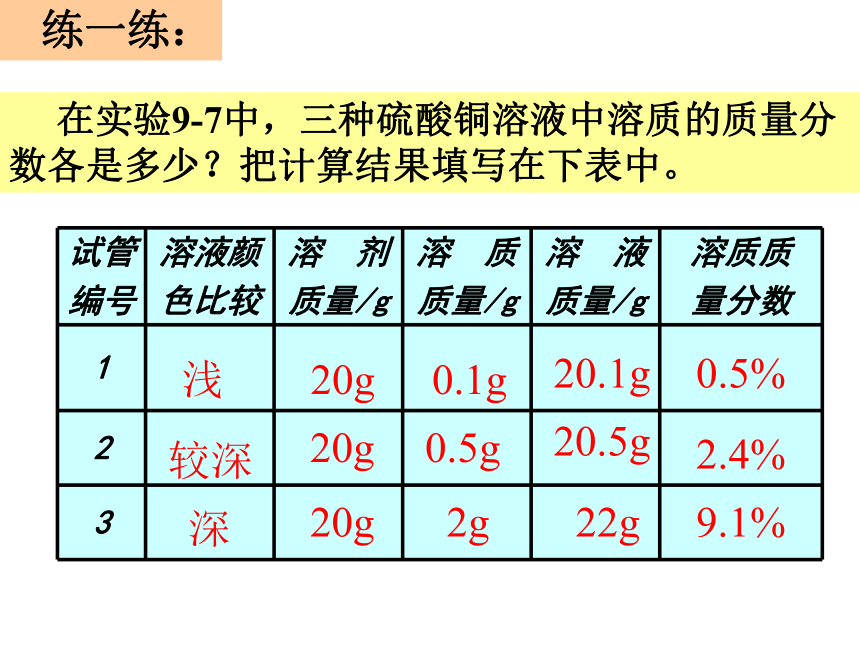
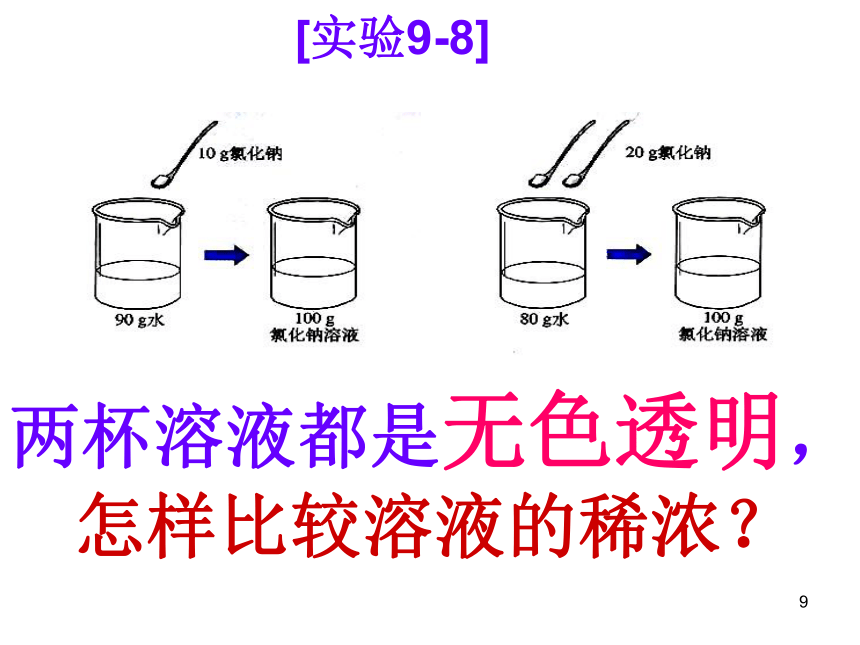
⑤物质的质量分数要在不超过其最大溶解量的范围时才有意义。浅较深深20g20g20g0.1g0.5g 2g20.1g20.5g 22g0.5%2.4%9.1% 练一练: 在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?把计算结果填写在下表中。9[实验9-8]两杯溶液都是无色透明,
怎样比较溶液的稀浓?结论:溶液中溶质的质量分数越大,溶液浓度越大固体溶解固体溶解10%
20%溶质质量分数的含义: 5 % 的食盐溶液
①.5g食盐溶于95g水形成的溶液。
②.食盐的质量占整个食盐溶液的5%。
③.将100g食盐溶液蒸干可以得到食盐5g。
④.组成:M(食盐):M(水):M(食盐溶液) =
5 : 95 : 100
溶质质量溶液质量生理盐水浓度是0.9%,每99.1克水和0.9克氯化钠溶解混合而成。 0.9%表示的意义是什么?
医用酒精浓度是75% ,每3体积的酒精和1体积的蒸馏水混合配制而成的的酒精溶液, 75%表示的意义是什么?讨论:[题型一] :有关溶质、溶剂和溶液之间的换算 二:溶质质量分数计算溶质质量溶液质量?100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :【例题1】在农业生产中,常需要用质量分数为16%的氯
化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各是多少?【解】答: 配制150kg质量分数为16%的氯化钠溶液
需24 kg氯化钠和126 kg水。练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 %解:20g X10%加水:20g +2g=9.1%加盐:20g X10%+2g20g +2g=18.2%16一、已知溶质或溶剂质量求溶质的质量分数1、10g溶质溶于90g水中溶质的质量分数为多少?2、用10g溶质配制成100g的溶液,则溶质的质量分数为多少?3、用80g水配制成了100g的溶液,则溶质的质量分数为多少?规律:已知任何两个质量都可求溶质的质量分数10%10%20%二、已知溶质的质量分数求溶质或溶剂质量4、要用10g的溶质配制10%的溶液,则需要多少克的水?5、要用45g的水配制10%的溶液,则需要溶质多少克?6、要配制100g的10%的溶液,则要溶质多少克?90g5g10g1.10克食盐能溶于90克水中,求所得溶液的食盐的质量分数?
2.若将上题中溶液倒出一半后剩余溶液中的质量分数为多少?
3.若在第1题的溶液中加入10克水,所得溶液的食盐的质量分数为多少?
4.若在第1题的溶液中加入10克食盐,食盐质量分数为多少?
5.若将第1题溶液的质量分数变为原来一半,需加水多少克?10%10%9.1%18.2%100g减少减少减少不变不变增加增加变稀增加不变增加变浓不变减少减少变浓2有40g溶质质量分数为5%的氯化钠溶液,若将其溶质的质量分数增大到10%,可以采取的方法是?解:方法一 增加溶质设应加入氯化钠固体的质量为x40gX5%+x=(40g+x)X10%)方法二 蒸发水分设应蒸发掉水的质量为y40gX5%=(40g—y)X10%解得 y=20g答:加入2.22g氯化钠,或蒸发掉20g水。解得 X=2.22g? [题型二] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量例:有100g20%NaOH溶液,要变成5%的NaOH溶液,需加入多少克水?练习;
1、50g5%的NaCl溶液加入50g水后,溶液的溶质质量分数为多少?
2、向150g溶质质量分数为20%的KNO3溶液中加入多少克水,溶液中溶质的质量分数为5%?
例题:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%答:需要水的质量195g需要水的质量= 245 g– 50g = 195g【解】设:稀释后溶液的质量为X。100g × 98% = X × 10%X = 980g需要水的质量 = 980g - 100g = 880g答:需要水的质量为880g。练习:1(课本P45)把100g质量分数为98%的浓硫酸
稀释成10%的稀硫酸,需要水的质量是多少? 例:将100g10%的NaOH溶液与50g20%混合,混合后溶液中溶质的质量分数是多少?? [题型三] :有关溶液混合的计算练习:
1、将50g10%的NaOH溶液与100g20%混合,混合后溶液中溶质的质量分数是多少?
2、要想使100g溶质质量分数为15%的NaCl溶液变为20%,需加入40%的NaCl溶液多少克? 请问溶质的质量分数与溶解度有什么区别? 溶质的质量分数36% 是指: 100克溶液中含有36克溶质。
溶质T0C时溶解度36克是指: 在T0C 时,100克水最多溶解该溶质36克。浓度与溶解度的比较表示溶液中溶质
质量的多少表示物质
溶解性的强弱 不一定一 定 不一定 不一定100克无单位必须饱和质量单位(克)联系:在一定温度下的饱和溶液中溶质的质量分数=在一定温度下的饱和溶液是最浓的溶液。 例1:20℃时,食盐的溶解度为36克,
(1)计算此温度下饱和食盐水的食盐的质量分数?[题型四] :饱和溶液中溶质的质量分数计算 (2)能否配制出20℃溶质质量分数为30%的食盐水?=26.5% 练习1、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:溶质在溶液中的质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18 < 20则:溶质在溶液中的质量分数为:×100% ≈ 26% 2、600C时,50克水最多能溶解55克硝酸钾,把600C时210克硝酸钾饱和溶液蒸发掉50克水后,再降至600C。晶体析出,求溶质在溶液中的质量分数。 分析:既然蒸发水后又降温,有晶体析出,说明溶液已经饱和,则溶液中溶质的质量分数可直接根据溶解度计算。解: 3、将600C时80%的硝酸铵溶液500克恒温蒸发掉5克水,析出10.5克晶体,求:600C时硝酸铵的溶解度。 分析:求溶解度就是计算100克水最多溶解的硝酸铵质量,或根据:饱和溶液中溶质质量分数)=S /(100+S)解:S = 410 克答:略sS练习1:100C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g练习:2(课本P45)在20℃时,将40g硝酸钾固体加入
100g水中,充分搅拌后,仍有8.4g硝酸钾固体
未溶解。请填写下列空白:
① 所得溶液是20℃时硝酸钾的 溶液;
(填“饱和”或“不饱”)
② 20℃时硝酸钾的溶解度为 ;
③ 所得溶液中硝酸钾的质量分数为 。24%31.6g饱和A练习1、 20℃时NaCl的溶解度为36克/100克水,
则在20℃时不可能配制的NaCl溶液是
( )
A 28% B 20% C 10% D 25%26.5%25克/100克水饱和练习2、 20℃时
(1)10ml的水最多能溶解3.6克A物质,则所得溶液中溶
质的质量分数为 .
(2)B的饱和溶液溶质的质量分数为20%,则此时B的溶解
度
(3)将C的饱和溶液50克恒温蒸发掉10克水,析出2克C物质
析出晶体后的溶液为 溶液.
(4)在40克水中加入15克D物质搅拌,充分溶液后仍有3克D
未溶解,所得溶液的质量为 克
综上所述 20 ℃时 A B C D 四种物质的溶解度由大
到小的顺序是 .A D B C52练习5. 30 ℃时,Ca(OH)2的溶解度为0.16克/100克水。
在此温度下,实验小组为制备饱和的澄清石灰
水,称取2.8克生石灰放入1000克水中,充分搅
拌后冷却到30 ℃,过滤后得澄清石灰水中,溶
质的质量为( )克。
A 等于2.8克 B 大于2.8克
C 小于1.6克 D 等于1.6克
C一、配制质量分数为6%的氯化钠溶液题型五、一定溶质质量分数的氯化钠溶液的配制【实验用品】托盘天平、烧杯、玻璃棒、药匙、量筒、 胶头滴管、 试剂瓶。氯化钠、蒸馏水。【实验步骤】【实验目的】1、练习配制一定溶质质量分数的溶液。2、加深对溶质的质量分数概念的理解。1、计算:氯化钠:50g×6%=3g 水:50g–3g= 47g2、称量:用托盘天平称量3g氯化钠,放入烧杯中;用量筒量取47mL的水,倒入烧杯中。3、溶解:用玻璃棒搅拌,使氯化钠溶解。4、装瓶贴标签:把配好的溶液装入试剂瓶,盖好瓶塞。写上名称[氯化钠溶液]和溶质的质量分数[6%].最后放到试剂柜中。
小结:用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管实验步骤:①计算;②称量;
③溶解;④装瓶,贴标签。练习:1下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。当堂练习:1、配制500mL密度为1.1g/mL的10%的NaOH溶液
需要多少gNaOH和多少g水?解:所需NaOH的质量为:500mL×1.1g/mL×10% = 55g所需水的质量为:500mL×1.1g/mL – 55g = 495g答:略ρ = 1.1g/mLV液= 500mLX%=10%分析:已知:未知:M溶质 M溶剂解: M溶液 = V液× ρ M溶质 = M溶液 × X% M溶剂= M溶液 - M溶质 2.在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是( )
A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码
B.用量筒量取蒸馏水读数时,仰视凹液面的最低处
C.将量筒中的水倒入烧杯时,有水洒出
D.将配好的氯化钠溶液转移到细口瓶时, 不慎撒出部分溶液B题型六、溶解度曲线与溶质质量分数
例:下图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是( )
A.在t1℃时,三种物质的溶解度由大到小的顺序是
B.在t2℃时,甲、乙两物质的溶解度
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液的是
D.当乙的饱和溶液中混有少量丙时,可采用 的方法析出丙
E.甲、乙、丙三种物质的饱和溶液从t2℃降温至 时,它们的溶液中溶质的质量分数由大到小的顺序是 t1℃注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型七]: 有关化学方程式的计算 【课本P45】1: 100g某硫酸溶液恰好与13g锌完全反应,
试计算这种硫酸中溶质的质量分数。【解】 :设这种硫酸中溶质的质量为XZn + H2SO4 = ZnSO4 + H2↑65 9813g X答:这种硫酸溶液中溶质的质量分数为19.6%。【解】 :盐酸中溶质的质量为:73g×20% = 14.6g练习:2(课本P45)73g质量分数为20%的盐酸与足量
大理石反应,生成二氧化碳的质量是多少?
这些二氧化碳的体积(标准状况)是多少?
(在标准状况下,CO2的密度为1.977g/L。)CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O设生成二氧化碳的质量为X73 4414.6g XX = 8.8g二氧化碳的体积 = 8.8g÷1.977g/L = 17.4L答:CO2的质量为8.8g;CO2的体积为17.4L3:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?解:设生成氢气的质量为x,硫酸的质量为y,生成硫酸锌的质量为z Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X= = 0.2g
y= =9.8g
z= =16.1g生成的硫酸锌溶液中溶质的质量分数为:
=15.15%答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。4:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)5: 26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。
(计算结果精确到0.1%2011年四川中考题)解:氢气的质量为0.2克。
设锌的质量为X,
Zn+ H2SO4 = ZnSO4+ H2↑
65 161 2
X Y 0.2g
65:X=2:0.2g X=6.5g
161:Y=2:0.2g Y=16.1g
黄铜中铜的质量分数:(26g-6.5g) / 26 g ×100%=75%
反应后所得溶液中溶质质量分数:16.1 g/ (125.8 g-19.5g ) ×100%=15.1%
答:黄铜中铜的质量分数为75% 反应后所得溶液中溶
质质量分数为15.1%
浓盐酸(HCl)
含HCl 37 %
密度为1.18 g/cm3
下面我们就来学习溶液组成的表示方法。颜色:淡蓝 蓝色 深蓝实验9-7浅较深深20g20g20g0.1g0.5g2g20.1g20.5g 22g填写实验记录5分析实验结论 ①对于有色溶液,我们可以根据颜色深浅来判断溶液是
浓还是浅;但是这种分法比较粗略,不能准确地表明一定
量溶液里究竟含有多少溶质。
②在实际应用中,常常要准确知道一定量溶液里含有多
少溶质,即溶液的浓度(浓稀程度)
一:溶质质量分数1、定义:是溶质质量和溶液质量之比 。2、公式:溶质质量溶液质量X100% 溶质质量分数=溶质的质量 =溶液质量 ×溶质质量分数注意:
①溶质的质量:形成溶液的那部分溶质,没有溶入溶液溶质的不计。
②溶液的质量=溶质的质量+溶剂的质量。
(必须分清溶质、溶剂与溶液)。
③计算时上下质量单位要统一。
④不要忘记X100%,最后得到百分数。
⑤物质的质量分数要在不超过其最大溶解量的范围时才有意义。浅较深深20g20g20g0.1g0.5g 2g20.1g20.5g 22g0.5%2.4%9.1% 练一练: 在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?把计算结果填写在下表中。9[实验9-8]两杯溶液都是无色透明,
怎样比较溶液的稀浓?结论:溶液中溶质的质量分数越大,溶液浓度越大固体溶解固体溶解10%
20%溶质质量分数的含义: 5 % 的食盐溶液
①.5g食盐溶于95g水形成的溶液。
②.食盐的质量占整个食盐溶液的5%。
③.将100g食盐溶液蒸干可以得到食盐5g。
④.组成:M(食盐):M(水):M(食盐溶液) =
5 : 95 : 100
溶质质量溶液质量生理盐水浓度是0.9%,每99.1克水和0.9克氯化钠溶解混合而成。 0.9%表示的意义是什么?
医用酒精浓度是75% ,每3体积的酒精和1体积的蒸馏水混合配制而成的的酒精溶液, 75%表示的意义是什么?讨论:[题型一] :有关溶质、溶剂和溶液之间的换算 二:溶质质量分数计算溶质质量溶液质量?100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :【例题1】在农业生产中,常需要用质量分数为16%的氯
化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各是多少?【解】答: 配制150kg质量分数为16%的氯化钠溶液
需24 kg氯化钠和126 kg水。练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 %解:20g X10%加水:20g +2g=9.1%加盐:20g X10%+2g20g +2g=18.2%16一、已知溶质或溶剂质量求溶质的质量分数1、10g溶质溶于90g水中溶质的质量分数为多少?2、用10g溶质配制成100g的溶液,则溶质的质量分数为多少?3、用80g水配制成了100g的溶液,则溶质的质量分数为多少?规律:已知任何两个质量都可求溶质的质量分数10%10%20%二、已知溶质的质量分数求溶质或溶剂质量4、要用10g的溶质配制10%的溶液,则需要多少克的水?5、要用45g的水配制10%的溶液,则需要溶质多少克?6、要配制100g的10%的溶液,则要溶质多少克?90g5g10g1.10克食盐能溶于90克水中,求所得溶液的食盐的质量分数?
2.若将上题中溶液倒出一半后剩余溶液中的质量分数为多少?
3.若在第1题的溶液中加入10克水,所得溶液的食盐的质量分数为多少?
4.若在第1题的溶液中加入10克食盐,食盐质量分数为多少?
5.若将第1题溶液的质量分数变为原来一半,需加水多少克?10%10%9.1%18.2%100g减少减少减少不变不变增加增加变稀增加不变增加变浓不变减少减少变浓2有40g溶质质量分数为5%的氯化钠溶液,若将其溶质的质量分数增大到10%,可以采取的方法是?解:方法一 增加溶质设应加入氯化钠固体的质量为x40gX5%+x=(40g+x)X10%)方法二 蒸发水分设应蒸发掉水的质量为y40gX5%=(40g—y)X10%解得 y=20g答:加入2.22g氯化钠,或蒸发掉20g水。解得 X=2.22g? [题型二] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量例:有100g20%NaOH溶液,要变成5%的NaOH溶液,需加入多少克水?练习;
1、50g5%的NaCl溶液加入50g水后,溶液的溶质质量分数为多少?
2、向150g溶质质量分数为20%的KNO3溶液中加入多少克水,溶液中溶质的质量分数为5%?
例题:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%答:需要水的质量195g需要水的质量= 245 g– 50g = 195g【解】设:稀释后溶液的质量为X。100g × 98% = X × 10%X = 980g需要水的质量 = 980g - 100g = 880g答:需要水的质量为880g。练习:1(课本P45)把100g质量分数为98%的浓硫酸
稀释成10%的稀硫酸,需要水的质量是多少? 例:将100g10%的NaOH溶液与50g20%混合,混合后溶液中溶质的质量分数是多少?? [题型三] :有关溶液混合的计算练习:
1、将50g10%的NaOH溶液与100g20%混合,混合后溶液中溶质的质量分数是多少?
2、要想使100g溶质质量分数为15%的NaCl溶液变为20%,需加入40%的NaCl溶液多少克? 请问溶质的质量分数与溶解度有什么区别? 溶质的质量分数36% 是指: 100克溶液中含有36克溶质。
溶质T0C时溶解度36克是指: 在T0C 时,100克水最多溶解该溶质36克。浓度与溶解度的比较表示溶液中溶质
质量的多少表示物质
溶解性的强弱 不一定一 定 不一定 不一定100克无单位必须饱和质量单位(克)联系:在一定温度下的饱和溶液中溶质的质量分数=在一定温度下的饱和溶液是最浓的溶液。 例1:20℃时,食盐的溶解度为36克,
(1)计算此温度下饱和食盐水的食盐的质量分数?[题型四] :饱和溶液中溶质的质量分数计算 (2)能否配制出20℃溶质质量分数为30%的食盐水?=26.5% 练习1、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:溶质在溶液中的质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18 < 20则:溶质在溶液中的质量分数为:×100% ≈ 26% 2、600C时,50克水最多能溶解55克硝酸钾,把600C时210克硝酸钾饱和溶液蒸发掉50克水后,再降至600C。晶体析出,求溶质在溶液中的质量分数。 分析:既然蒸发水后又降温,有晶体析出,说明溶液已经饱和,则溶液中溶质的质量分数可直接根据溶解度计算。解: 3、将600C时80%的硝酸铵溶液500克恒温蒸发掉5克水,析出10.5克晶体,求:600C时硝酸铵的溶解度。 分析:求溶解度就是计算100克水最多溶解的硝酸铵质量,或根据:饱和溶液中溶质质量分数)=S /(100+S)解:S = 410 克答:略sS练习1:100C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g练习:2(课本P45)在20℃时,将40g硝酸钾固体加入
100g水中,充分搅拌后,仍有8.4g硝酸钾固体
未溶解。请填写下列空白:
① 所得溶液是20℃时硝酸钾的 溶液;
(填“饱和”或“不饱”)
② 20℃时硝酸钾的溶解度为 ;
③ 所得溶液中硝酸钾的质量分数为 。24%31.6g饱和A练习1、 20℃时NaCl的溶解度为36克/100克水,
则在20℃时不可能配制的NaCl溶液是
( )
A 28% B 20% C 10% D 25%26.5%25克/100克水饱和练习2、 20℃时
(1)10ml的水最多能溶解3.6克A物质,则所得溶液中溶
质的质量分数为 .
(2)B的饱和溶液溶质的质量分数为20%,则此时B的溶解
度
(3)将C的饱和溶液50克恒温蒸发掉10克水,析出2克C物质
析出晶体后的溶液为 溶液.
(4)在40克水中加入15克D物质搅拌,充分溶液后仍有3克D
未溶解,所得溶液的质量为 克
综上所述 20 ℃时 A B C D 四种物质的溶解度由大
到小的顺序是 .A D B C52练习5. 30 ℃时,Ca(OH)2的溶解度为0.16克/100克水。
在此温度下,实验小组为制备饱和的澄清石灰
水,称取2.8克生石灰放入1000克水中,充分搅
拌后冷却到30 ℃,过滤后得澄清石灰水中,溶
质的质量为( )克。
A 等于2.8克 B 大于2.8克
C 小于1.6克 D 等于1.6克
C一、配制质量分数为6%的氯化钠溶液题型五、一定溶质质量分数的氯化钠溶液的配制【实验用品】托盘天平、烧杯、玻璃棒、药匙、量筒、 胶头滴管、 试剂瓶。氯化钠、蒸馏水。【实验步骤】【实验目的】1、练习配制一定溶质质量分数的溶液。2、加深对溶质的质量分数概念的理解。1、计算:氯化钠:50g×6%=3g 水:50g–3g= 47g2、称量:用托盘天平称量3g氯化钠,放入烧杯中;用量筒量取47mL的水,倒入烧杯中。3、溶解:用玻璃棒搅拌,使氯化钠溶解。4、装瓶贴标签:把配好的溶液装入试剂瓶,盖好瓶塞。写上名称[氯化钠溶液]和溶质的质量分数[6%].最后放到试剂柜中。
小结:用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管实验步骤:①计算;②称量;
③溶解;④装瓶,贴标签。练习:1下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。当堂练习:1、配制500mL密度为1.1g/mL的10%的NaOH溶液
需要多少gNaOH和多少g水?解:所需NaOH的质量为:500mL×1.1g/mL×10% = 55g所需水的质量为:500mL×1.1g/mL – 55g = 495g答:略ρ = 1.1g/mLV液= 500mLX%=10%分析:已知:未知:M溶质 M溶剂解: M溶液 = V液× ρ M溶质 = M溶液 × X% M溶剂= M溶液 - M溶质 2.在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是( )
A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码
B.用量筒量取蒸馏水读数时,仰视凹液面的最低处
C.将量筒中的水倒入烧杯时,有水洒出
D.将配好的氯化钠溶液转移到细口瓶时, 不慎撒出部分溶液B题型六、溶解度曲线与溶质质量分数
例:下图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是( )
A.在t1℃时,三种物质的溶解度由大到小的顺序是
B.在t2℃时,甲、乙两物质的溶解度
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液的是
D.当乙的饱和溶液中混有少量丙时,可采用 的方法析出丙
E.甲、乙、丙三种物质的饱和溶液从t2℃降温至 时,它们的溶液中溶质的质量分数由大到小的顺序是 t1℃注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型七]: 有关化学方程式的计算 【课本P45】1: 100g某硫酸溶液恰好与13g锌完全反应,
试计算这种硫酸中溶质的质量分数。【解】 :设这种硫酸中溶质的质量为XZn + H2SO4 = ZnSO4 + H2↑65 9813g X答:这种硫酸溶液中溶质的质量分数为19.6%。【解】 :盐酸中溶质的质量为:73g×20% = 14.6g练习:2(课本P45)73g质量分数为20%的盐酸与足量
大理石反应,生成二氧化碳的质量是多少?
这些二氧化碳的体积(标准状况)是多少?
(在标准状况下,CO2的密度为1.977g/L。)CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O设生成二氧化碳的质量为X73 4414.6g XX = 8.8g二氧化碳的体积 = 8.8g÷1.977g/L = 17.4L答:CO2的质量为8.8g;CO2的体积为17.4L3:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?解:设生成氢气的质量为x,硫酸的质量为y,生成硫酸锌的质量为z Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X= = 0.2g
y= =9.8g
z= =16.1g生成的硫酸锌溶液中溶质的质量分数为:
=15.15%答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。4:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)5: 26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。
(计算结果精确到0.1%2011年四川中考题)解:氢气的质量为0.2克。
设锌的质量为X,
Zn+ H2SO4 = ZnSO4+ H2↑
65 161 2
X Y 0.2g
65:X=2:0.2g X=6.5g
161:Y=2:0.2g Y=16.1g
黄铜中铜的质量分数:(26g-6.5g) / 26 g ×100%=75%
反应后所得溶液中溶质质量分数:16.1 g/ (125.8 g-19.5g ) ×100%=15.1%
答:黄铜中铜的质量分数为75% 反应后所得溶液中溶
质质量分数为15.1%
同课章节目录
