第八单元课题2金属化学性质(市级公开课 )(共40张PPT)
文档属性
| 名称 | 第八单元课题2金属化学性质(市级公开课 )(共40张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-04-10 20:15:57 | ||
图片预览








文档简介
课件40张PPT。8.2 金属的化学性质小趣事 盛宴中,拿破仑为什么使用铝碗而不用银碗呢? 2.认识常见金属与盐酸、稀硫酸以及其他
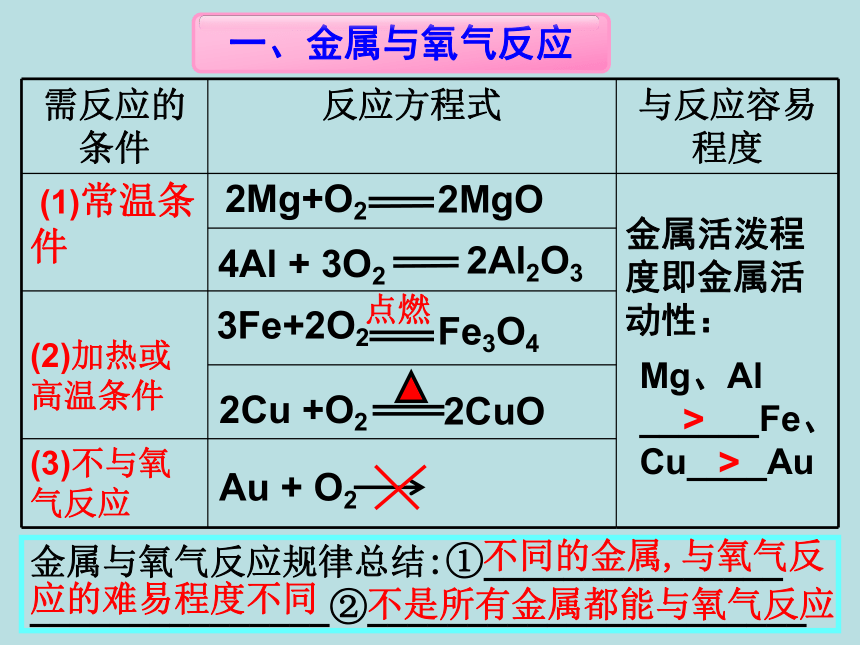
金属化合物溶液反应。 3.了解置换反应及金属活动性顺序。 1.知道常见金属与氧气的反应 。学习目标知识回顾:我们学过哪些金属与其他物质反应? 1.金属能与__
______反应 2.金属能与____
_________反应 3.金属能与_____
___________反应 氧气 盐酸、稀硫酸 其他金属化合物溶液我们学过哪些金属与其他物质反应?点燃金属活泼程度即金属活动性:金属与氧气反应规律总结:①_______________ _______________②______________________ 不同的金属,与氧气反应的难易程度不同不是所有金属都能与氧气反应 Mg、Al
______Fe、Cu____Au>>1.铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?为什么不宜用钢刷、沙等擦洗铝制品?
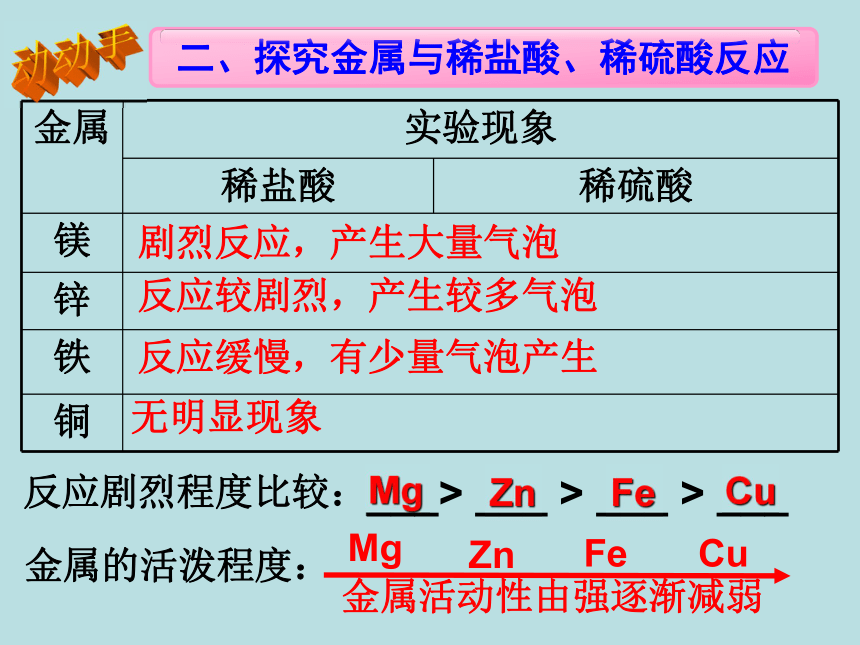
______________________________________
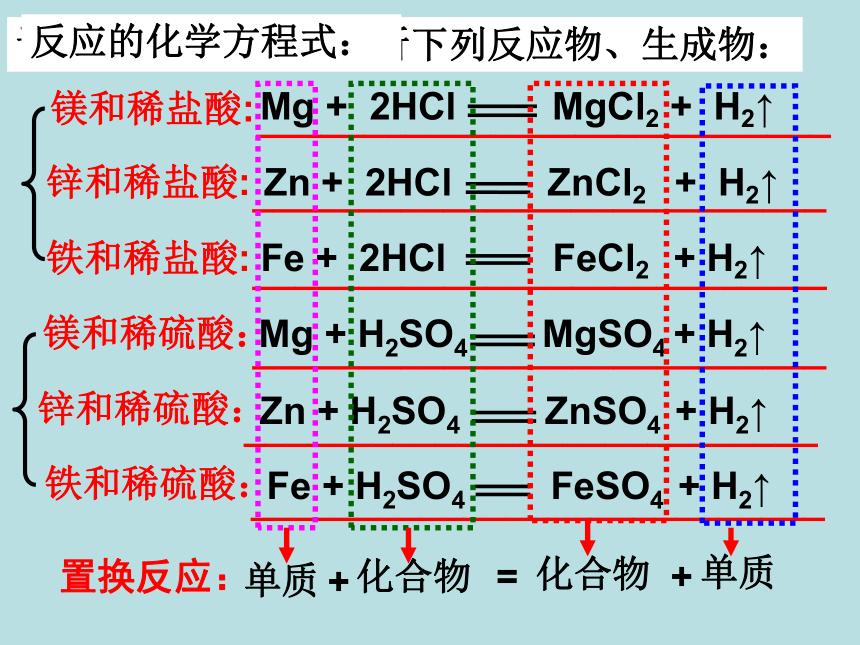
_____________________________应用:新铝锅旧铝锅2.“真金不怕火炼”说明金的化学性质__________铝和氧气反应生成致密的氧化铝薄膜,覆盖在铝的 表面,阻止铝的进一步氧化。不活泼剧烈反应,产生大量气泡反应较剧烈,产生较多气泡反应缓慢,有少量气泡产生无明显现象金属活动性由强逐渐减弱反应剧烈程度比较:___> ___ > ___ > ___金属的活泼程度:MgZnFeCuMgZnFeCu动动手练习:下图是Mg、Zn、Fe、Cu与盐酸反应的实验现象,仔细观察下图并回答问题:根据反应现象,这四种金属的活泼性顺序为( )B. Mg >Zn >Fe >CuA. Cu >Fe >Zn >MgC. Zn > Mg >Fe >CuD. Mg >Zn >Cu >FeB剧烈反应,产生大量气泡反应较剧烈,产生较多气泡反应缓慢,有少量气泡产生无明显现象 试总结金属与稀盐酸、稀硫酸反应的规律:
①_________________________________
②_________________________________不同种的金属,与同种稀盐酸反应的快慢不同不是所有金属都能与稀盐酸、稀硫酸反应。__________________________________________________________________________________________________________________________________________________________________锌和稀硫酸:铁和稀硫酸:镁和稀硫酸:锌和稀盐酸: 铁和稀盐酸: 镁和稀盐酸: 单质化合物化合物单质++=置换反应:请从单质/化合物去分析下列反应物、生成物:反应的化学方程式:
1.下列各反应属于置换反应的是( )C 由一种单质和一种化合物反应,生成
另一种单质和另一种化合物的反应。 置换反应:
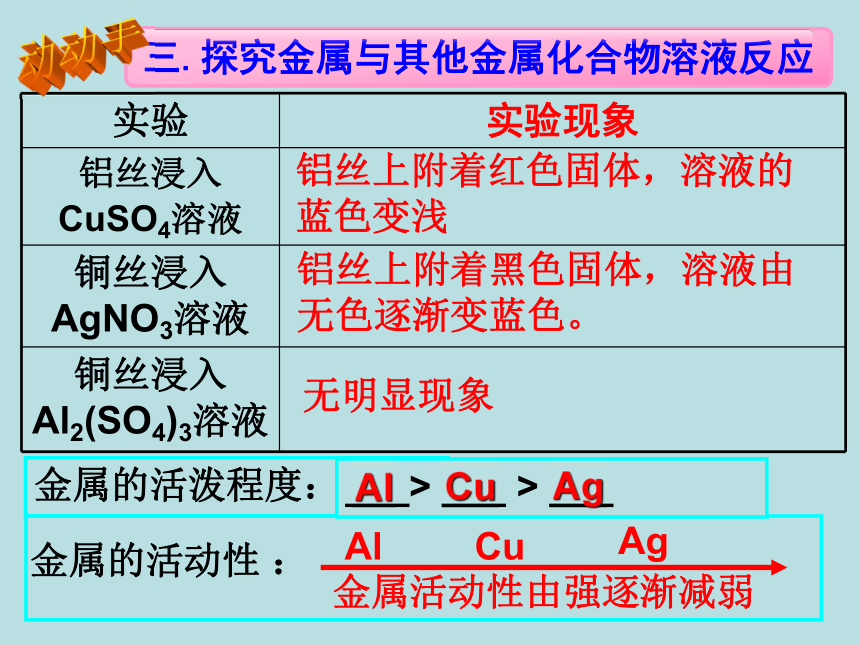
铝丝上附着红色固体,溶液的蓝色变浅铝丝上附着黑色固体,溶液由无色逐渐变蓝色。无明显现象金属的活泼程度:___> ___ > ___ AlCuAg金属活动性由强逐渐减弱金属的活动性 :AlCuAg动动手不反应试总结金属与其他金属化合物溶液反应的规律:
①_________________________________
_________________________________金属活动性强的金属能把金属活动性比它弱的金属从它的化合物溶液中置换出来8.2 金属的化学性质课 时 2剧烈反应,产生大量气泡反应较剧烈,产生较多气泡反应缓慢,有少量气泡产生,溶液变浅绿色。铝丝表面附着红色物质,溶液由蓝色变无色铜片表面附着银白色物质,溶液由无色逐渐变蓝色。铁钉表面附着红色物质,溶液由蓝色逐渐变浅绿色。蓝色溶液:___________________________浅绿色溶液:__________________________ ____________________________CuSO4、CuCl2 等含Cu2+的溶液FeSO4、FeCl2 等含Fe2+的溶液Fe2(SO4)3、FeCl3 等含Fe3+的溶液红色固体:_________紫红色溶液:_______Cu、Fe2O3KMnO4蓝色沉淀:________红褐色沉淀:_______Fe(OH)3Cu(OH)2黑色固体:____________________________CuO、MnO2、Fe3O4、铁粉(Fe)、C黄色固体:___紫黑色固体:________SKMnO4有刺激性气味的气体:__________________SO2、NH3、HCl黄色溶液:置换反应后铁的化合物中铁元素的化合价都为+2价练习:1.写出铁与氯化铜溶液、铁与硝酸银溶液反应的化学方程式。2. 为探究Al、Fe、Cu三种金属的活动性顺序,有甲、乙、丙三位同学设计了如下方案:(1)甲同学将金属分别放入盛有盐酸的3支试管中.根据铜加入盐酸中无变化,铝与盐酸反应比铁剧烈_____________________现象,判断出Al>Fe>Cu.(2)乙同学只用一支试管,只取一次盐酸也能证明Al>Fe>Cu,他在盐酸中插入金属的顺序是Fe________。(3)丙同学只调整了乙同学插入盐酸中金属的顺序,也能得到正确结论.丙同学调整金属的顺序为__________
(4)在CuCl2和AlCl3的混合溶液中加入一定量的铁粉充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是_____
人们经过类似于上述探究,归纳和总结出了常见金属在溶液中的活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au对金属活动顺序表的认识:1.金属位置越靠前,它的活动性就越强。2.位于氢前面的金属能置换出盐酸、稀硫酸中的氢。3.位于前面的金属能把位于后面的金属从他们的化合物溶液里置换出来。金属活动性顺序由强逐渐减弱“越前越强”“前金换后金”“前氢换氢”常见金属活动性顺序表的应用:1.金属与酸、金属与其他金属盐溶液是否发生反应的判断。练习:判断下列反应是否能发生,说出你的理由。(1)Mg + HCl(2)Fe + HCl(3)Ag + H2SO4(4)Zn + CuSO4(8)Ag + ZnSO4(6)Al + CuSO4(7)Cu + AgNO3(5)Cu + ZnSO4(9)Cu + H2SO4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性顺序由强逐渐减弱 1.餐厅里的调味品盐、油、酱、醋(假设醋酸化学式可表示为HR),用小铝杯盛放着,你们认为这种做法合理吗?为什么?
_____________________________________化学与生活2.老农家的葡萄园里葡萄树“生病”了,为了给树冶病,他用铁桶将硫酸铜(CuSO4)、熟石灰加水配了大桶波尔多液以备随时杀菌之用。你们认为他这样做合理吗?为什么?
_____________________________________不合理,因为铝可以和醋酸反应不合理,因为铁可以和溶液里的CuSO4反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性顺序由强逐渐减弱3.不法商贩常常用黄铜(铜、锌合金)制的假金首饰坑害消费者,黄铜和黄金外观相似。小明妈妈在市场上买了一条纯金项链。小明用刚学习的科学知识来了个“火眼识真金”:
(1)看颜色是不是金光闪闪;
(2)泡在食醋中,看是否有气泡产生;
(3)放在火上烧,看是否变色;
(4)将食盐水(NaCl)滴在项链上看是否表面变色。?
你们认为小明的方法中哪些是合理的呢?_______(2)(3)4.将铁片分别放入下列溶液中充分反应,反应后溶液质量比反应前减轻的是( )
A.AgNO3 B.H2SO4 C.HCl D.FeSO4A5.在金属活动顺序表中,K与Na相邻,其化学性质也相似。已知金属K投入盐的水溶液中,先发生如下反应:2K+2H2O==2KOH+H2↑.则金属Na投入CuSO4溶液中发生化学反应方程式为_________6.为探究金属Mg和Al的活动性,实验前先用砂纸打磨镁条和铝片,目的是____________________7.学完金属活动性知识后,试总结金属活动性强弱的方法有①________________②__________探究活动:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等. (1)该实验的目的是:
①___________________
_____________________
②___________________
_____________________两支长颈漏斗中产生的现象的不同之处_______
_________________________________________ 比较镁、铁与稀盐酸反应的剧烈程度 比较相同时间内镁、铁与稀盐酸反应放出热量的多少; 甲装置长颈漏斗中的液面比乙装置中的高 2.设计实验验证金属活动性顺序(1)两种金属的验证方法例:设计实验证明Fe、Cu两种金属的活动性顺序
_________________________________________(2)三种金属的验证方法②_______________________________________(两边盐溶液,中间金属)设计实验证明Zn、Fe、Ag三种金属的活动性顺序。方案1:Fe、Cu、稀盐酸 方案2:Fe、CuSO4溶液①__________________________________Zn、Fe、Ag、稀盐酸(注:要控制变量)(两边金属,中间盐溶液)用Zn、FeSO4溶液、Ag③_______________________________用ZnSO4溶液、Fe、AgNO3溶液1.只用下列选项所给出的试剂进行实验,能得到Zn、Cu、Ag三种金属正确的活动性顺序的是( )
A.Zn(NO3)2溶液、Cu(NO3)2溶液、Ag
B.Zn(NO3)2溶液、AgNO3溶液、Cu
C.稀H2SO4、Zn、Cu、Ag
D.Zn(NO3)2溶液、Cu、AgB2.为验证金属活动性Zn>Fe>Cu这一结论,下面实验设计合理的是( )
A.将Zn、Cu两金属片分别放入稀盐酸中 B.将Fe、Cu两金属片分别放入稀盐酸中 C.将Zn、Fe两金属片分别放入CuCl2溶液中 D.将Zn、Cu两金属片分别放入FeCl2溶液中D3.(2012年梅州中考)现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:I.将铁片浸入稀硫酸中,II.将银片浸入稀硫酸中,III.将铁片浸入硫酸铜溶液中.(1)实验I的现象是_________,有气泡产生,溶液由无色逐渐变为浅绿色.反应的化学方程式为________________________;
反应产生的气体可用__________的方法检验.
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的___
_________________(写出实验操作和现象).
(3)将银、铜、铁的两种金属分别放入______溶液中,即可验证这三种金属的活动性强弱. 练习:为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式__________________________________.
你认为小明的实验能否比较锌和铝的金属活动性强弱?______你的理由是____________________
__________________________________________不能 小明实验方案中没有控制盐酸的浓度、铝片和锌粒的表面积相关变量。(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是______________
__________________________________________ 未去膜的铝片表面有氧化铝,氧化铝先与盐酸反应。3、关于优先反应问题例1:锌、铁、铜组成的混合物投入到硝酸银溶液中,哪种金属先反应?例2:锌投入到硝酸银和硝酸铜混合溶液中,溶液中的铜和银,哪种金属先被置换出来?答:先是锌与硝酸银反应,再到铁与硝酸银反应,最后到铜与硝酸银反应。 答:银先被置换出来,银被置换完后再到铜被置换出来。1.在盛有AgNO3和Cu(NO3)2混合溶液的试管中,加入一定量的锌粉充分反应,试管底部有少量固体存在。过滤,向滤液中加稀盐酸,产生白色沉淀,滤渣是( )
A. Cu B. Ag C. Zn和Ag D. Zn和Cu2.向含AgNO3、Cu(NO3)2、Zn(NO3)2的混合液中,加入一些铁粉,待反应完成后过滤,下列情况是可能存在的是( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+
B.滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+
C.滤纸上有Ag、Fe,滤液中有Zn2+、Fe2+
D.滤纸上有Ag、Zn、Fe,滤液中有Zn2+、Fe2+BA3、在AgNO3和Cu(NO3)2的混合物中加入一定量的铁粉,充分反应后过滤: ①若在滤液中加入稀盐酸出现白色沉淀。则滤液中一定有___________________________。 滤纸上一定含有______________; ②若在滤液中加入稀HCl无任何现象。则滤纸上一定含有___________;可能含有_______________。 ③若在滤液中插入铁片,取出后无任何变化。则滤纸上一定有_________; 可能有__________。 ④若将滤纸上的固体放入稀HCl中,生成无色可燃性气体。则滤液中一定有____________。 滤纸的物质一定是______________;Fe(NO3)2、AgNO3、Cu(NO3)2AgAg、CuFeAg 和CuFeFe(NO3)2Ag、Cu和Fe4.除杂题1.填写下列表格(“混合物栏括号内为杂质”)除杂原则:不增(不增加新的杂质)、不减(被提纯的物质不减少)、易分(操作简单、容易分离)除杂方法:
一、物理方法:(1)过滤法。(2)吸附法。
二、化学方法:(1)转化法(把杂质转化成被提纯的物质)(2)除去法。(将杂质转为气体、沉淀或溶液而除去)(1)转化法(把杂质转化成被提纯的物质)灼热的CuO高温煅烧加入过量铁粉,过滤通入NaHCO3溶液(2)除去法(将杂质转为气体、沉淀或溶液而除去)灼热的铜网通入NaOH溶液后干燥稀盐酸例1:等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D.产生H2的速率N>MC5.图像题5.图像题5.金属与酸反应的图像题1.首先理解横、纵坐标的含义。2.其次把握曲线的四个点,即起点、转折点、交点、终点。解题思路:类型一:等量的金属与足量的酸反应。
产生氢气的质量关系_______________Al > Mg > Fe > Zn 类型二:足量的金属与等量的酸反应。
产生氢气的质量相等。练习1、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D.产生H2的速率N>MC练习2:在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡。分别向两边烧杯各加入5g镁和5g铁,镁和铁全部反应而消失后,天平的指针( )
A.偏向加铁的一边 B. 偏向加镁的一边
C.仍停留在原来的位置 D. 无法确定A练习3:在托盘天平两端的烧杯内,分别盛有等质量、等质量分数的足量的稀硫酸,调节天平至平衡。现向左边烧杯中加入6.5g的铁钉,同时向右边烧杯中加入6.5g锌粒。在实验过程中,观察到指针偏转的情况是( )
A.始终向左偏 B.不发生偏转
C.始终向右偏 D.最初向左偏转,然后向右偏转D评价总结 通过这节课的学习你有哪些收获呢?
你呢?祝大家开心快乐!!
金属化合物溶液反应。 3.了解置换反应及金属活动性顺序。 1.知道常见金属与氧气的反应 。学习目标知识回顾:我们学过哪些金属与其他物质反应? 1.金属能与__
______反应 2.金属能与____
_________反应 3.金属能与_____
___________反应 氧气 盐酸、稀硫酸 其他金属化合物溶液我们学过哪些金属与其他物质反应?点燃金属活泼程度即金属活动性:金属与氧气反应规律总结:①_______________ _______________②______________________ 不同的金属,与氧气反应的难易程度不同不是所有金属都能与氧气反应 Mg、Al
______Fe、Cu____Au>>1.铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?为什么不宜用钢刷、沙等擦洗铝制品?
______________________________________
_____________________________应用:新铝锅旧铝锅2.“真金不怕火炼”说明金的化学性质__________铝和氧气反应生成致密的氧化铝薄膜,覆盖在铝的 表面,阻止铝的进一步氧化。不活泼剧烈反应,产生大量气泡反应较剧烈,产生较多气泡反应缓慢,有少量气泡产生无明显现象金属活动性由强逐渐减弱反应剧烈程度比较:___> ___ > ___ > ___金属的活泼程度:MgZnFeCuMgZnFeCu动动手练习:下图是Mg、Zn、Fe、Cu与盐酸反应的实验现象,仔细观察下图并回答问题:根据反应现象,这四种金属的活泼性顺序为( )B. Mg >Zn >Fe >CuA. Cu >Fe >Zn >MgC. Zn > Mg >Fe >CuD. Mg >Zn >Cu >FeB剧烈反应,产生大量气泡反应较剧烈,产生较多气泡反应缓慢,有少量气泡产生无明显现象 试总结金属与稀盐酸、稀硫酸反应的规律:
①_________________________________
②_________________________________不同种的金属,与同种稀盐酸反应的快慢不同不是所有金属都能与稀盐酸、稀硫酸反应。__________________________________________________________________________________________________________________________________________________________________锌和稀硫酸:铁和稀硫酸:镁和稀硫酸:锌和稀盐酸: 铁和稀盐酸: 镁和稀盐酸: 单质化合物化合物单质++=置换反应:请从单质/化合物去分析下列反应物、生成物:反应的化学方程式:
1.下列各反应属于置换反应的是( )C 由一种单质和一种化合物反应,生成
另一种单质和另一种化合物的反应。 置换反应:
铝丝上附着红色固体,溶液的蓝色变浅铝丝上附着黑色固体,溶液由无色逐渐变蓝色。无明显现象金属的活泼程度:___> ___ > ___ AlCuAg金属活动性由强逐渐减弱金属的活动性 :AlCuAg动动手不反应试总结金属与其他金属化合物溶液反应的规律:
①_________________________________
_________________________________金属活动性强的金属能把金属活动性比它弱的金属从它的化合物溶液中置换出来8.2 金属的化学性质课 时 2剧烈反应,产生大量气泡反应较剧烈,产生较多气泡反应缓慢,有少量气泡产生,溶液变浅绿色。铝丝表面附着红色物质,溶液由蓝色变无色铜片表面附着银白色物质,溶液由无色逐渐变蓝色。铁钉表面附着红色物质,溶液由蓝色逐渐变浅绿色。蓝色溶液:___________________________浅绿色溶液:__________________________ ____________________________CuSO4、CuCl2 等含Cu2+的溶液FeSO4、FeCl2 等含Fe2+的溶液Fe2(SO4)3、FeCl3 等含Fe3+的溶液红色固体:_________紫红色溶液:_______Cu、Fe2O3KMnO4蓝色沉淀:________红褐色沉淀:_______Fe(OH)3Cu(OH)2黑色固体:____________________________CuO、MnO2、Fe3O4、铁粉(Fe)、C黄色固体:___紫黑色固体:________SKMnO4有刺激性气味的气体:__________________SO2、NH3、HCl黄色溶液:置换反应后铁的化合物中铁元素的化合价都为+2价练习:1.写出铁与氯化铜溶液、铁与硝酸银溶液反应的化学方程式。2. 为探究Al、Fe、Cu三种金属的活动性顺序,有甲、乙、丙三位同学设计了如下方案:(1)甲同学将金属分别放入盛有盐酸的3支试管中.根据铜加入盐酸中无变化,铝与盐酸反应比铁剧烈_____________________现象,判断出Al>Fe>Cu.(2)乙同学只用一支试管,只取一次盐酸也能证明Al>Fe>Cu,他在盐酸中插入金属的顺序是Fe________。(3)丙同学只调整了乙同学插入盐酸中金属的顺序,也能得到正确结论.丙同学调整金属的顺序为__________
(4)在CuCl2和AlCl3的混合溶液中加入一定量的铁粉充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是_____
人们经过类似于上述探究,归纳和总结出了常见金属在溶液中的活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au对金属活动顺序表的认识:1.金属位置越靠前,它的活动性就越强。2.位于氢前面的金属能置换出盐酸、稀硫酸中的氢。3.位于前面的金属能把位于后面的金属从他们的化合物溶液里置换出来。金属活动性顺序由强逐渐减弱“越前越强”“前金换后金”“前氢换氢”常见金属活动性顺序表的应用:1.金属与酸、金属与其他金属盐溶液是否发生反应的判断。练习:判断下列反应是否能发生,说出你的理由。(1)Mg + HCl(2)Fe + HCl(3)Ag + H2SO4(4)Zn + CuSO4(8)Ag + ZnSO4(6)Al + CuSO4(7)Cu + AgNO3(5)Cu + ZnSO4(9)Cu + H2SO4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性顺序由强逐渐减弱 1.餐厅里的调味品盐、油、酱、醋(假设醋酸化学式可表示为HR),用小铝杯盛放着,你们认为这种做法合理吗?为什么?
_____________________________________化学与生活2.老农家的葡萄园里葡萄树“生病”了,为了给树冶病,他用铁桶将硫酸铜(CuSO4)、熟石灰加水配了大桶波尔多液以备随时杀菌之用。你们认为他这样做合理吗?为什么?
_____________________________________不合理,因为铝可以和醋酸反应不合理,因为铁可以和溶液里的CuSO4反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性顺序由强逐渐减弱3.不法商贩常常用黄铜(铜、锌合金)制的假金首饰坑害消费者,黄铜和黄金外观相似。小明妈妈在市场上买了一条纯金项链。小明用刚学习的科学知识来了个“火眼识真金”:
(1)看颜色是不是金光闪闪;
(2)泡在食醋中,看是否有气泡产生;
(3)放在火上烧,看是否变色;
(4)将食盐水(NaCl)滴在项链上看是否表面变色。?
你们认为小明的方法中哪些是合理的呢?_______(2)(3)4.将铁片分别放入下列溶液中充分反应,反应后溶液质量比反应前减轻的是( )
A.AgNO3 B.H2SO4 C.HCl D.FeSO4A5.在金属活动顺序表中,K与Na相邻,其化学性质也相似。已知金属K投入盐的水溶液中,先发生如下反应:2K+2H2O==2KOH+H2↑.则金属Na投入CuSO4溶液中发生化学反应方程式为_________6.为探究金属Mg和Al的活动性,实验前先用砂纸打磨镁条和铝片,目的是____________________7.学完金属活动性知识后,试总结金属活动性强弱的方法有①________________②__________探究活动:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等. (1)该实验的目的是:
①___________________
_____________________
②___________________
_____________________两支长颈漏斗中产生的现象的不同之处_______
_________________________________________ 比较镁、铁与稀盐酸反应的剧烈程度 比较相同时间内镁、铁与稀盐酸反应放出热量的多少; 甲装置长颈漏斗中的液面比乙装置中的高 2.设计实验验证金属活动性顺序(1)两种金属的验证方法例:设计实验证明Fe、Cu两种金属的活动性顺序
_________________________________________(2)三种金属的验证方法②_______________________________________(两边盐溶液,中间金属)设计实验证明Zn、Fe、Ag三种金属的活动性顺序。方案1:Fe、Cu、稀盐酸 方案2:Fe、CuSO4溶液①__________________________________Zn、Fe、Ag、稀盐酸(注:要控制变量)(两边金属,中间盐溶液)用Zn、FeSO4溶液、Ag③_______________________________用ZnSO4溶液、Fe、AgNO3溶液1.只用下列选项所给出的试剂进行实验,能得到Zn、Cu、Ag三种金属正确的活动性顺序的是( )
A.Zn(NO3)2溶液、Cu(NO3)2溶液、Ag
B.Zn(NO3)2溶液、AgNO3溶液、Cu
C.稀H2SO4、Zn、Cu、Ag
D.Zn(NO3)2溶液、Cu、AgB2.为验证金属活动性Zn>Fe>Cu这一结论,下面实验设计合理的是( )
A.将Zn、Cu两金属片分别放入稀盐酸中 B.将Fe、Cu两金属片分别放入稀盐酸中 C.将Zn、Fe两金属片分别放入CuCl2溶液中 D.将Zn、Cu两金属片分别放入FeCl2溶液中D3.(2012年梅州中考)现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:I.将铁片浸入稀硫酸中,II.将银片浸入稀硫酸中,III.将铁片浸入硫酸铜溶液中.(1)实验I的现象是_________,有气泡产生,溶液由无色逐渐变为浅绿色.反应的化学方程式为________________________;
反应产生的气体可用__________的方法检验.
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的___
_________________(写出实验操作和现象).
(3)将银、铜、铁的两种金属分别放入______溶液中,即可验证这三种金属的活动性强弱. 练习:为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式__________________________________.
你认为小明的实验能否比较锌和铝的金属活动性强弱?______你的理由是____________________
__________________________________________不能 小明实验方案中没有控制盐酸的浓度、铝片和锌粒的表面积相关变量。(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是______________
__________________________________________ 未去膜的铝片表面有氧化铝,氧化铝先与盐酸反应。3、关于优先反应问题例1:锌、铁、铜组成的混合物投入到硝酸银溶液中,哪种金属先反应?例2:锌投入到硝酸银和硝酸铜混合溶液中,溶液中的铜和银,哪种金属先被置换出来?答:先是锌与硝酸银反应,再到铁与硝酸银反应,最后到铜与硝酸银反应。 答:银先被置换出来,银被置换完后再到铜被置换出来。1.在盛有AgNO3和Cu(NO3)2混合溶液的试管中,加入一定量的锌粉充分反应,试管底部有少量固体存在。过滤,向滤液中加稀盐酸,产生白色沉淀,滤渣是( )
A. Cu B. Ag C. Zn和Ag D. Zn和Cu2.向含AgNO3、Cu(NO3)2、Zn(NO3)2的混合液中,加入一些铁粉,待反应完成后过滤,下列情况是可能存在的是( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+
B.滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+
C.滤纸上有Ag、Fe,滤液中有Zn2+、Fe2+
D.滤纸上有Ag、Zn、Fe,滤液中有Zn2+、Fe2+BA3、在AgNO3和Cu(NO3)2的混合物中加入一定量的铁粉,充分反应后过滤: ①若在滤液中加入稀盐酸出现白色沉淀。则滤液中一定有___________________________。 滤纸上一定含有______________; ②若在滤液中加入稀HCl无任何现象。则滤纸上一定含有___________;可能含有_______________。 ③若在滤液中插入铁片,取出后无任何变化。则滤纸上一定有_________; 可能有__________。 ④若将滤纸上的固体放入稀HCl中,生成无色可燃性气体。则滤液中一定有____________。 滤纸的物质一定是______________;Fe(NO3)2、AgNO3、Cu(NO3)2AgAg、CuFeAg 和CuFeFe(NO3)2Ag、Cu和Fe4.除杂题1.填写下列表格(“混合物栏括号内为杂质”)除杂原则:不增(不增加新的杂质)、不减(被提纯的物质不减少)、易分(操作简单、容易分离)除杂方法:
一、物理方法:(1)过滤法。(2)吸附法。
二、化学方法:(1)转化法(把杂质转化成被提纯的物质)(2)除去法。(将杂质转为气体、沉淀或溶液而除去)(1)转化法(把杂质转化成被提纯的物质)灼热的CuO高温煅烧加入过量铁粉,过滤通入NaHCO3溶液(2)除去法(将杂质转为气体、沉淀或溶液而除去)灼热的铜网通入NaOH溶液后干燥稀盐酸例1:等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D.产生H2的速率N>MC5.图像题5.图像题5.金属与酸反应的图像题1.首先理解横、纵坐标的含义。2.其次把握曲线的四个点,即起点、转折点、交点、终点。解题思路:类型一:等量的金属与足量的酸反应。
产生氢气的质量关系_______________Al > Mg > Fe > Zn 类型二:足量的金属与等量的酸反应。
产生氢气的质量相等。练习1、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D.产生H2的速率N>MC练习2:在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡。分别向两边烧杯各加入5g镁和5g铁,镁和铁全部反应而消失后,天平的指针( )
A.偏向加铁的一边 B. 偏向加镁的一边
C.仍停留在原来的位置 D. 无法确定A练习3:在托盘天平两端的烧杯内,分别盛有等质量、等质量分数的足量的稀硫酸,调节天平至平衡。现向左边烧杯中加入6.5g的铁钉,同时向右边烧杯中加入6.5g锌粒。在实验过程中,观察到指针偏转的情况是( )
A.始终向左偏 B.不发生偏转
C.始终向右偏 D.最初向左偏转,然后向右偏转D评价总结 通过这节课的学习你有哪些收获呢?
你呢?祝大家开心快乐!!
同课章节目录
