中考化学专题复习
图片预览


文档简介
课件38张PPT。夯实基础 提升能力
中考化学专题复习
临安市实验初级中学 卢珺珺
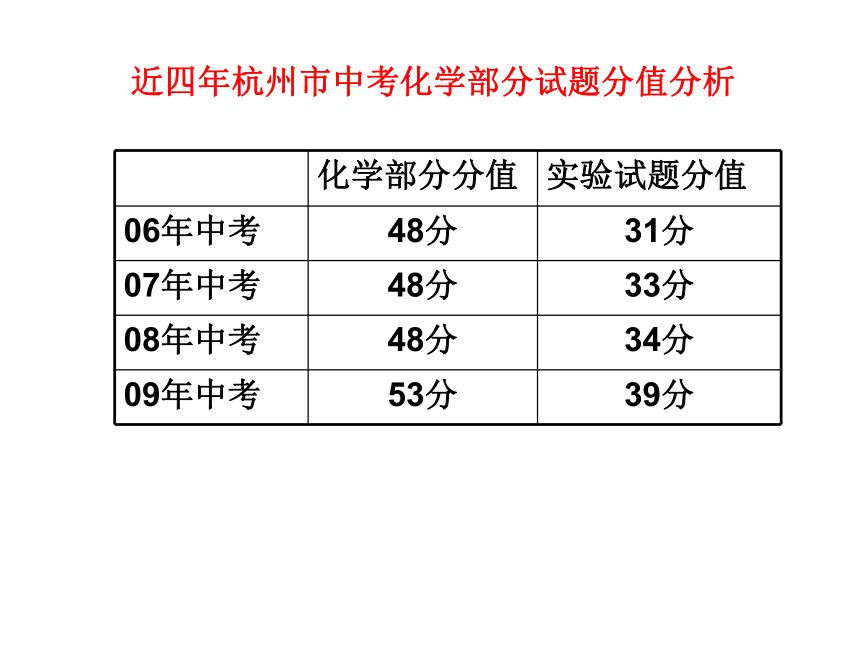
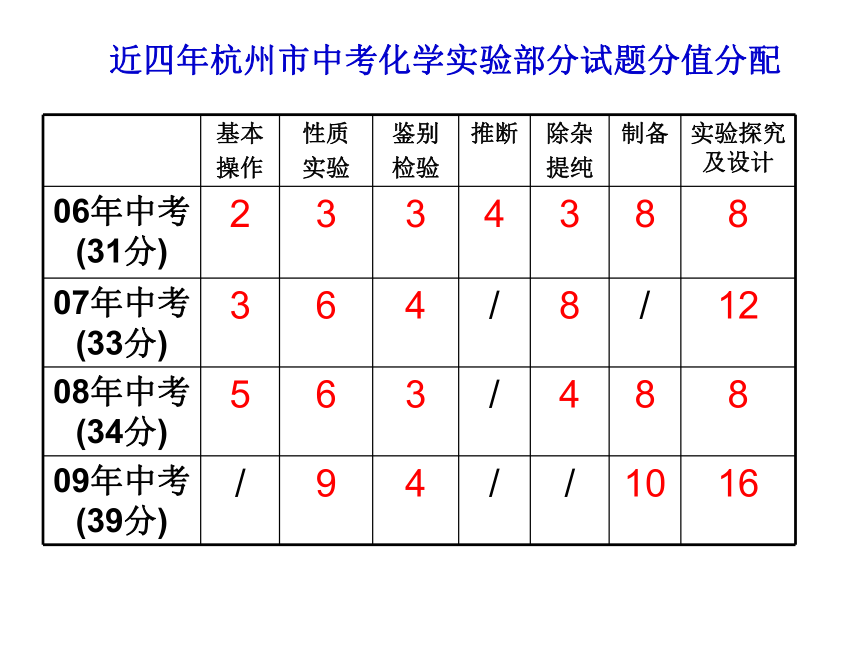
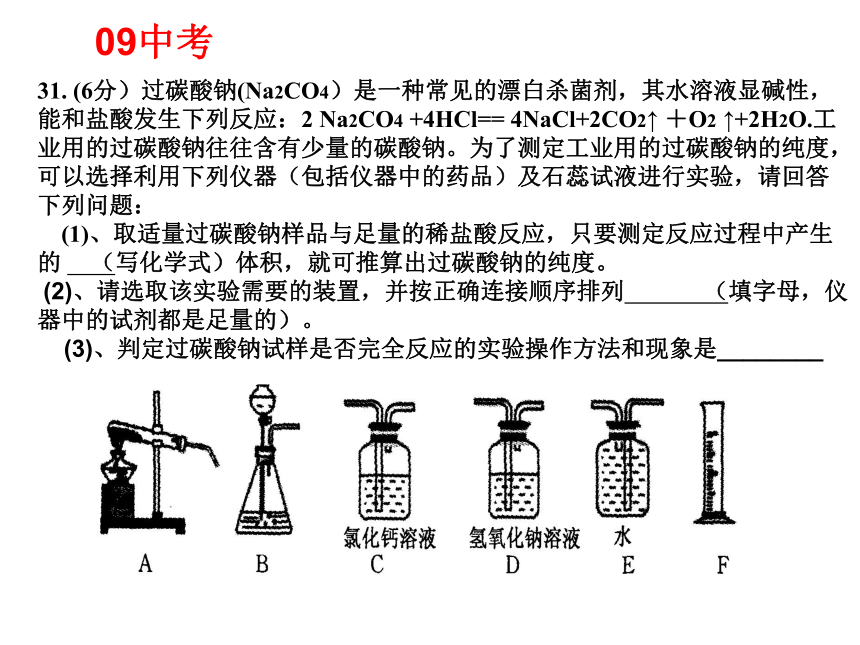
近四年杭州市中考化学部分试题分值分析近四年杭州市中考化学实验部分试题分值分配31. (6分)过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2 Na2CO4 +4HCl== 4NaCl+2CO2↑ +O2 ↑+2H2O.工业用的过碳酸钠往往含有少量的碳酸钠。为了测定工业用的过碳酸钠的纯度,可以选择利用下列仪器(包括仪器中的药品)及石蕊试液进行实验,请回答下列问题:
(1)、取适量过碳酸钠样品与足量的稀盐酸反应,只要测定反应过程中产生的 (写化学式)体积,就可推算出过碳酸钠的纯度。
(2)、请选取该实验需要的装置,并按正确连接顺序排列 (填字母,仪器中的试剂都是足量的)。
(3)、判定过碳酸钠试样是否完全反应的实验操作方法和现象是________
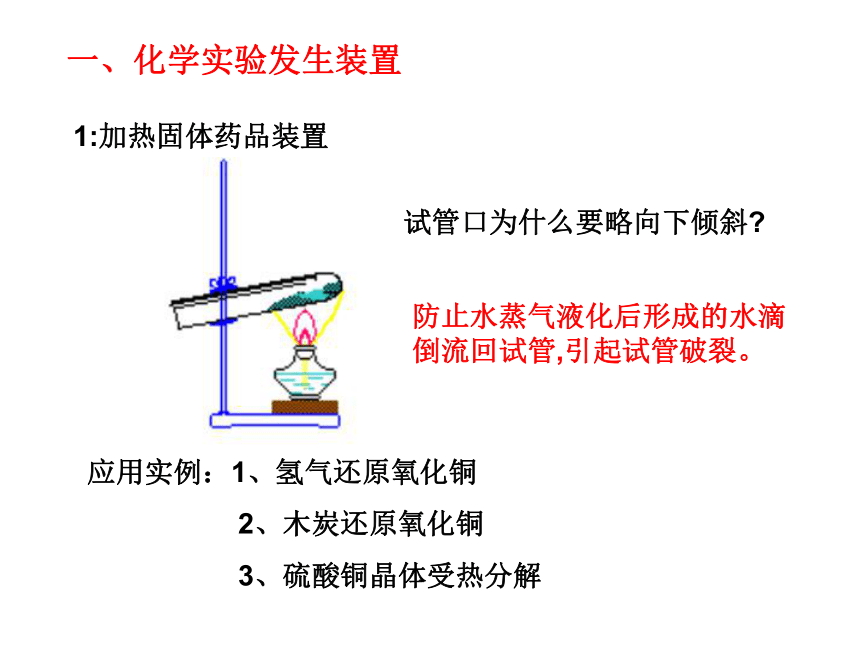
09中考实验装置的选取与连接科学中考化学部分专题复习1:加热固体药品装置试管口为什么要略向下倾斜?防止水蒸气液化后形成的水滴倒流回试管,引起试管破裂。应用实例:1、氢气还原氧化铜
2、木炭还原氧化铜
3、硫酸铜晶体受热分解一、化学实验发生装置2、常见的气体发生装置
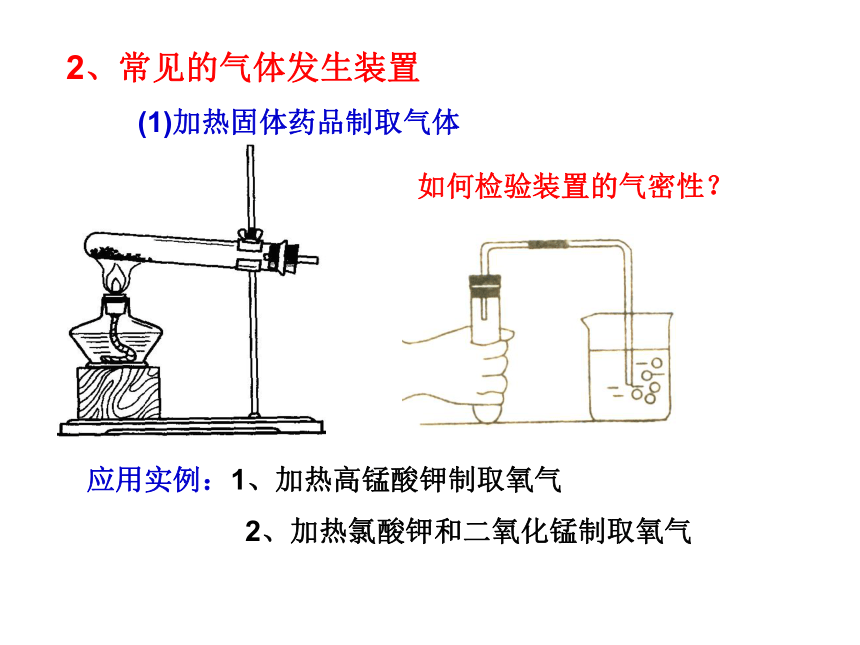
(1)加热固体药品制取气体如何检验装置的气密性?应用实例:1、加热高锰酸钾制取氧气
2、加热氯酸钾和二氧化锰制取氧气 2、常见的气体发生装置
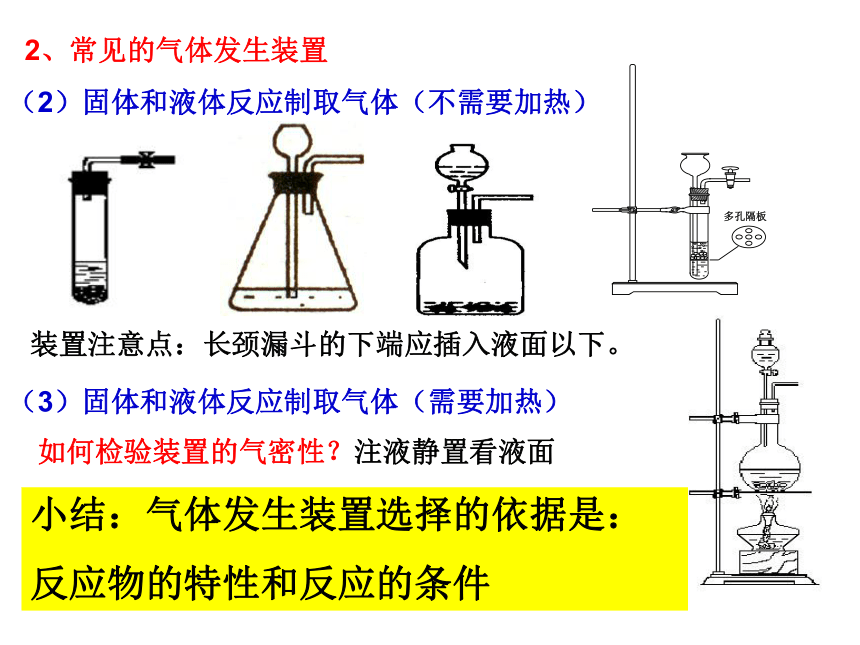
(2)固体和液体反应制取气体(不需要加热)装置注意点:长颈漏斗的下端应插入液面以下。如何检验装置的气密性?注液静置看液面小结:气体发生装置选择的依据是:
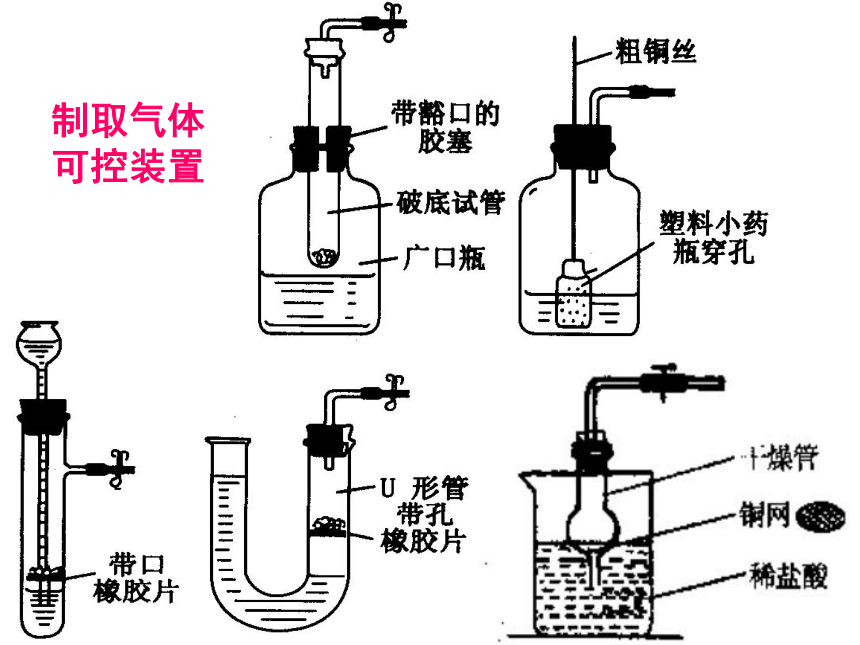
反应物的特性和反应的条件(3)固体和液体反应制取气体(需要加热)制取气体
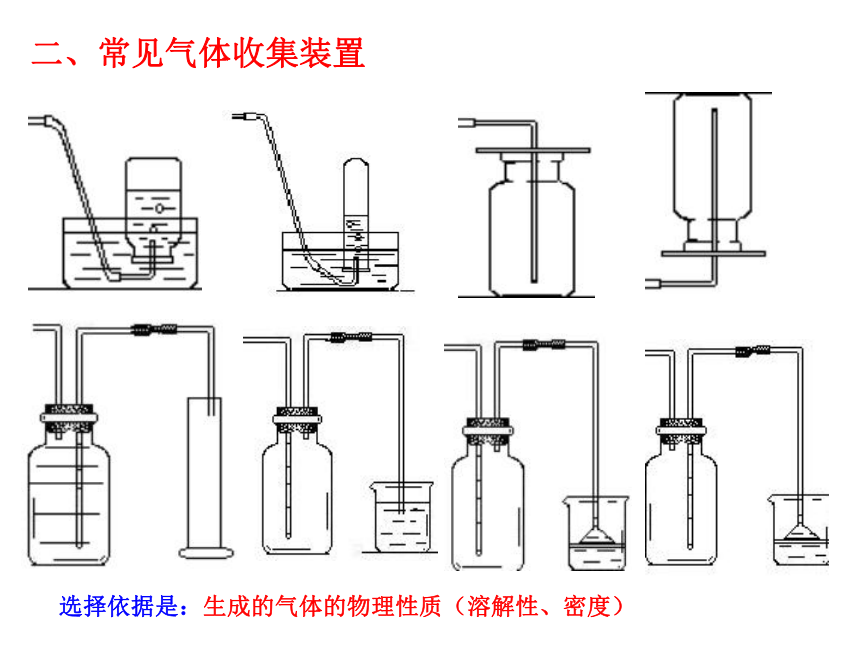
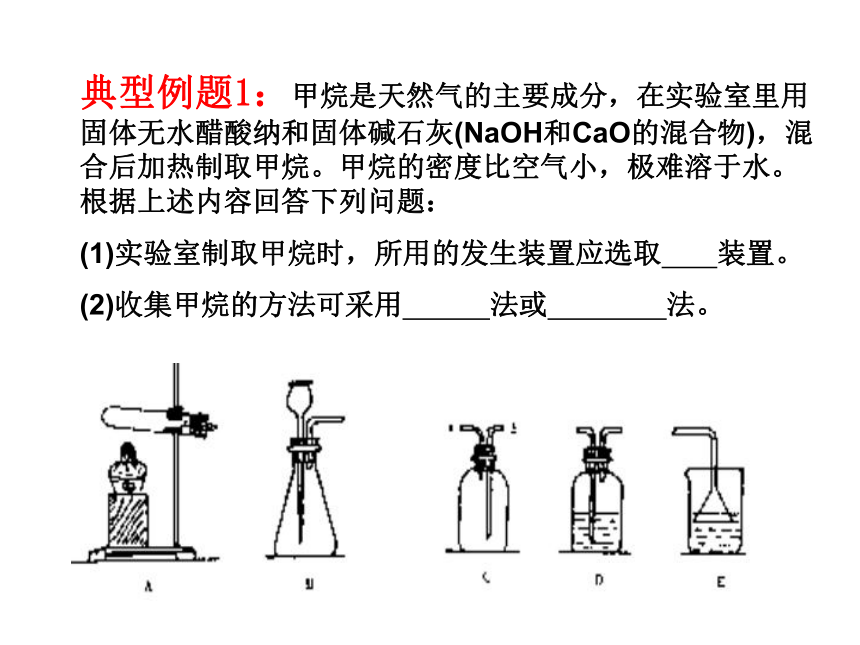
可控装置二、常见气体收集装置选择依据是:生成的气体的物理性质(溶解性、密度)典型例题1:甲烷是天然气的主要成分,在实验室里用固体无水醋酸纳和固体碱石灰(NaOH和CaO的混合物),混合后加热制取甲烷。甲烷的密度比空气小,极难溶于水。根据上述内容回答下列问题:
(1)实验室制取甲烷时,所用的发生装置应选取 装置。
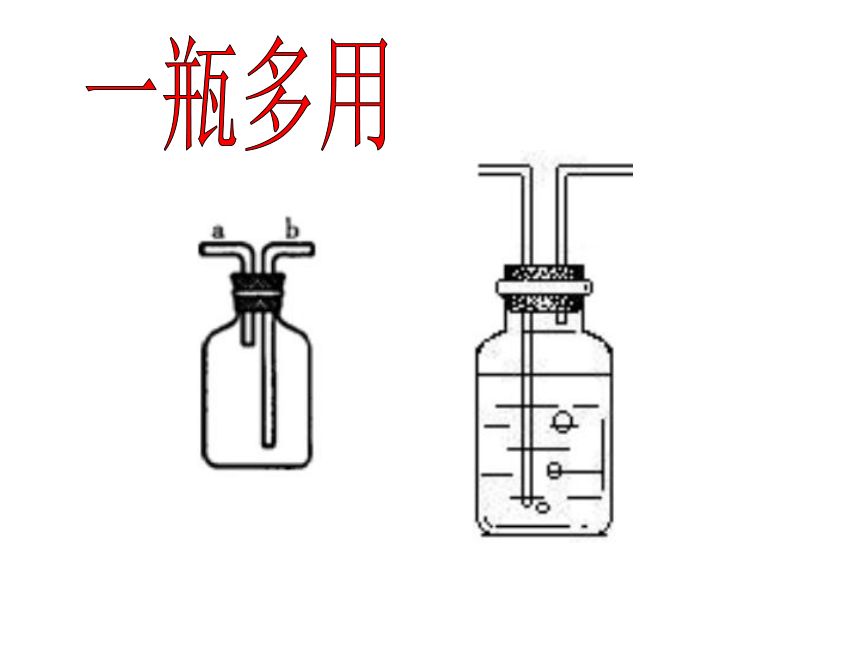
(2)收集甲烷的方法可采用 法或 法。一瓶多用作用1:收集气体空瓶:排空气法收集气体
密度小于空气的气体法收集时,气体应
从 通入
密度大于空气的体法收集时,气体应
从 通入装满水时:排水法收集气体
收集时,气体应从 通入a管b管a管作用2、洗气瓶(除去杂质气体)除去水蒸气氢氧化钠除去酸性气体
(如HCl、CO2
SO2等气体)稀盐酸除去碱性气体(如氨气等)洗气时,必须让气体从长管进入,从短管出去作用3、验气瓶检验二氧化碳气体作用4、量气瓶06中考31.(8分)在实验室中,利用下图装置可以制取并收集多种气体(必要时可以加热)。
⑴.李明同学想选择下列装置制取干燥、平稳、大小可控的氧气流,应优先选择的气体发生装置是___________ (填装置符号),其制取氧气的化学反应方程式为_________________,C瓶中盛放的试剂是_________________ 。
⑵.李明同学还想利用上述实验装置用H2还原氧化铜,但王强同学认为要将其中的一个装置改造后,才能进行H2还原氧化铜的实验。这个实验装置的改造方法是_________________。B 浓硫酸A装置去塞,并将导管伸入试管底部(D装置试管口略向下倾斜,去塞,将导管伸人试管底部)32.(8分)已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀。右图为Fe(OH)2制备实验的改进装置,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀。
(1)写出A试管中发生反应的化学方程式___________________ ;
(2)A试管中的反应开始时,打开止水夹,B试管中看到的现象是 ___________________ ;
(3)若要在该装置中得到Fe(OH)2白色絮状沉淀,并在一段时间内防止被氧化为Fe(OH)3红褐色沉淀,下一步的实验操作是_____________
(4)写出该装置中生成Fe(OH)2的化学方程式___________________ 。08中考Fe+H2S04=FeS04+H2↑ 导管口有气泡产生关紧止水夹 2Na0H+FeS04=Na2S04+Fe(OH)2↓三、气体干燥、除杂、检验装置典型例题2:证明某气体中同时含有 H2O 和H2 ? (下列装置可重复使用)方案评价: 检验H2O的存在除水检验H2的存在检验H2O是否除尽典型例题3:证明导出的气体中同时含有 CO和CO2?方案评价:检验CO2的存在除CO2检验CO的存在防止尾气污染空气检验CO2是否除尽检验方法H2OCO2H2CO吸收方法实验现象白色粉末变蓝澄清石灰水变浑浊黑色粉末变红白色粉末变蓝黑色粉末变红石灰水变混浊设计思路总结:常见气体的检验总结:气体的净化、转化与检验拓展提升1:设计一套装置检验煤气中可能含有 的存在CO、CO2、H2、H2O装置连接顺序为:检验原混合气体中的 H2O检验 H2O是否除尽检验 H2还原CuO生成的H2O检验原混合气体中的CO2检验CO2是否除尽检验CO还原CuO生成的CO2综合性气体制备实验的设计?净化
装置干燥
装置收集
装置尾气处理
装置发生
装置(1)固 ? 气体 (2)固+液——气体(2)“长进短出” : CO2——NaOH溶液;石灰水(可检验)
HCl ——NaOH溶液;Ca(OH)2溶液;AgNO3溶液 (可检验)
H2O—— 浓H2SO4;固体NaOH;生石灰;氯化钙等;
无水CuSO4只检验(1)排水法(O2、H2);(2)向上排空气法(O2、CO2); (3)向下排空气法(H2)(1)点燃法(如CO) (2)吸收法07中考31.(8分)某学生利用下图所示的装置,要测定含杂质(杂质不参加反应)的氧化铜的质量分数.取样品10克,得到如下两组数据:请回答下列同题:
(1)为保证实验安全,在点燃酒精灯前一步的实验步骤是____
(2)不应选择______组的实验数据来计算样品中的氧化铜的质量分数,原因是______
(3)若要使两组数据计算得到的结果一样.应将D装置连接在上图中的________位置(用装置编号表示),并请在D装置上画出用导管连接的方式,并标出D中的液体名称.
先往玻璃管中通氢气 无水硫酸铜还吸收氢气中含有的水蒸气 A、B之间 B四、尾气吸收装置五、防止液体倒吸发生装置 完成一个典型实验,实现掌握一类实验思想与规律。典型例题4:某Na2CO3样品中混有一些NaCl请测定其纯度:
(1)化学反应原理是 。
(2)装置(仪器)中盛放的试剂及作用是 。
(3)装置的连接顺序是 。
(4)需要测定的数据是 。
(5)操作步骤 。①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1);
③准确称量纯碱样品的质量(设为n)并放入广口瓶B内
④将B装置分别与试管A和C相连,打开弹簧夹缓缓鼓入空气几分钟后,关闭弹簧夹;再将干燥管与瓶C连接,然后将稀硫酸缓缓注入B瓶中,至不再产生气泡为止。
⑤再次打开弹簧夹往试管A缓缓鼓入空气数分钟然后称量干燥管Ⅰ的质量(设为m2)。⑴ 实验操作鼓入空气要缓缓鼓地进行,其理由是____,如果这两步操作太快,会导致测定结果_____。
⑵鼓入空气的目的是_____________;装置A中的试剂X应选用_______,其作用是___________ 。
⑶装置C的作用是_____;干燥管Ⅱ的作用是_____。
⑷装置A与B之间的弹簧夹在第___项操作前必须打开,在第_________项操作用其以前必须夹紧。
⑸根据此实验,写出计算纯碱样品纯度的公式:_____气密性的检查
中考化学专题复习
临安市实验初级中学 卢珺珺
近四年杭州市中考化学部分试题分值分析近四年杭州市中考化学实验部分试题分值分配31. (6分)过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2 Na2CO4 +4HCl== 4NaCl+2CO2↑ +O2 ↑+2H2O.工业用的过碳酸钠往往含有少量的碳酸钠。为了测定工业用的过碳酸钠的纯度,可以选择利用下列仪器(包括仪器中的药品)及石蕊试液进行实验,请回答下列问题:
(1)、取适量过碳酸钠样品与足量的稀盐酸反应,只要测定反应过程中产生的 (写化学式)体积,就可推算出过碳酸钠的纯度。
(2)、请选取该实验需要的装置,并按正确连接顺序排列 (填字母,仪器中的试剂都是足量的)。
(3)、判定过碳酸钠试样是否完全反应的实验操作方法和现象是________
09中考实验装置的选取与连接科学中考化学部分专题复习1:加热固体药品装置试管口为什么要略向下倾斜?防止水蒸气液化后形成的水滴倒流回试管,引起试管破裂。应用实例:1、氢气还原氧化铜
2、木炭还原氧化铜
3、硫酸铜晶体受热分解一、化学实验发生装置2、常见的气体发生装置
(1)加热固体药品制取气体如何检验装置的气密性?应用实例:1、加热高锰酸钾制取氧气
2、加热氯酸钾和二氧化锰制取氧气 2、常见的气体发生装置
(2)固体和液体反应制取气体(不需要加热)装置注意点:长颈漏斗的下端应插入液面以下。如何检验装置的气密性?注液静置看液面小结:气体发生装置选择的依据是:
反应物的特性和反应的条件(3)固体和液体反应制取气体(需要加热)制取气体
可控装置二、常见气体收集装置选择依据是:生成的气体的物理性质(溶解性、密度)典型例题1:甲烷是天然气的主要成分,在实验室里用固体无水醋酸纳和固体碱石灰(NaOH和CaO的混合物),混合后加热制取甲烷。甲烷的密度比空气小,极难溶于水。根据上述内容回答下列问题:
(1)实验室制取甲烷时,所用的发生装置应选取 装置。
(2)收集甲烷的方法可采用 法或 法。一瓶多用作用1:收集气体空瓶:排空气法收集气体
密度小于空气的气体法收集时,气体应
从 通入
密度大于空气的体法收集时,气体应
从 通入装满水时:排水法收集气体
收集时,气体应从 通入a管b管a管作用2、洗气瓶(除去杂质气体)除去水蒸气氢氧化钠除去酸性气体
(如HCl、CO2
SO2等气体)稀盐酸除去碱性气体(如氨气等)洗气时,必须让气体从长管进入,从短管出去作用3、验气瓶检验二氧化碳气体作用4、量气瓶06中考31.(8分)在实验室中,利用下图装置可以制取并收集多种气体(必要时可以加热)。
⑴.李明同学想选择下列装置制取干燥、平稳、大小可控的氧气流,应优先选择的气体发生装置是___________ (填装置符号),其制取氧气的化学反应方程式为_________________,C瓶中盛放的试剂是_________________ 。
⑵.李明同学还想利用上述实验装置用H2还原氧化铜,但王强同学认为要将其中的一个装置改造后,才能进行H2还原氧化铜的实验。这个实验装置的改造方法是_________________。B 浓硫酸A装置去塞,并将导管伸入试管底部(D装置试管口略向下倾斜,去塞,将导管伸人试管底部)32.(8分)已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀。右图为Fe(OH)2制备实验的改进装置,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀。
(1)写出A试管中发生反应的化学方程式___________________ ;
(2)A试管中的反应开始时,打开止水夹,B试管中看到的现象是 ___________________ ;
(3)若要在该装置中得到Fe(OH)2白色絮状沉淀,并在一段时间内防止被氧化为Fe(OH)3红褐色沉淀,下一步的实验操作是_____________
(4)写出该装置中生成Fe(OH)2的化学方程式___________________ 。08中考Fe+H2S04=FeS04+H2↑ 导管口有气泡产生关紧止水夹 2Na0H+FeS04=Na2S04+Fe(OH)2↓三、气体干燥、除杂、检验装置典型例题2:证明某气体中同时含有 H2O 和H2 ? (下列装置可重复使用)方案评价: 检验H2O的存在除水检验H2的存在检验H2O是否除尽典型例题3:证明导出的气体中同时含有 CO和CO2?方案评价:检验CO2的存在除CO2检验CO的存在防止尾气污染空气检验CO2是否除尽检验方法H2OCO2H2CO吸收方法实验现象白色粉末变蓝澄清石灰水变浑浊黑色粉末变红白色粉末变蓝黑色粉末变红石灰水变混浊设计思路总结:常见气体的检验总结:气体的净化、转化与检验拓展提升1:设计一套装置检验煤气中可能含有 的存在CO、CO2、H2、H2O装置连接顺序为:检验原混合气体中的 H2O检验 H2O是否除尽检验 H2还原CuO生成的H2O检验原混合气体中的CO2检验CO2是否除尽检验CO还原CuO生成的CO2综合性气体制备实验的设计?净化
装置干燥
装置收集
装置尾气处理
装置发生
装置(1)固 ? 气体 (2)固+液——气体(2)“长进短出” : CO2——NaOH溶液;石灰水(可检验)
HCl ——NaOH溶液;Ca(OH)2溶液;AgNO3溶液 (可检验)
H2O—— 浓H2SO4;固体NaOH;生石灰;氯化钙等;
无水CuSO4只检验(1)排水法(O2、H2);(2)向上排空气法(O2、CO2); (3)向下排空气法(H2)(1)点燃法(如CO) (2)吸收法07中考31.(8分)某学生利用下图所示的装置,要测定含杂质(杂质不参加反应)的氧化铜的质量分数.取样品10克,得到如下两组数据:请回答下列同题:
(1)为保证实验安全,在点燃酒精灯前一步的实验步骤是____
(2)不应选择______组的实验数据来计算样品中的氧化铜的质量分数,原因是______
(3)若要使两组数据计算得到的结果一样.应将D装置连接在上图中的________位置(用装置编号表示),并请在D装置上画出用导管连接的方式,并标出D中的液体名称.
先往玻璃管中通氢气 无水硫酸铜还吸收氢气中含有的水蒸气 A、B之间 B四、尾气吸收装置五、防止液体倒吸发生装置 完成一个典型实验,实现掌握一类实验思想与规律。典型例题4:某Na2CO3样品中混有一些NaCl请测定其纯度:
(1)化学反应原理是 。
(2)装置(仪器)中盛放的试剂及作用是 。
(3)装置的连接顺序是 。
(4)需要测定的数据是 。
(5)操作步骤 。①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1);
③准确称量纯碱样品的质量(设为n)并放入广口瓶B内
④将B装置分别与试管A和C相连,打开弹簧夹缓缓鼓入空气几分钟后,关闭弹簧夹;再将干燥管与瓶C连接,然后将稀硫酸缓缓注入B瓶中,至不再产生气泡为止。
⑤再次打开弹簧夹往试管A缓缓鼓入空气数分钟然后称量干燥管Ⅰ的质量(设为m2)。⑴ 实验操作鼓入空气要缓缓鼓地进行,其理由是____,如果这两步操作太快,会导致测定结果_____。
⑵鼓入空气的目的是_____________;装置A中的试剂X应选用_______,其作用是___________ 。
⑶装置C的作用是_____;干燥管Ⅱ的作用是_____。
⑷装置A与B之间的弹簧夹在第___项操作前必须打开,在第_________项操作用其以前必须夹紧。
⑸根据此实验,写出计算纯碱样品纯度的公式:_____气密性的检查
同课章节目录
