第二节 探索酸的性质 复习与练习课
图片预览





文档简介
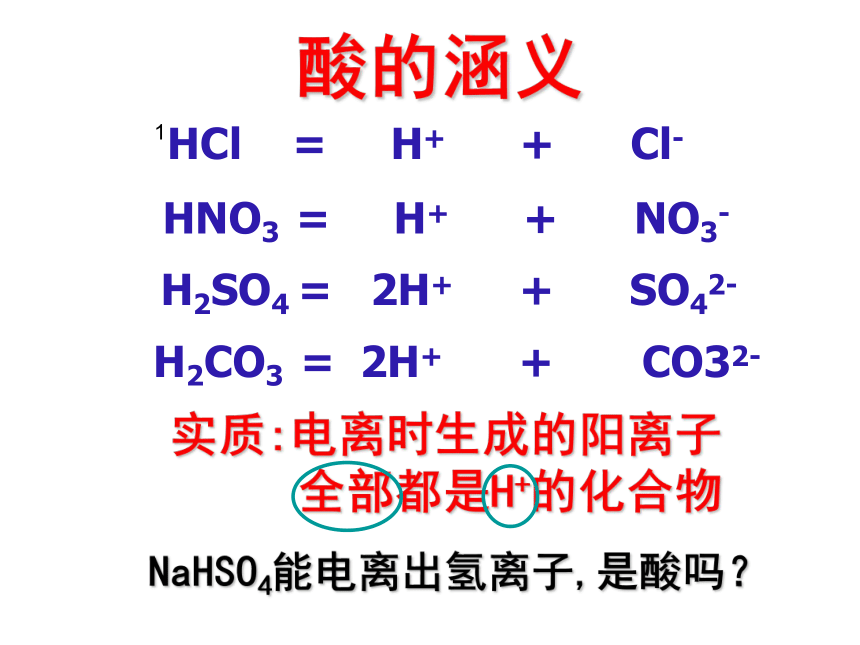
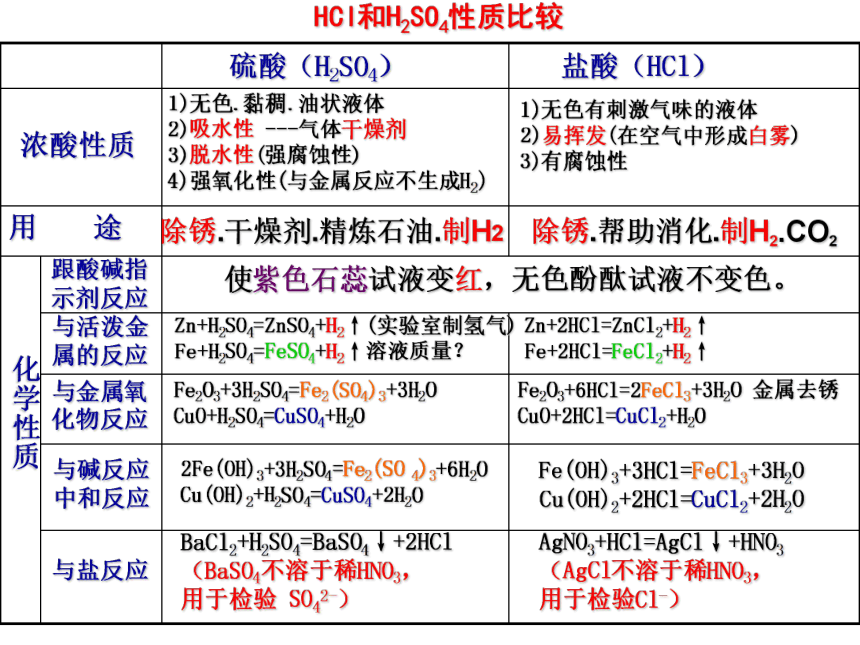
课件20张PPT。探索酸的性质酸的共性和个性 HCl = H+ + Cl- HNO3 = H+ + NO3- H2SO4 = 2H+ + SO42- H2CO3 =实质:电离时生成的阳离子全部都是H+的化合物 酸的涵义NaHSO4能电离出氢离子,是酸吗?12H+ + CO32-HCl和H2SO4性质比较 化学性质浓酸性质 硫酸(H2SO4)盐酸(HCl) 1)无色.黏稠.油状液体
2)吸水性 ---气体干燥剂
3)脱水性(强腐蚀性)
4)强氧化性(与金属反应不生成H2)1)无色有刺激气味的液体
2)易挥发(在空气中形成白雾)
3)有腐蚀性 使紫色石蕊试液变红,无色酚酞试液不变色。跟酸碱指示剂反应与活泼金属的反应与金属氧化物反应与碱反应
中和反应与盐反应Zn+H2SO4=ZnSO4+H2↑(实验室制氢气)
Fe+H2SO4=FeSO4+H2↑溶液质量?Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O BaCl2+H2SO4=BaSO4↓+2HCl
(BaSO4不溶于稀HNO3,
用于检验 SO42-)2Fe(OH)3+3H2SO4=Fe2(SO 4)3+6H2O
Cu(OH)2+H2SO4=CuSO4+2H2OZn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑Fe2O3+6HCl=2FeCl3+3H2O 金属去锈
CuO+2HCl=CuCl2+H2OFe(OH)3+3HCl=FeCl3+3H2O
Cu(OH)2+2HCl=CuCl2+2H2O AgNO3+HCl=AgCl↓+HNO3
(AgCl不溶于稀HNO3,
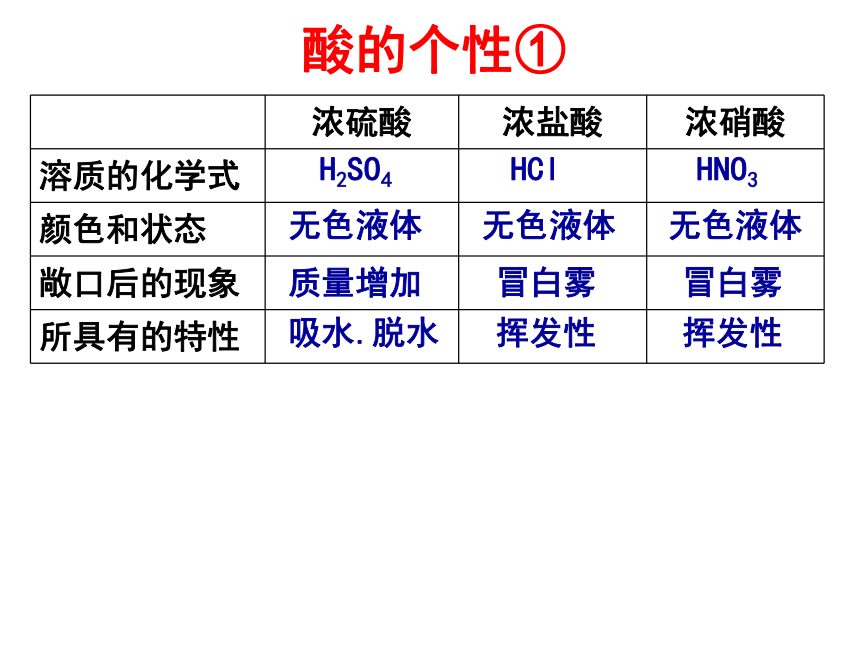
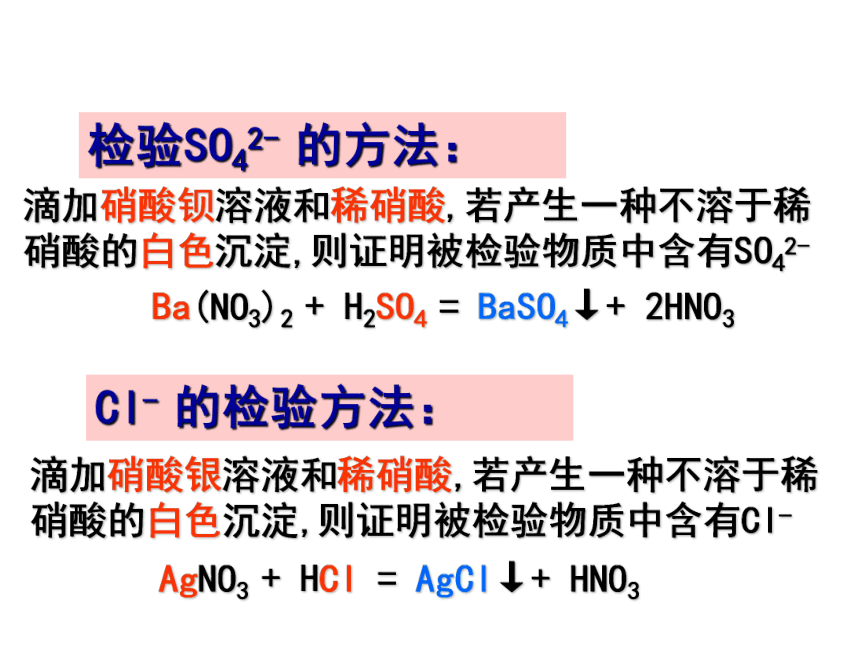
用于检验Cl-)除锈.干燥剂.精炼石油.制H2除锈.帮助消化.制H2.CO2酸指示剂活泼金属金属氧化物碱盐酸的通性原因是酸溶液都能电离出共同的阳离子——H+ 化学性质跟指示剂的反应
跟金属的反应
跟金属氧化物反应
跟碱的反应
跟盐的反应Cu(OH)2+2HNO3= Cu(NO3)2+2H2OZnO+2HNO3=Zn(NO3)2+H2O由于氧化性特强,不生成氢气使石蕊变红色,使酚酞不变色物理性质挥发性硝酸的性质(瓶口呈现白雾)BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑酸的个性① H2SO4HClHNO3无色液体质量增加冒白雾冒白雾无色液体无色液体吸水.脱水挥发性挥发性滴加硝酸银溶液和稀硝酸,若产生一种不溶于稀硝酸的白色沉淀,则证明被检验物质中含有Cl-Cl- 的检验方法:滴加硝酸钡溶液和稀硝酸,若产生一种不溶于稀硝酸的白色沉淀,则证明被检验物质中含有SO42- 检验SO42- 的方法:Ba(NO3)2 + H2SO4 = BaSO4↓+ 2HNO3AgNO3 + HCl = AgCl↓+ HNO3 13.下列各组离子属于酸电离产生的是( )
A、H+、NO3-、SO42- B、OH-、Ba2+、K+
C、H+、Na+、SO42- D、Na+ 、Ba2+、 Cl-A14.鉴别硫酸和盐酸应用的试剂是( )
A.硝酸银溶液 B.氯化钡溶液 C.酚酞 D.石蕊解鉴别题关键:操作要简单,现象要明显因为AgNO3与HCl反应产生AgCl白色沉淀,而AgNO3与H2SO4反应生成的Ag2SO4微溶,也会出现白色沉淀B★溶液有可能同时存在Cl-和SO42-时,先检验哪种离子? 应该先检验SO42-,而且用Ba(NO3)2溶液和稀硝酸作试剂;且需将BaSO4沉淀滤去,再往滤液中加AgNO3溶液和稀硝酸检验Cl-; 若先检验Cl-,加入AgNO3溶液时,会生成Ag2SO4(微溶)沉淀,而干扰Cl-的检验。? 酸都具有一些相同的性质,是因为酸都可电离出 ,但不同的酸由于 不同,故又有不同的化学性质。氢离子酸根阴离子1、怎样除去盐酸中混有的少量硫酸?答:向混合溶液中逐滴加入氯化钡溶液,并充分振荡到不再有沉淀为止,滤去不溶物硫酸钡H2SO4 + BaCl2 = BaSO4↓+ 2HCl除去杂质的思路:不增不减易分关键:
沾亲带故
变废为宝(不增加新杂质)(不与提纯物反应)(生成气体.沉淀或水)除杂练习:①HNO3(HCl)②Na2SO4(Na2CO3)③Cu(CuO)
?
水立刻沸腾,液滴飞溅甲处液面下降,乙处液面上升②浓硫酸溶于水放出大量热①浓硫酸的密度大于水的密度这个事实告诉我们:在稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水中,并不断搅拌。22.按图所示的装置打开分液漏斗的活塞,让水滴入盛有浓硫酸的锥形瓶中,可以看到锥形瓶中出现 的现象,同时U型管两液面高度变化是 ,
原因是: 2.食醋是醋酸的稀溶液;某同学在家中做验证食醋具有酸的某一条通性的实验他选择下列物质,其中不能达到目的的是( )
A.木炭 B.大理石 C.铁钉 D.铁锈A3.铜粉中混有少量的铁粉,为除去盐酸,可加入适量的( ) A.水 B.稀盐酸 C.氢氧化钾 D.加热B4.酸都具有相似的化学性质是因为( )
A.酸的pH都小于7 B.酸溶液中都有酸根离子 C.酸溶液中阳离子都是氢离子D.酸溶液中都含有氢气C5.下列物质在空气中放置一段时间后质量会增加的是( ) A.浓盐酸 B.浓硝酸 C.浓硫酸 D. 碳 7.下列化学方程式中正确的是( )
A. Zn + 2HNO3 = Zn(NO3)2 + H2↑
B. 2Fe + 6HCl = 2FeCl3 + 3H2↑ C. Fe2O3 + 2H2SO4 = 2FeSO4 + 2H2O D. Cu?(OH?)2 + 2HNO3 = Cu(NO3)2+2H2O
E. CaCO3 + 2HCl == CaCl2 + H2CO3
F. Al + H2SO4 == AlSO4 + H2↑
G. Cu + 2HCl == CuCl2 + H2OA6.等质量等质量分数的盐酸和氢氧化钠溶液混合,充分反应后滴入石蕊试液,溶液呈( )
A.红色 B.蓝色 C.紫色 D.无色CD浓硫酸硝酸银溶液密度比空气小的气体,如氢气8.如图所示,该装置有洗气.检验及储气等多种用途: (1)若用此装置来除去氢气中混有的少量水蒸气时,在锥形瓶内应该盛放的试剂是? ??. (2)若要验证氢气中是否混有氯化氢气体,锥形瓶内应该盛放的试剂是????? ????. (3)若证明并除去某气体中含有的CO2,在锥形瓶中应盛放的试剂是 .
(4)若用来收集气体,当气体从b端通入时,能收集到的气体可以是 .
(5)若用排水法收集气体,气体应从 .
端通入.a bb澄清石灰水9.在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是( )
A.ZnO B.Fe C.Cu(OH)2 D.Fe2O3A倒入稀硫酸MgZnFeCuAg实验结论:1.不是所有的金属都能与酸反应,如Cu.Ag2.能反应的金属反应速度也不同,如Mg>Al>Zn>Fe反应快慢程度Mg > Zn > Fe判断依据:斜线越陡,说明单位时间内产生氢气多,反应快MgZnFe甲乙丙反应快慢比较:练习:等质量的A,B,C三种金属分别与质量相同,
质量分数也相同的稀硫酸充分反应放出氢气的情况如下图所示:AC)反应时间判断:1 活动性最强的金属是2 活动性最弱的金属是(()产生H2
质量3.等质量的下列金属,分别与稀硫酸反应,生成氢气最快的是( );生成氢气最多的是( )
A.Mg B.Al C.Zn D.FeAB将一定质量分数的硫酸溶液加水稀释,下图正确表示PH变化的是( )
A16g铁和铜的混合物与50g稀硫酸恰好完全反应,生
成0.5g氢气,计算:
(1)混合物中铁的质量是多少?
(2)所用稀硫酸中硫酸的质量分数是多少?
(3)生成物的溶液中,溶质的质量分数是多少?14克49%60%
2)吸水性 ---气体干燥剂
3)脱水性(强腐蚀性)
4)强氧化性(与金属反应不生成H2)1)无色有刺激气味的液体
2)易挥发(在空气中形成白雾)
3)有腐蚀性 使紫色石蕊试液变红,无色酚酞试液不变色。跟酸碱指示剂反应与活泼金属的反应与金属氧化物反应与碱反应
中和反应与盐反应Zn+H2SO4=ZnSO4+H2↑(实验室制氢气)
Fe+H2SO4=FeSO4+H2↑溶液质量?Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O BaCl2+H2SO4=BaSO4↓+2HCl
(BaSO4不溶于稀HNO3,
用于检验 SO42-)2Fe(OH)3+3H2SO4=Fe2(SO 4)3+6H2O
Cu(OH)2+H2SO4=CuSO4+2H2OZn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑Fe2O3+6HCl=2FeCl3+3H2O 金属去锈
CuO+2HCl=CuCl2+H2OFe(OH)3+3HCl=FeCl3+3H2O
Cu(OH)2+2HCl=CuCl2+2H2O AgNO3+HCl=AgCl↓+HNO3
(AgCl不溶于稀HNO3,
用于检验Cl-)除锈.干燥剂.精炼石油.制H2除锈.帮助消化.制H2.CO2酸指示剂活泼金属金属氧化物碱盐酸的通性原因是酸溶液都能电离出共同的阳离子——H+ 化学性质跟指示剂的反应
跟金属的反应
跟金属氧化物反应
跟碱的反应
跟盐的反应Cu(OH)2+2HNO3= Cu(NO3)2+2H2OZnO+2HNO3=Zn(NO3)2+H2O由于氧化性特强,不生成氢气使石蕊变红色,使酚酞不变色物理性质挥发性硝酸的性质(瓶口呈现白雾)BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑酸的个性① H2SO4HClHNO3无色液体质量增加冒白雾冒白雾无色液体无色液体吸水.脱水挥发性挥发性滴加硝酸银溶液和稀硝酸,若产生一种不溶于稀硝酸的白色沉淀,则证明被检验物质中含有Cl-Cl- 的检验方法:滴加硝酸钡溶液和稀硝酸,若产生一种不溶于稀硝酸的白色沉淀,则证明被检验物质中含有SO42- 检验SO42- 的方法:Ba(NO3)2 + H2SO4 = BaSO4↓+ 2HNO3AgNO3 + HCl = AgCl↓+ HNO3 13.下列各组离子属于酸电离产生的是( )
A、H+、NO3-、SO42- B、OH-、Ba2+、K+
C、H+、Na+、SO42- D、Na+ 、Ba2+、 Cl-A14.鉴别硫酸和盐酸应用的试剂是( )
A.硝酸银溶液 B.氯化钡溶液 C.酚酞 D.石蕊解鉴别题关键:操作要简单,现象要明显因为AgNO3与HCl反应产生AgCl白色沉淀,而AgNO3与H2SO4反应生成的Ag2SO4微溶,也会出现白色沉淀B★溶液有可能同时存在Cl-和SO42-时,先检验哪种离子? 应该先检验SO42-,而且用Ba(NO3)2溶液和稀硝酸作试剂;且需将BaSO4沉淀滤去,再往滤液中加AgNO3溶液和稀硝酸检验Cl-; 若先检验Cl-,加入AgNO3溶液时,会生成Ag2SO4(微溶)沉淀,而干扰Cl-的检验。? 酸都具有一些相同的性质,是因为酸都可电离出 ,但不同的酸由于 不同,故又有不同的化学性质。氢离子酸根阴离子1、怎样除去盐酸中混有的少量硫酸?答:向混合溶液中逐滴加入氯化钡溶液,并充分振荡到不再有沉淀为止,滤去不溶物硫酸钡H2SO4 + BaCl2 = BaSO4↓+ 2HCl除去杂质的思路:不增不减易分关键:
沾亲带故
变废为宝(不增加新杂质)(不与提纯物反应)(生成气体.沉淀或水)除杂练习:①HNO3(HCl)②Na2SO4(Na2CO3)③Cu(CuO)
?
水立刻沸腾,液滴飞溅甲处液面下降,乙处液面上升②浓硫酸溶于水放出大量热①浓硫酸的密度大于水的密度这个事实告诉我们:在稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水中,并不断搅拌。22.按图所示的装置打开分液漏斗的活塞,让水滴入盛有浓硫酸的锥形瓶中,可以看到锥形瓶中出现 的现象,同时U型管两液面高度变化是 ,
原因是: 2.食醋是醋酸的稀溶液;某同学在家中做验证食醋具有酸的某一条通性的实验他选择下列物质,其中不能达到目的的是( )
A.木炭 B.大理石 C.铁钉 D.铁锈A3.铜粉中混有少量的铁粉,为除去盐酸,可加入适量的( ) A.水 B.稀盐酸 C.氢氧化钾 D.加热B4.酸都具有相似的化学性质是因为( )
A.酸的pH都小于7 B.酸溶液中都有酸根离子 C.酸溶液中阳离子都是氢离子D.酸溶液中都含有氢气C5.下列物质在空气中放置一段时间后质量会增加的是( ) A.浓盐酸 B.浓硝酸 C.浓硫酸 D. 碳 7.下列化学方程式中正确的是( )
A. Zn + 2HNO3 = Zn(NO3)2 + H2↑
B. 2Fe + 6HCl = 2FeCl3 + 3H2↑ C. Fe2O3 + 2H2SO4 = 2FeSO4 + 2H2O D. Cu?(OH?)2 + 2HNO3 = Cu(NO3)2+2H2O
E. CaCO3 + 2HCl == CaCl2 + H2CO3
F. Al + H2SO4 == AlSO4 + H2↑
G. Cu + 2HCl == CuCl2 + H2OA6.等质量等质量分数的盐酸和氢氧化钠溶液混合,充分反应后滴入石蕊试液,溶液呈( )
A.红色 B.蓝色 C.紫色 D.无色CD浓硫酸硝酸银溶液密度比空气小的气体,如氢气8.如图所示,该装置有洗气.检验及储气等多种用途: (1)若用此装置来除去氢气中混有的少量水蒸气时,在锥形瓶内应该盛放的试剂是? ??. (2)若要验证氢气中是否混有氯化氢气体,锥形瓶内应该盛放的试剂是????? ????. (3)若证明并除去某气体中含有的CO2,在锥形瓶中应盛放的试剂是 .
(4)若用来收集气体,当气体从b端通入时,能收集到的气体可以是 .
(5)若用排水法收集气体,气体应从 .
端通入.a bb澄清石灰水9.在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是( )
A.ZnO B.Fe C.Cu(OH)2 D.Fe2O3A倒入稀硫酸MgZnFeCuAg实验结论:1.不是所有的金属都能与酸反应,如Cu.Ag2.能反应的金属反应速度也不同,如Mg>Al>Zn>Fe反应快慢程度Mg > Zn > Fe判断依据:斜线越陡,说明单位时间内产生氢气多,反应快MgZnFe甲乙丙反应快慢比较:练习:等质量的A,B,C三种金属分别与质量相同,
质量分数也相同的稀硫酸充分反应放出氢气的情况如下图所示:AC)反应时间判断:1 活动性最强的金属是2 活动性最弱的金属是(()产生H2
质量3.等质量的下列金属,分别与稀硫酸反应,生成氢气最快的是( );生成氢气最多的是( )
A.Mg B.Al C.Zn D.FeAB将一定质量分数的硫酸溶液加水稀释,下图正确表示PH变化的是( )
A16g铁和铜的混合物与50g稀硫酸恰好完全反应,生
成0.5g氢气,计算:
(1)混合物中铁的质量是多少?
(2)所用稀硫酸中硫酸的质量分数是多少?
(3)生成物的溶液中,溶质的质量分数是多少?14克49%60%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
