第二节 物质的转化规律(第2课时)
图片预览




文档简介
课件17张PPT。金属的冶炼:
定义:
把金属从化合态变成游离态叫金属的冶炼。氢气还原氧化铜实验注意事项:
①H2在通入之前要先检验纯度。
②实验开始时需要先通入一会氢气,再加热氧化铜,目的是赶走试管中残留的空气,防止氢气与空气混合热导致试管爆裂;
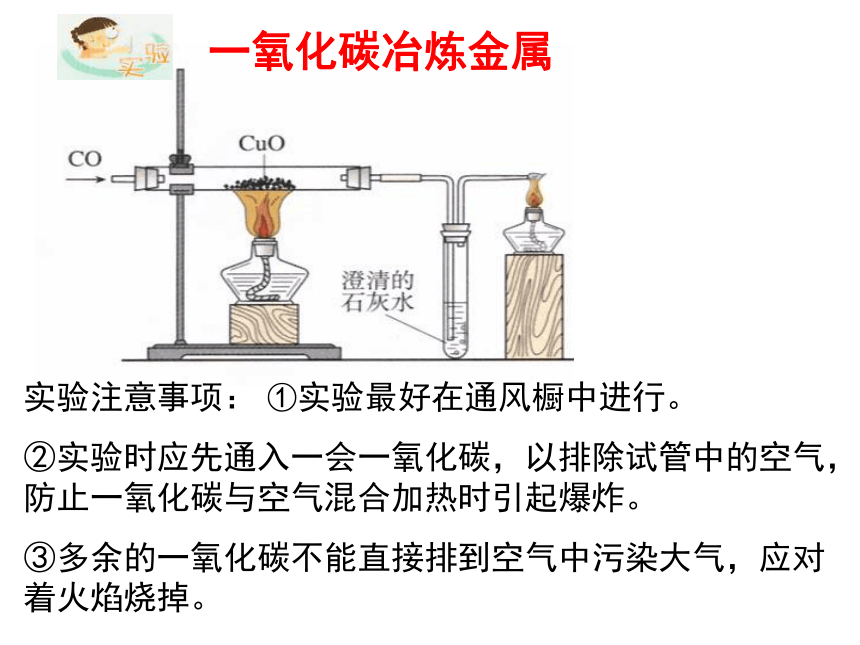
③实验停止后,要继续通入一会氢气,直到试管冷却为止,防止灼热的铜被空气中的氧气再次氧化成氧化铜。一氧化碳冶炼金属实验注意事项: ①实验最好在通风橱中进行。
②实验时应先通入一会一氧化碳,以排除试管中的空气,防止一氧化碳与空气混合加热时引起爆炸。
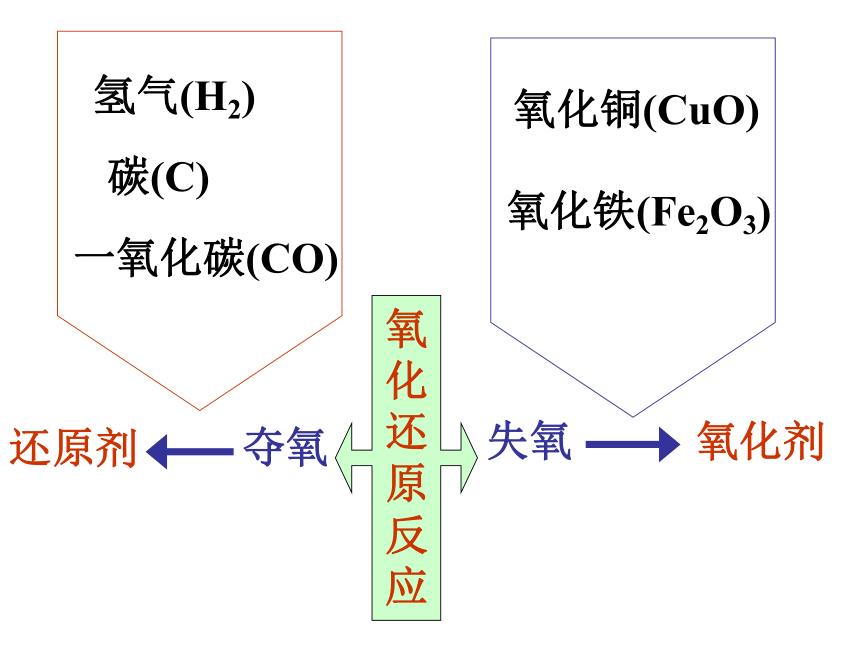
③多余的一氧化碳不能直接排到空气中污染大气,应对着火焰烧掉。氢气(H2)碳(C)一氧化碳(CO)夺氧还原剂氧化铜(CuO)氧化铁(Fe2O3)失氧氧化剂氧
化
还
原
反
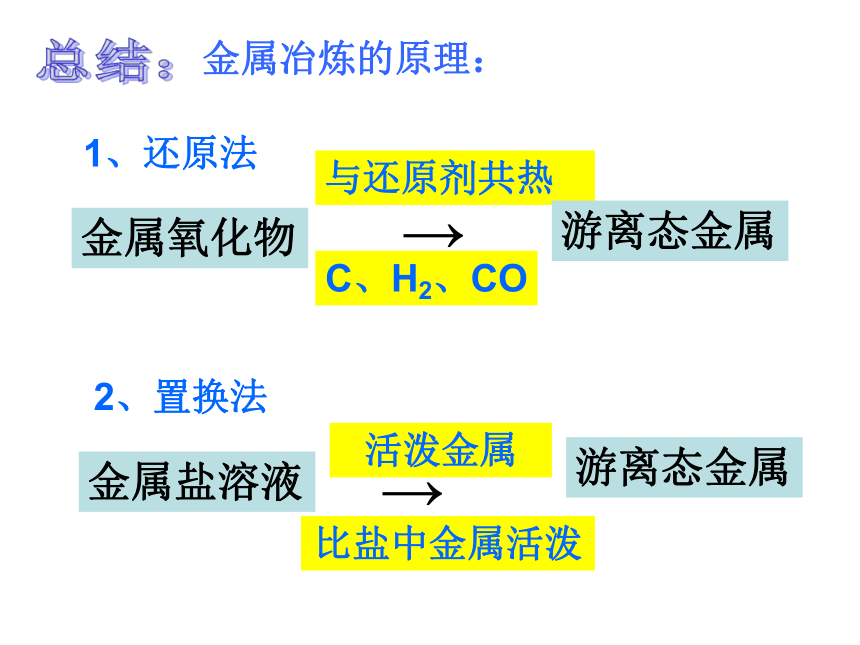
应金属冶炼的原理:与还原剂共热C、H2、CO1、还原法2、置换法活泼金属比盐中金属活泼总结:例题: 100吨含Fe2O3的质量分数为85%的铁矿石中,可炼出含铁的质量分数为96%的生铁多少吨?用2000吨含Fe2O375%的铁矿石,最多可以冶炼出多少吨铁?CaCO3+H2O+CO2=Ca(HCO3)2易溶于水钟乳石、石笋和石柱的形成实验:产生气泡,一会下沉,一会又浮上来,不断地上下沉浮。 蛋壳变白,变薄。蛋壳没了,剩下鸡蛋膜.。练习:1、Ca → CaO → Ca(OH)2 →CaCO3 2、C → CO2 → H2CO3 → Na2CO3 3、Na+Cl2 == 4、CaO+SiO2 == 5、HCl+NaOH= 6、NaCl+AgNO3 = 11、Zn+H2SO4 = 7、Ca(OH)2+CO2 = 8、H2SO4+CuO = 9、HCl+AgNO3 = 10、Ca(OH)2+Na2CO3 = 12、Fe+CuSO4 = 高温点燃读图: 分析 两条纵线、四条横线、四条斜线和两条折线。一、两条纵线:
1、金属 → 金属氧化物 → 碱 → 盐
⑴ 金属 + 氧气 → 金属氧化物
⑵ 金属氧化物 + 水 → 碱(可溶性碱)
⑶ 碱 + 盐 → 新碱 + 新盐 2、非金属 → 非金属氧化物 → 酸 → 盐
⑴ 非金属 + 氧气 → 非金属氧化物
⑵ 非金属氧化物 + 水 → 酸
⑶ 酸 + 盐 → 新酸 + 新盐 常见无机物间相互关系二、四条横线:
1、金属 + 非金属 → 盐
2、金属氧化物 + 非金属氧化物 → 盐
3、碱 + 酸 → 盐 + 水
4、盐 + 盐 → 新盐 + 新盐三、四条斜线:
1、金属氧化物+酸→盐+水
2、非金属氧化物+碱→盐+水
3、碱+盐→新碱+新盐
4、酸+盐→新酸+新盐四、两条折线:
1、金属 + 酸 → 盐 + 氢气
2、金属 + 盐 → 金属 + 盐读图: 根据此图来说说酸具有哪些性质? 试分析制取盐的可能途径有几条?讨论:试设计ZnSO4四种方法。1.Zn + H2SO4 = ZnSO4 + H2↑
2.Zn + CuSO4 = ZnSO4 + Cu
3.ZnO + H2SO4 = ZnSO4 + H2O
4.Zn(OH)2 + H2SO4 = ZnSO4 + 2 H2O
定义:
把金属从化合态变成游离态叫金属的冶炼。氢气还原氧化铜实验注意事项:
①H2在通入之前要先检验纯度。
②实验开始时需要先通入一会氢气,再加热氧化铜,目的是赶走试管中残留的空气,防止氢气与空气混合热导致试管爆裂;
③实验停止后,要继续通入一会氢气,直到试管冷却为止,防止灼热的铜被空气中的氧气再次氧化成氧化铜。一氧化碳冶炼金属实验注意事项: ①实验最好在通风橱中进行。
②实验时应先通入一会一氧化碳,以排除试管中的空气,防止一氧化碳与空气混合加热时引起爆炸。
③多余的一氧化碳不能直接排到空气中污染大气,应对着火焰烧掉。氢气(H2)碳(C)一氧化碳(CO)夺氧还原剂氧化铜(CuO)氧化铁(Fe2O3)失氧氧化剂氧
化
还
原
反
应金属冶炼的原理:与还原剂共热C、H2、CO1、还原法2、置换法活泼金属比盐中金属活泼总结:例题: 100吨含Fe2O3的质量分数为85%的铁矿石中,可炼出含铁的质量分数为96%的生铁多少吨?用2000吨含Fe2O375%的铁矿石,最多可以冶炼出多少吨铁?CaCO3+H2O+CO2=Ca(HCO3)2易溶于水钟乳石、石笋和石柱的形成实验:产生气泡,一会下沉,一会又浮上来,不断地上下沉浮。 蛋壳变白,变薄。蛋壳没了,剩下鸡蛋膜.。练习:1、Ca → CaO → Ca(OH)2 →CaCO3 2、C → CO2 → H2CO3 → Na2CO3 3、Na+Cl2 == 4、CaO+SiO2 == 5、HCl+NaOH= 6、NaCl+AgNO3 = 11、Zn+H2SO4 = 7、Ca(OH)2+CO2 = 8、H2SO4+CuO = 9、HCl+AgNO3 = 10、Ca(OH)2+Na2CO3 = 12、Fe+CuSO4 = 高温点燃读图: 分析 两条纵线、四条横线、四条斜线和两条折线。一、两条纵线:
1、金属 → 金属氧化物 → 碱 → 盐
⑴ 金属 + 氧气 → 金属氧化物
⑵ 金属氧化物 + 水 → 碱(可溶性碱)
⑶ 碱 + 盐 → 新碱 + 新盐 2、非金属 → 非金属氧化物 → 酸 → 盐
⑴ 非金属 + 氧气 → 非金属氧化物
⑵ 非金属氧化物 + 水 → 酸
⑶ 酸 + 盐 → 新酸 + 新盐 常见无机物间相互关系二、四条横线:
1、金属 + 非金属 → 盐
2、金属氧化物 + 非金属氧化物 → 盐
3、碱 + 酸 → 盐 + 水
4、盐 + 盐 → 新盐 + 新盐三、四条斜线:
1、金属氧化物+酸→盐+水
2、非金属氧化物+碱→盐+水
3、碱+盐→新碱+新盐
4、酸+盐→新酸+新盐四、两条折线:
1、金属 + 酸 → 盐 + 氢气
2、金属 + 盐 → 金属 + 盐读图: 根据此图来说说酸具有哪些性质? 试分析制取盐的可能途径有几条?讨论:试设计ZnSO4四种方法。1.Zn + H2SO4 = ZnSO4 + H2↑
2.Zn + CuSO4 = ZnSO4 + Cu
3.ZnO + H2SO4 = ZnSO4 + H2O
4.Zn(OH)2 + H2SO4 = ZnSO4 + 2 H2O
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
